FORMULACION LIQUIDA INYECTABLE DE PARACETAMOL.
Formulación farmacéutica líquida inyectable de paracetamol que contiene paracetamol,
un disolvente acuoso, un agente taponante de pKa comprendido entre 4,5 y 6,5, un agente isotonisante y el dímero de paracetamol de fórmula (I) siguiente:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CH2004/000085.
Solicitante: NGUYEN-XUAN, THO.
Nacionalidad solicitante: Suiza.
Dirección: CHEMIN DU BON PIROUZ,1267 VICH.
Inventor/es: NGUYEN-XUAN,THO.
Fecha de Publicación: .
Fecha Concesión Europea: 21 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K31/167 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo el átomo de nitrogeno de un grupo carboxiamida unido directamente al ciclo aromático, p. ej. lidocaina, paracetamol.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
Clasificación PCT:
- A61K31/167 A61K 31/00 […] › teniendo el átomo de nitrogeno de un grupo carboxiamida unido directamente al ciclo aromático, p. ej. lidocaina, paracetamol.
- A61K9/08 A61K 9/00 […] › Soluciones.
Clasificación antigua:
- A61K31/167 A61K 31/00 […] › teniendo el átomo de nitrogeno de un grupo carboxiamida unido directamente al ciclo aromático, p. ej. lidocaina, paracetamol.
- A61K9/08 A61K 9/00 […] › Soluciones.
Fragmento de la descripción:
Formulación líquida inyectable de paracetamol.
La presente invención se refiere a una nueva formulación farmacéutica líquida inyectable de paracetamol que contiene un dímero de este principio activo, un procedimiento para preparar esta formulación, y la utilización de este dímero para estabilizar una formulación farmacéutica líquida de paracetamol.
El paracetamol (DCI del acetaminofeno o N-(4-hidroxifenil)-acetamida) es un analgésico y un antipirético ampliamente empleado en medio hospitalario. Es deseable disponer de formulaciones líquidas farmacéuticas estables de este principio activo para una administración por inyección, en particular para perfusión por vía intravenosa.
Se conoce que el paracetamol en solución acuosa es susceptible de sufrir una hidrólisis para formar el p-aminofenol, él mismo susceptible de degradarse en quinoneimina (véase por ejemplo J. E. Fairbrother, "Acetaminophen", en Analytical Profiles of Drug Substances, 1974, vol. 3, pág. 1-109). La velocidad de degradación del paracetamol crece con el aumento de la temperatura y de la luz. Esta velocidad es mínima a un pH cercano a 6 (K. T. Koshy et al, 1961, J. Pharm. Sci. 50, pág. 116-118).
Para estabilizar el paracetamol en solución, se conoce añadir un tampón y un agente antioxidante o captador de radicales.
La solicitud de patente internacional nº 02072080, por ejemplo, describe soluciones acuosas para perfusión estables de paracetamol que incluye un tampón de pH 5,5 a 6,5 y un agente antioxidante elegido entre el ácido ascórbico y un derivado portador de una función tiol tal como la cisteína o la acetil-cisteína.
La solicitud de patente europea nº 0916347 revela soluciones de paracetamol a base de una mezcla de agua y de disolventes alcohólicos que incluyen un tampón de pH 5,5 a 5,6 y metabisulfito como agente antioxidante.
Las soluciones inyectables estabilizadas de paracetamol del estado de la técnica presentan el inconveniente de provocar un efecto potencial irritante, alergénico y/o cancerígeno en algunos pacientes, debido a la toxicidad del agente antioxidante que contienen. Además, su estabilidad necesita la eliminación del oxígeno y otros oxidantes del medio acuoso. Por lo tanto, estas soluciones no pueden conservarse en toxicidad del agente antioxidante que contienen. Además, su estabilidad necesita la eliminación del oxígeno y otros oxidantes del medio acuoso. Estas soluciones no pueden, por lo tanto, conservarse en recipientes de material plástico parcialmente permeable al oxígeno o que incluye trazas de residuos de oxidantes.
La solicitud de patente MI2001A002135 (documento de prioridad de la solicitud de patente internacional nº 03/033026) aún no publicada revela soluciones acuosas inyectables estables de paracetamol obtenidas por mezcla de paracetamol con agua, propilenglicol y un tampón citrato (pH de 4,5 a 6,5), calentamiento de la solución obtenida a una temperatura comprendida entre 70 y 130ºC y mantenimiento de esta solución a esta temperatura durante al menos 10 minutos. Estas soluciones no contienen agente antioxidante tóxico, siendo el ácido cítrico un antioxidante débil ampliamente utilizado en la industria alimentaria.
D.W. Potter et al, 1985, J. Biol. Chem. 260, 22, pág.12174-80, divulgan la oxidación y la polimerización de paracetamol en solución acuosa por el peróxido de hidrógeno en presencia de peroxidasa de rábano blanco, el aislamiento por HPLC semipreparativa y la identificación por espectrometría de masa y espectroscopia RMN, de dos dímeros, dos trímeros y dos tetrámeros de paracetamol. Para una concentración de paracetamol superior a 0,2 mM, el dímero de fórmula (I) ("compuesto B") es muy mayoritario.
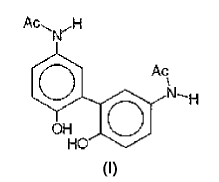
El problema o objetivo de la invención consiste en encontrar una nueva formulación farmacéutica líquida inyectable de paracetamol que sea estable durante una duración prolongada sin presentar los inconvenientes mencionados más arriba.
Este mismo dímero de paracetamol en muy baja cantidad parece actuar como antioxidante y permite pasar de los antioxidantes fuertes o tóxicos descritos para las soluciones estabilizadas de paracetamol del estado de la técnica.
La formulación de la invención presenta una excelente estabilidad a temperatura ambiente, e incluso a una temperatura aproximadamente de 40ºC, y se puede conservar en un recipiente de material plástico, en particular una bolsita de infusión, por ejemplo de polipropileno, polietileno, cloruro de polivinilo o de combinaciones de polímeros extrudados.
Este dímero de paracetamol puede ser sustituido por otro producto de polimerización del paracetamol, por ejemplo una mezcla de al menos dos oligómeros de paracetamol elegidos entre los dos dímeros, los dos trímeros y los dos tetrámeros del paracetamol descritos por D. W. Potter et al, 1985, referencia citada más arriba.
En general, esta formulación contiene al menos 0,005%, preferentemente al menos 0,05%, en relación de superficie de los picos HPLC con una detección a 245 nm, de dímero de paracetamol de fórmula (I).
La formulación de la invención puede contener de 0,1 a 5,0 g/100 ml, preferentemente de 0,4 a 1,5 g/100 ml de paracetamol.
El disolvente acuoso es agua, de calidad para inyectable, o una mezcla de agua y de uno o vario(s) disolvente(s) miscible(s) al agua, por ejemplo, el propilenglicol, el polietilenglicol, el etanol, y/o surfactantes tales como los polisorbatos, los poloxámeros. Si la tasa de paracetamol deseada en la solución sobrepasa 1,0 g/100 ml, el disolvente acuoso será preferentemente una mezcla de agua y disolvente(s) miscible(s) en agua.
La formulación de la invención contiene un agente taponante de pKa comprendido entre 4,5 a 6,5, preferentemente entre 5,0 a 6,2. Este agente taponante se elegirá, ventajosamente, entre el tampón citrato, el tampón fosfato, el tampón fosfato-citrato, el tampón bicarbonato, el tampón tartrato o el tampón acetato, preferentemente entre el tampón citrato, el tampón fosfato y el tampón fosfato-citrato, o una mezcla de estos tampones.
Esta formulación para inyección contiene un agente isotonisante, destinado a crear una presión osmótica cercana a la del suero fisiológico. Este agente isotonisanse te elije en general entre el cloruro de sodio o la glucosa.
La formulación de la invención en general se prepara en primer lugar por mezcla de paracetamol, de agua de calidad para inyectable, eventualmente de uno o varios otro(s) disolvente(s) miscible(s) al agua, y/o de surfactantes, de agente taponantes y de agente isotonisante, luego por calentamiento de la solución obtenida, a granel o ya rellenada en recipientes, a una temperatura de al menos 70ºC durante al menos 15 minutos. Este calentamiento tiene por objeto eliminar cualquier traza de nucleación que podría durante el almacenamiento de la solución desencadenar una recristalización del paracetamol.
La invención se refiere también a un procedimiento de preparación de la formulación definida más arriba, que comprende la mezcla de paracetamol, de agua, eventualmente de disolvente miscible al agua, y/o de surfactantes de agente taponante y de agente isotonisante, luego el calentamiento de la solución obtenida, a granel o ya rellenada en recipientes, a una temperatura de al menos 70ºC durante al menos 15 minutos.
El dímero de fórmula (I) parece formarse espontáneamente pero lentamente durante la conservación de la solución obtenida más arriba a una temperatura suficiente, por ejemplo de 60ºC.
Para formar in situ el dímero de fórmula (I), es práctico calentar la solución a una temperatura comprendida entre 100 y 130ºC, preferentemente entre 110 y 125ºC, durante un tiempo de al menos 5 minutos.
La invención se refiere también a un procedimiento para preparar la formulación definida más arriba que comprende el calentamiento de la solución a una temperatura comprendida entre 100 y 130ºC, preferentemente entre 110 y 125ºC, durante un tiempo de al menos 5 minutos.
La invención también se refiere a una formulación tal como se define más arriba susceptible de ser obtenida por este procedimiento.
La invención se refiere también a la utilización del dímero de fórmula (I) para estabilizar una formulación líquida de paracetamol. Este dímero se fabrica en general in situ en el seno de la formulación líquida...
Reivindicaciones:
1. Formulación farmacéutica líquida inyectable de paracetamol que contiene paracetamol, un disolvente acuoso, un agente taponante de pKa comprendido entre 4,5 y 6,5, un agente isotonisante y el dímero de paracetamol de fórmula (I) siguiente:
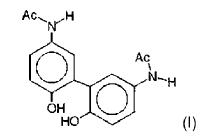
a excepción de una solución obtenida mezclando paracetamol con agua, con propilenglicol y un tampón citrato (pH de 4,5 a 6,5), calentando dicha solución de 70ºC a 130ºC y manteniéndola a dicha temperatura durante al menos 10 minutos.
2. Formulación según la reivindicación 1, caracterizada porque contiene al menos 0,005%, en relación de superficie de los picos HPLC con una detección a 245 nm, de dímero de paracetamol de fórmula (I).
3. Formulación según la reivindicación 1, caracterizada porque contiene al menos 0,05%, en relación de superficie de los picos HPLC con una detección a 245 nm, de dímero de paracetamol de fórmula (I).
4. Formulación según una cualquiera de las reivindicaciones anteriores, caracterizada porque contiene de 0,1 a 5,0 g/100 ml de paracetamol.
5. Formulación según una cualquiera de las reivindicaciones anteriores, caracterizada porque contiene a un agente taponante elegido entre el tampón citrato, el tampón fosfato, el tampón fosfato-citrato, el tampón bicarbonato, el tampón tartrato o el tampón acetato o una mezcla de estos tampones.
6. Formulación según una cualquiera de las reivindicaciones anteriores, caracterizada porque se puede obtener por un procedimiento que incluye el calentamiento de la solución a una temperatura comprendida entre 100 y 130ºC durante una duración de al menos 5 minutos.
7. Formulación según una cualquiera de las reivindicaciones anteriores en la cual el dímero de fórmula (I) es sustituido por otro producto de polimerización del paracetamol.
8. Procedimiento de preparación de una formulación según una cualquiera de las reivindicaciones anteriores, que comprende la mezcla de paracetamol, de agua, eventualmente de uno o varios disolvente(s) miscible(s) al agua, y/o de surfactantes, de agente taponante y de agente isotonisante, y el calentamiento de la solución a una temperatura de 70ºC durante al menos 15 minutos, después a una temperatura comprendida entre 100 y 130ºC durante una duración de al menos 5 minutos.
9. Utilización del dímero de fórmula (I) para estabilizar una formulación líquida de paracetamol, que no es una solución obtenida mezclando paracetamol con agua, con propilenglicol y un tampón citrato (pH de 4,5 a 6,5), calentando dicha solución de 70ºC a 130ºC y manteniéndola a dicha temperatura durante al menos 10 minutos.
10. Utilización de un recipiente de material plástico, en particular de una bolsita de infusión, para conservar una formulación según una cualquiera de las reivindicaciones 1 a 7.
Patentes similares o relacionadas:
Procedimiento de preparación de cápsula dura de hipromelosa por el uso de termogelificación, del 22 de Julio de 2020, de Suheung Co., Ltd: Un procedimiento de preparación de una cápsula dura de hipromelosa usando termogelificación con estabilidad durante almacenamiento, resistencia de película, distribución […]
Composición para el control de parásitos animales y método para el control de parásitos animales, del 15 de Julio de 2020, de MITSUI CHEMICALS AGRO, INC: Una composición para su uso en un método de tratamiento, en donde el método es para exterminar parásitos animales, comprendiendo la composición, […]
Uso de principios activos refrescantes fisiológicos y agentes que contienen tales principios activos, del 17 de Junio de 2020, de Symrise AG: Procedimiento no terapéutico para la modulación in-vitro del receptor de mentol frío TRPM8, en el que se lleva a contacto el receptor con al menos un modulador, que se selecciona […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Composición anestésica de uso tópico en forma de nanopartículas, del 13 de Mayo de 2020, de Biolab Sanus Farmacêutica Ltda: Una composición anestésica en forma de hidrogel de aplicación tópica sobre la piel o las mucosas, que lleva: (i) una suspensión de nanocápsulas […]
Compuestos de sulfonamida inversa a base de sulfuro, alquilo y piridilo para el tratamiento del VHB, del 13 de Mayo de 2020, de Novira Therapeutics Inc: compuesto de Fórmula IIIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo; en la que cada R1 se selecciona independientemente de H, halo […]
Partículas de inhalación que comprenden una combinación de un anticolinérgico, un corticoesteroide y un beta-adrenérgico, del 22 de Abril de 2020, de CHIESI FARMACEUTICI S.P.A.: Micropartículas multicomponentes para uso en una formulación para inhalación, cada micropartícula comprende una combinación de dipropionato de […]
Composición farmacéutica, del 25 de Marzo de 2020, de Mexichem Fluor S.A. de C.V: Una composición farmacéutica que comprende: (i) al menos un compuesto de formoterol seleccionado entre formoterol, sales farmacéuticamente […]