Formulación farmacéutica que comprende uno o más éstreres de ácido fumárico en una matriz de erosión.
Formulación farmacéutica en forma de un comprimido de matriz de erosión que comprende:
i) del 10% al 80% en peso de uno o más ésteres de ácido fumárico seleccionados de diésteres alquílicos (C1-C5) de ácido fumárico y monoésteres alquílicos (C1-C5) de ácido fumárico, o una sal farmacéuticamente aceptable de los mismos, como principio activo;
ii) el 1-50% en peso de uno o más agentes de control de velocidad; y
un recubrimiento entérico, en la que dicho recubrimiento entérico se aplica a un nivel del 1,5-3,5% en peso del núcleo, en la que la erosión de dicha matriz de erosión permite la liberación controlada o sostenida de dicho principio activo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2010/050172.
Solicitante: Forward Pharma A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: Ostergade 24 A 1. 1100 Kobenhavn K DINAMARCA.
Inventor/es: NILSSON, HENRIK, RUPP, ROLAND.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/215 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › de ácidos carboxílicos.
- A61K9/28 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Grageas; Píldoras o comprimidos con revestimientos.
- A61P17/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 17/00 Medicamentos para el tratamiento de problemas dermatológicos. › para el tratamiento de la psoriasis.
PDF original: ES-2411972_T3.pdf
Fragmento de la descripción:
Formulación farmacéutica que comprende uno o más ésteres de ácido fumárico en una matriz de erosión
Campo de la invención La presente invención se refiere a una formulación farmacéutica que comprende una matriz de erosión. Más particularmente la invención se refiere a una formulación farmacéutica que comprende una matriz erosionable que comprende uno o más ésteres de ácido fumárico así como uno o más agentes de control de velocidad, en la que la erosión de dicha matriz de erosión permite la liberación controlada o sostenida de dichos ésteres de ácido fumárico.
Antecedentes de la invención La psoriasis es una enfermedad crónica de la piel, con un alto porcentaje de predisposición genética. La enfermedad fluctúa entre un agravamiento agudo y épocas de paralización completa. Los pacientes que presentan psoriasispueden estar gravemente incapacitados por las características externas de la enfermedad. Ésta afecta a todas las partes de la vida, tales como la carrera profesional así como la vida personal y privada.
Las posibilidades terapéuticas disponibles hasta la terapia según la invención son limitadas, en particular para pacientes con psoriasis de moderada a grave, y muchas de ellas sólo proporcionan una mejora temporal y a corto plazo, y/o tienen graves efectos adversos/efectos secundarios. Puesto que la psoriasis tiene una alta tasa de recurrencia, la mayoría de los pacientes han de someterse a tratamiento a largo plazo.
Se han usado los ésteres de ácido fumárico para el tratamiento de psoriasis de moderada a grave durante más de 30 años. En 1994, se aprobó una mezcla definida de sales de fumarato de dimetilo y fumarato de monoetilo en Alemania, Fumaderm® initial / Fumaderm®. Un comprimido con recubrimiento entérico de Fumaderm® contiene los siguientes principios activos: 120 mg de fumarato de dimetilo; 87 mg de sal de calcio de hidrogenofumarato de etilo; 5 mg de sal de magnesio de hidrogenofumarato de etilo; 3 mg de sal de zinc de hidrogenofumarato de etilo, y los siguientes otros componentes: croscarmelosa sódica, talco, estearato de magnesio, agentes colorantes E 171 y E 132, copolímero de ácido metacrílico-metacrilato de metilo (1:1) , copolímero de ácido metacrílico-acrilato de etilo (1:1) , Macrogol 6000, simeticona, povidona, citrato de trietilo, celulosa microcristalina, dióxido de silicio altamente disperso [Resumen de Características del Producto, Fumaderm®, versión de enero de 2009]. Hoy en día, Fumaderm® representa aproximadamente el 66% de todas las prescripciones para la terapia sistémica de psoriasis en Alemania. Sin embargo, una alta frecuencia de efectos secundarios provoca la interrupción temprana de algunos pacientes en tratamiento. Se contempla que los efectos secundarios gastrointestinales y los sofocos pueden explicarse, al menos parcialmente, por las propiedades de liberación de la formulación de prescripción, que conducen a altas concentraciones locales en el intestino.
Los presentes inventores contemplan que puede obtenerse un régimen de tratamiento mejorado mediante la administración de una composición farmacéutica que está diseñada para suministrar el principio activo de manera controlada, es decir de manera que se prolonga, se sostiene, se retarda, se ralentiza y/o se retrasa en comparación con el producto disponible comercialmente.
Los ésteres de ácido fumárico, tales como fumarato de dimetilo, pueden estar sujetos a degradación e hidrólisis. Se sabe, por ejemplo, que el fumarato de dimetilo es más propenso a la hidrólisis en un entorno alcalino/menos ácido en comparación con entornos más ácidos (Litjens et al, “In vitro pharmacokinetics of anti-psoriatic fumaric acid esters”, BMC Pharmacology 2004, 4:22) . Por tanto, se considera que el fumarato de dimetilo es más propenso a la hidrólisis en el intestino delgado en comparación con el ventrículo gástrico. Además del efecto del pH descrito anteriormente, se considera que las esterasas contribuyen a la hidrólisis de ésteres de ácido fumárico.
El documento WO 2006/037342 da a conocer composiciones farmacéuticas de liberación controlada que comprenden éster (es) de ácido fumárico como principio (s) activo (s) en las que el perfil de liberación controlada da como resultado una reducción en los efectos secundarios relacionados GI (gastrointestinales) .
Objeto de la invención Es un objeto de las realizaciones de la invención proporcionar una formulación farmacéutica de liberación controlada
controlada o sostenida que comprende éster (es) de ácido fumárico como principio (s) activo (s) que muestra una biodisponibilidad relativa adecuada en comparación con, por ejemplo, la formulación de la técnica anterior Fumaderm®. Específicamente, es un objeto de la presente invención proporcionar una formulación farmacéutica de liberación controlada o sostenida que comprende éster (es) de ácido fumárico como principio (s) activo (s) que muestra una variabilidad reducida en los valores de AUC y/o Cmax con respecto a la formulación de la técnica anterior Fumaderm®.
Sumario de la invención Se ha encontrado por el/los presente (s) inventor (es) que puede obtenerse una liberación controlada o sostenida de uno o más ésteres de ácido fumárico mediante un comprimido de matriz de erosión. La prolongación de la liberación de API puede controlarse con la cantidad de polímero (s) de control de velocidad en relación con los demás componentes y se contempla que pueden evitarse o reducirse las altas concentraciones locales del API.
Se ha encontrado que puede obtenerse una liberación controlada o sostenida de uno o más ésteres de ácido fumárico a un nivel farmacéuticamente relevante a partir de, en comparación con Fumaderm®, un comprimido pequeño con el fin de mejorar el cumplimiento por parte del paciente, y en el que pueden evitarse las altas concentraciones locales del API a la vez que se garantiza un suministro tan completo como sea posible del principio activo en el plazo de un periodo de tiempo definido tras alcanzar el sitio de absorción, y en el que puede proporcionarse al mismo tiempo una variabilidad reducida, en comparación con Fumaderm®.
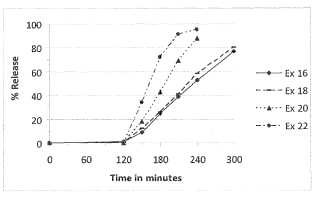
Se ha encontrado que formulaciones según la invención presentan una buena correlación in vitro/in vivo. En un aspecto, la correlación in vitro/in vivo se determina comparando el tiempo hasta que se libera el 80% del éster de ácido fumárico desde las formulaciones en una prueba de disolución in vitro con la Cmax que se mide in vivo tras la administración de las formulaciones.
Se contempla además por los presentes inventores que la liberación controlada del API mediante erosión de la matriz minimiza o reduce la exposición del API a hidrólisis dentro del tracto gastrointestinal, mitigando de ese modo la degradación del API antes de la absorción.
En un primer aspecto, se contempla que es posible mediante el presente documento retener el efecto del tratamiento mientras que al mismo tiempo se reduce sustancialmente algunos o varios de los efectos secundarios o efectos adversos no deseados conocidos de Fumaderm®, o se mejora la tolerabilidad en comparación con Fumaderm®.
En otro aspecto, se contempla que es posible mediante el presente documento obtener un efecto del tratamiento mejorado en comparación con Fumaderm® mientras que al mismo tiempo se reducen los efectos secundarios no deseados conocidos de dicho tratamiento de psoriasis de la técnica anterior, Fumaderm®.
En otro aspecto, se contempla que es posible mediante el presente documento obtener un efecto del tratamiento mejorado mientras que al mismo tiempo se mantiene la tolerabilidad en comparación con Fumaderm®.... [Seguir leyendo]
Reivindicaciones:
1. Formulación farmacéutica en forma de un comprimido de matriz de erosión que comprende:
i) del 10% al 80% en peso de uno o más ésteres de ácido fumárico seleccionados de diésteres alquílicos (C1-C5) de ácido fumárico y monoésteres alquílicos (C1-C5) de ácido fumárico, o una sal farmacéuticamente aceptable de los mismos, como principio activo;
ii) el 1-50% en peso de uno o más agentes de control de velocidad; y
un recubrimiento entérico, en la que dicho recubrimiento entérico se aplica a un nivel del 1, 5-3, 5% en peso del núcleo,
en la que la erosión de dicha matriz de erosión permite la liberación controlada o sostenida de dicho principio activo.
2. Formulación farmacéutica según la reivindicación 1 que comprende:
i) del 30% al 60% en peso de uno o más ésteres de ácido fumárico seleccionados de diésteres alquílicos (C1-C5) de ácido fumárico y monoésteres alquílicos (C1-C5) de ácido fumárico, o una sal farmacéuticamente aceptable de los mismos, como principio activo;
ii) el 3-40% en peso de uno o más agentes de control de velocidad.
3. Formulación farmacéutica según la reivindicación 1 ó 2, en la que la matriz de erosión es una matriz de erosión monolítica.
4. Formulación según cualquiera de las reivindicaciones anteriores, en la que el agente de control de velocidad es un polímero soluble en agua.
5. Formulación según cualquiera de las reivindicaciones anteriores, en la que el agente de control de velocidad es un polímero de celulosa o un derivado de celulosa o una mezcla de los mismos.
6. Formulación según la reivindicación 5, en la que el agente de control de velocidad se selecciona del grupo que comprende hidroxipropilcelulosa, hidroxipropilmetilcelulosa (HPMC) , metilcelulosa, carboximetilcelulosa y mezclas de las mismas.
7. Formulación según la reivindicación 6, en la que el agente de control de velocidad es hidroxipropilcelulosa.
8. Formulación según cualquiera de las reivindicaciones anteriores, que comprende además un aglutinante.
9. Formulación según la reivindicación 8, en la que dicho aglutinante es lactosa.
10. Formulación según cualquiera de las reivindicaciones anteriores, que comprende: i) del 40% al 60% en peso de uno o más ésteres de ácido fumárico seleccionados de diésteres alquílicos (C1-C5)
de ácido fumárico y monoésteres alquílicos (C1-C5) de ácido fumárico, o una sal farmacéuticamente aceptable de los mismos, como principio activo; ii) el 4-6% en peso de un agente de control de velocidad; iii) e.
3. 55% en peso de un aglutinante.
11. Formulación según cualquiera de las reivindicaciones 1-9, que comprende: i) del 30% al 60% en peso de uno o más ésteres de ácido fumárico seleccionados de diésteres alquílicos (C1-C5)
de ácido fumárico y monoésteres alquílicos (C1-C5) de ácido fumárico, o una sal farmacéuticamente aceptable de los mismos, como principio activo; ii) el 3-6% en peso de un agente de control de velocidad; iii) e.
3. 65% en peso de un aglutinante.
12. Formulación según cualquiera de las reivindicaciones anteriores, en la que la liberación del éster de ácido fumárico, cuando se somete a una prueba de disolución in vitro empleando ácido clorhídrico 0, 1 N como medio de disolución durante las 2 primeras horas de la prueba y luego tampón fosfato 0, 05 M, pH 6, 8 como medio de
disolución, es de la siguiente manera:
en el plazo de las 2 primeras horas tras el inicio de la prueba se libera desde aproximadamente el 0% p/p hasta aproximadamente el 50% p/p del éster fumárico contenido en la formulación, y/o en el plazo de las 3 primeras horas tras el inicio de la prueba se libera desde aproximadamente el 20% p/p hasta aproximadamente el 75% p/p de la cantidad total del éster de ácido fumárico contenido en la formulación.
13. Formulación según una cualquiera de las reivindicaciones anteriores, en la que el éster de ácido fumárico es un monoéster alquílico (C1-C5) de ácido fumárico que está presente en forma de una sal farmacéuticamente aceptable.
14. Formulación según una cualquiera de las reivindicaciones anteriores, que comprende fumarato de dimetilo como principio activo.
15. Formulación según cualquiera de las reivindicaciones anteriores, que comprende: i) del 40% al 55% en peso de fumarato de dimetilo; ii) el 4-6% en peso de hidroxipropilcelulosa; iii) e.
3. 55% en peso de lactosa.
16. Formulación según cualquiera de las reivindicaciones 1-14, que comprende : i) del 30% al 60% en peso de fumarato de dimetilo; ii) el 3-6% en peso de hidroxipropilcelulosa; iii) e.
3. 65% en peso de lactosa.
17. Método para preparar la formulación según cualquiera de las reivindicaciones 1-16, que comprende las etapas
de: a) disolver o suspender un agente de control de velocidad en forma de un material de matriz polimérica en agua para obtener una suspensión acuosa del mismo;
b) pulverizar dicha suspensión acuosa sobre gránulos de un éster de ácido fumárico durante un periodo de tiempo suficiente para obtener un recubrimiento uniforme sobre los mismos; c) secar los gránulos obtenidos;
d) opcionalmente tamizar o moler dichos gránulos; e) combinar cualquier excipiente y aditivo farmacéuticamente aceptable de manera conocida en sí misma para obtener una formulación de comprimido;
f) aplicar un recubrimiento entérico a dicha formulación de comprimido de manera conocida en sí misma; en el que se realizan las etapas anteriores a una temperatura para permitir que la temperatura de producto no supere los 45ºC.
18. Método para preparar la formulación según cualquiera de las reivindicaciones 1-16, que comprende las etapas de:
a) opcionalmente tamizar o moler cristales de éster de ácido fumárico;
b) combinar dichos cristales de éster de ácido fumárico, un agente de control de velocidad en forma de un material de matriz polimérica, y cualquier excipiente y aditivo farmacéuticamente aceptable mediante compresión directa para obtener una formulación de comprimido;
c) aplicar un recubrimiento entérico a dicha formulación de comprimido de manera conocida en sí misma;
en el que se realizan las etapas anteriores a una temperatura para permitir que la temperatura de producto no supere los 45ºC.
19. Método según la reivindicación 18, en el que los cristales de éster de ácido fumárico se tamizan o se muelen de tal manera que el 90% de las partículas tienen un tamaño de partícula en el intervalo de 5-1000 !m.
20. Formulación farmacéutica según cualquiera de las reivindicaciones 1-16, para su uso para el tratamiento de
psoriasis, artritis psoriásica, neurodermatitis, enfermedad inflamatoria del intestino, tal como enfermedad de Crohn y colitis ulcerosa, poliartritis, esclerosis múltiple (EM) , diabetes mellitus juvenil, tiroiditis de Hashimoto, enfermedad de Graves, LES (lupus eritematoso sistémico) , síndrome de Sjögren, anemia perniciosa, hepatitis crónica activa (lupoide) , artritis reumatoide (AR) , nefritis debida a lupus, miastenia grave, uveítis, uveítis que no responde al tratamiento, conjuntivitis primaveral, pénfigo vulgar, esclerodermia, neuritis óptica, dolor tal como dolor radicular, dolor asociado con radiculopatía, dolor neuropático o ciática/dolor ciático, trasplante de órganos (prevención de rechazo) , sarcoidosis, necrobiosis lipídica o granuloma anular.
21. Uso de una formulación farmacéutica según una cualquiera de las reivindicaciones 1-16, para la preparación de un medicamento para el tratamiento de psoriasis, artritis psoriásica, neurodermatitis, enfermedad inflamatoria del 15 intestino, tal como enfermedad de Crohn y colitis ulcerosa, poliartritis, esclerosis múltiple (EM) , diabetes mellitus juvenil, tiroiditis de Hashimoto, enfermedad de Graves, LES (lupus eritematoso sistémico) , síndrome de Sjögren, anemia perniciosa, hepatitis crónica activa (lupoide) , artritis reumatoide (AR) , nefritis debida a lupus, miastenia grave, uveítis, uveítis que no responde al tratamiento, conjuntivitis primaveral, pénfigo vulgar, esclerodermia, neuritis óptica, dolor tal como dolor radicular, dolor asociado con radiculopatía, dolor neuropático o ciática/dolor
ciático, trasplante de órganos (prevención de rechazo) , sarcoidosis, necrobiosis lipídica o granuloma anular.
Patentes similares o relacionadas:
Derivados de benzoxazinona para el tratamiento de enfermedades cutáneas, del 29 de Julio de 2020, de Sixera Pharma AB: Un compuesto según la Fórmula I **(Ver fórmula)** en donde R es -S-CH3 o -Cl, o una sal farmacéuticamente aceptable del mismo.
Composiciones tópicas que comprenden un corticosteroide y un retinoide para tratar la psoriasis, del 1 de Julio de 2020, de Bausch Health Ireland Limited: Una composición farmacéutica tópica para usar en el tratamiento de la psoriasis, la composición que comprende: (a) propionato de halobetasol […]
Derivado de amina cíclica y uso farmacéutico del mismo, del 1 de Julio de 2020, de TORAY INDUSTRIES, INC.: Un derivado de amina cíclica representado por la siguiente fórmula general (I): **(Ver fórmula)** donde R1 representa un grupo alquiloxi que tiene de 1 a 3 átomos […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Sales de butirato para uso en enfermedades inflamatorias, del 17 de Junio de 2020, de Birrbeheer B.V: Una preparación que comprende una sal de butirato para uso en el tratamiento de un sujeto que padece una enfermedad que está asociada con inflamación sistémica, […]
Amidas heterocíclicas como inhibidores de quinasa, del 3 de Junio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto que es **(Ver fórmula)** o un tautómero del mismo o una sal del mismo.
Composición farmacéutica tópica a base de alcanos semifluorados, del 13 de Mayo de 2020, de NOVALIQ GMBH: Una composición farmacéutica tópica para usar en la prevención o el tratamiento de una enfermedad o afección que afecta la piel o un apéndice de la piel, que comprende […]
Purina dionas como moduladores de la ruta de Wnt, del 29 de Abril de 2020, de AGENCY FOR SCIENCE, TECHNOLOGY AND RESEARCH: Un compuesto que tiene la estructura (I) **(Ver fórmula)** o una sal del mismo; en el que: R1, R2, R3, R4 y R5 son cada uno, independientemente, […]