FORMULACIÓN EN COMPRIMIDOS DE LIBERACIÓN EXTENDIDA QUE CONTIENE PRAMIPEXOL O UNA DE SUS SALES FARMACÉUTICAMENTE ACEPTABLES, MÉTODO PARA SU FABRICACIÓN Y SU USO.
Una formulación en comprimidos de liberación extendida que comprende pramipexol,
o su sal farmacéuticamente aceptable, en una matriz que comprende al menos un polímero que se expande en agua distinto del almidón pregelatinizado, y en la que al menos uno de los al menos dos polímeros es un polímero aniónico
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/053602.
Solicitante: BOEHRINGER INGELHEIM INTERNATIONAL GMBH.
Nacionalidad solicitante: Alemania.
Dirección: BINGER STRASSE 173 55216 INGELHEIM AM RHEIN ALEMANIA.
Inventor/es: FRIEDL, THOMAS, DR., EISENREICH,Wolfram.
Fecha de Publicación: .
Fecha Solicitud PCT: 25 de Julio de 2005.
Clasificación Internacional de Patentes:
- A61K9/20H6B
- A61K9/20H6D
- A61K9/20H6F2
- A61K9/20H6F4
- A61K9/28K
Clasificación PCT:
- A61K31/428 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con carbociclos.
- A61K31/4745 A61K 31/00 […] › condensados con sistemas cíclicos teniendo el nitrógeno como heteroátomo de un ciclo, p. ej. fenantrolinas (derivados de la yohimbina, vinblastina A61K 31/475; derivados de la ergolina A61K 31/48).
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención está dirigida a una formulación en comprimidos de liberación extendida que contiene pramipexol o una de sus sales farmacéuticamente 5 aceptables, a un método para su fabricación y a su uso.
ANTECEDENTES DE LA INVENCIÓN
Pramipexol es un agonista del receptor de dopamina D2 conocido. Es 10 estructuralmente diferente de los fármacos derivados del cornezuelo del centeno, por ejemplo bromocriptina o pergolida. También es exclusivo desde el punto de vista farmacológico, porque es un agonista completo y tiene selectividad de receptor por la familia dopamina D2 de receptores de dopamina.
Pramipexol se designa químicamente como (S)-2-amino-4,5,6,7-tetrahidro-6-15 (propilamino)benzotiazol, y tiene la fórmula molecular C10H17N3S y una masa molecular relativa de 211,33. La fórmula química es la siguiente:
SNNNH2H
20
La forma salina que se utiliza habitualmente es el dihidrocloruro de pramipexol monohidrato (fórmula molecular C10H21Cl2N3OS; masa molecular relativa 302,27). El dihidrocloruro de pramipexol monohidrato es un polvo cristalino insípido, de color blanco a blancuzco. Se funde en el intervalo de 296°C a 301°C, con descomposición. El pramipexol es un compuesto quiral con un centro quiral. El (S)-enantiómero puro se 25 obtiene a partir del proceso sintético mediante recristalización quiral de uno de los intermedios durante la síntesis.
El dihidrocloruro de pramipexol monohidrato es un compuesto muy soluble. La solubilidad en agua es más de 20 mg/ml, y la solubilidad en un medio tampón es, en general, mayor que 10 mg/ml entre pH 2 y pH 7,4. El dihidrocloruro de pramipexol 30 monohidrato no es higroscópico y tiene una naturaleza muy cristalina. Después de una trituración no cambia la modificación de los cristales (monohidrato). El pramipexol es muy estable en estado sólido, pero en disolución es sensible a la luz.
Los comprimidos de liberación inmediata ("immediate release", IR) de pramipexol se autorizaron, en primer lugar, en EE.UU. en 1997, seguido, en el transcurso de los años siguientes, de autorizaciones de comercialización en la Unión Europea (UE), Suiza, Canadá y Sudamérica, así como en países de la Europa del Este, Cercano Oriente y Asia.
En UE y EE.UU., los comprimidos de pramipexol IR están indicados para el 5 tratamiento de las señales y los síntomas de la enfermedad de Parkinson temprana o enfermedad de Parkinson avanzada, en combinación con levodopa. Los comprimidos IR deben tomarse 3 veces al día.
Desde el punto de vista farmacocinético, los comprimidos de pramipexol IR se absorben rápida y completamente después de su administración oral. La biodisponibilidad 10 absoluta es mayor que 90%, y la máxima concentración en plasma se produce entre 1 a 3 horas. La ingesta de alimentos disminuye la velocidad de absorción, pero no el grado global de absorción. El pramipexol muestra una cinética lineal y una variación entre pacientes de los niveles plasmáticos relativamente baja. La semivida de eliminación (t1/2[h]) varía de 8 horas en los jóvenes a 12 horas en los mayores. 15
Como se conoce habitualmente, un o unos ingredientes activos de liberación modificada permiten simplificar el programa de administración del paciente, reduciendo la cantidad de tomas diarias recomendadas, mejoran el cumplimiento por parte del paciente, y atenúan los acontecimientos adversos, por ejemplo relacionados con unos elevados picos plasmáticos. Las preparaciones farmacéuticas de liberación modificada regulan la 20 liberación del ingrediente o ingredientes activos incorporados a lo largo del tiempo, y comprenden formulaciones con una liberación controlada, prolongada, sostenida, retrasada, lenta o extendida, de modo que consiguen los objetivos terapéuticos o de comodidad que no ofrecen las formas de dosificación convencionales, como disoluciones o formas de dosificación de disolución inmediata. 25
Una liberación modificada o extendida de un o unos ingredientes activos a partir de una preparación farmacéutica puede lograrse mediante la inmersión homogénea de dicho o dichos ingredientes activos en una matriz hidrófila, que es una red soluble, parcialmente soluble o insoluble de polímeros hidrófilos viscosos, que se mantienen juntos mediante enredamientos físicos o químicos, mediante interacciones iónicas o 30 cristalinas, mediante formación de complejos, mediante enlaces hidrógeno o fuerzas de van der Waals. Dicha matriz hidrófila se expande tras ponerse en contacto con el agua, creando, con ello, una capa gelificada protectora desde la cual el o los ingredientes activos se liberan a lo largo del tiempo de forma lenta, gradual y continua, mediante difusión a través de la red polimérica, mediante erosión de la capa gelificada, mediante 35
disolución del polímero, o mediante una combinación de dichos mecanismos de liberación.
Sin embargo, se ha demostrado difícil formular un comprimido que tenga una combinación adecuada de propiedades modificadas, de liberación extendida o sostenida, y de manipulación, en que el fármaco tengra una solubilidad relativamente alta, como en 5 el caso del dihidrocloruro de pramipexol.
Existe una serie de enfoques, descritos en la técnica anterior, para proporcionar composiciones de comprimidos de liberación sostenida de pramipexol:
El documento WO 2004/010997 describe una composición farmacéutica de liberación sostenida en forma de un comprimido que puede administrarse por vía oral, 10 que comprende una sal soluble en agua de pramipexol, dispersa en una matriz que comprende un polímero hidrófilo y un almidón que tiene una resistencia a la tracción de al menos aproximadamente 0,15 kN cm-2, preferiblemente al menos aproximadamente 0,175 kN cm-2, y más preferiblemente al menos aproximadamente 0,2 kN cm-2, en una fracción sólida representativa del comprimido. Su memoria descriptiva se concentra en 15 proporcionar una composición con un rendimiento de dureza suficiente durante una operación de formación de comprimidos de alta velocidad, en particular para resistir la erosión durante la aplicación de una capa de revestimiento.
Según una realización preferida, se proporciona una composición farmacéutica en forma de un comprimido que puede administrarse por vía oral, que tiene un núcleo que 20 comprende dihidrocloruro de pramipexol monohidrato en una cantidad de aproximadamente 0,375, 0,75, 1,5, 3 ó 4,5 mg, disperso en una matriz que comprende (a) HPMC de tipo 2208 en una cantidad de aproximadamente 35% a aproximadamente 50% en peso del comprimido, y (b) un almidón pregelatinizado que tiene una resistencia a la tracción de al menos aproximadamente 0,15 kN cm-2 en una fracción sólida de 0,8, en 25 una cantidad de aproximadamente 45% a aproximadamente 65% en peso del comprimido; estando dicho núcleo sustancialmente encerrado en un revestimiento que constituye de aproximadamente 2% a aproximadamente 7% del peso del comprimido, comprendiendo dicho revestimiento un componente hidrófobo con una base de etilcelulosa o un componente insoluble en agua, y un componente formador de poros con 30 una base de HPMC en una cantidad de aproximadamente 10% a aproximadamente 40% en peso del componente con una base de etilcelulosa.
Además, el documento WO 2004/010999 describe una composición farmacéutica que puede administrarse por vía oral que comprende una cantidad terapéuticamente eficaz de pramipexol, o una de sus sales farmacéuticamentes aceptables, y al menos un 35 excipiente farmacéuticamente aceptable, mostrando dicha composición al menos uno de
(a) un perfil de liberación in vitro en el que, de media, no más de aproximadamente 20% del pramipexol se disuelve en el espacio de 2 horas después de colocar la composición en un ensayo de disolución convencional; y (b) un perfil de absorción del pramipexol in vivo después de la administración oral de una dosis individual a seres humanos adultos sanos, en el que el tiempo para alcanzar una media de 20% de absorción es mayor que 5 aproximadamente 2 horas y/o el tiempo para alcanzar una media de 40% de absorción es mayor que aproximadamente 4 horas. Sin embargo, en el uso práctico, parece que cualquier formulación que tenga un perfil de liberación extendida o controlada diseñada para la aplicación una vez al día cumpliría los anteriores requerimientos, para los cuales no existen unas indicaciones generales sobre la manera...
Reivindicaciones:
1. Una formulación en comprimidos de liberación extendida que comprende pramipexol, o su sal farmacéuticamente aceptable, en una matriz que comprende al menos un polímero que se expande en agua distinto del almidón pregelatinizado, y en la que al menos uno de los al menos dos polímeros es un polímero aniónico. 5
2. La formulación en comprimidos de liberación extendida de la reivindicación 1, en la que el polímero aniónico se selecciona del grupo de polímeros del ácido acrílico opcionalmente reticulados, polímeros del ácido metacrílico, alginatos y carboximetilcelulosa.
3. La formulación en comprimidos de liberación extendida de la reivindicación 2, 10 en la que el polímero aniónico es un polímero del ácido acrílico opcionalmente reticulado, y en la que el contenido del polímero del ácido acrílico opcionalmente reticulado en la matriz es desde aproximadamente 0,25% en peso a aproximadamente 25% en peso, y preferiblemente de aproximadamente 0,5% en peso a aproximadamente 15% en peso, y preferiblemente de aproximadamente 1% en peso a aproximadamente 10% en peso. 15
4. La formulación en comprimidos de liberación extendida de la reivindicación 1, en la que al menos uno de los al menos dos polímeros es un polímero sustancialmente neutro distinto del almidón pregelatinizado.
5. La formulación en comprimidos de liberación extendida de la reivindicación 4, en la que el polímero sustancialmente neutro se selecciona de hidroxipropilcelulosa e 20 hidroxipropilmetilcelulosa.
6. La formulación en comprimidos de liberación extendida de la reivindicación 4, en la que el polímero sustancialmente neutro es hidroxipropilmetilcelulosa, y en la que el contenido de hidroxipropilmetilcelulosa en la matriz es de aproximadamente 10% en peso a aproximadamente 75% en peso, y preferiblemente de aproximadamente 25% en peso a 25 aproximadamente 65% en peso.
7. La formulación en comprimidos de liberación extendida de la reivindicación 4, en la que la matriz comprende aproximadamente:
(a) pramipexol, o su sal 0,05 a 5% en peso (b) polímero(s) que se edxpande(n) en agua aniónico(s) 0,25 a 25% en peso 30
(c) polímero(s) que se expande(n) en agua neutro(s) 10 a 75% en peso (d) otros excipientes hasta 100% en peso
8. La formulación en comprimidos de liberación extendida de la reivindicación 1, que consiste en dihidrocloruro de pramipexol monohidrato, hipromelosa 2208, almidón de maíz, carbómero 941, dióxido de silicio coloidal y estearato de magnesio. 5
9. La formulación en comprimidos de liberación extendida de acuerdo con la reivindicación 1, proporcionando el comprimido resultante una característica de liberación dependiente del pH con una característica de liberación más rápida en el intervalo de pH < 4,5, y una característica de liberación más lenta y además independiente del pH en el intervalo de pH 4,5 a 7,5. 10
10. La formulación en comprimidos de liberación extendida según cualquiera de las reivindicaciones precdentes, en la que la cantidad contenida de pramipexol, o su sal farmacéuticamente aceptable es suficiente para proporcionar una dosis diaria administrada de una vez.
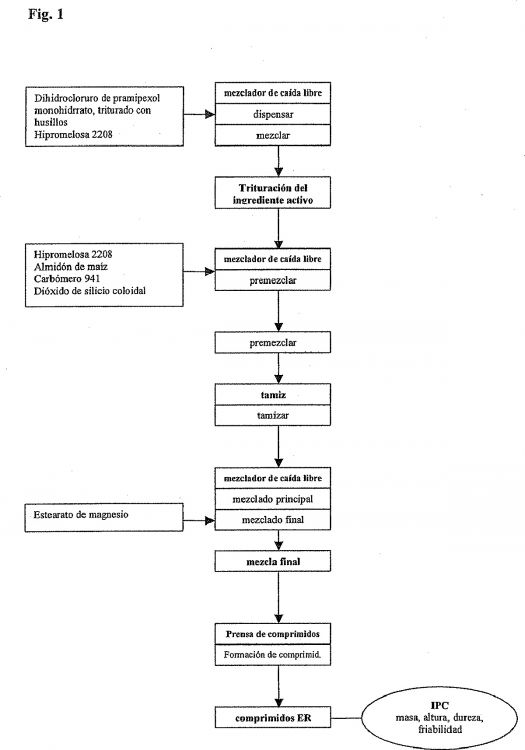
11. Método para fabricar la formulación en comprimidos de liberación extendida según 15 una de las anteriores reivindicaciones 1 a 10, mediante un proceso de compresión directa que comprende las etapas de
(1) producir una trituración del ingrediente activo, en la que el ingrediente activo es pramipexol, o su sal farmacéuticamente aceptable, mediante su premezcla con una porción de polímero(s) que se expande(n) en agua y/u otro(s) excipiente(s) 20 en un mezclador, en donde se tritura el pramipexol, o su sal farmacéuticamente aceptable, preferiblemente se tritura con husillos, antes del uso;
(2) premezclar la trituración del ingrediente activo de la etapa (1), la porción principal del o de los polímeros que se expanden en agua y/o excipientes en un mezclador para obtener una premezcla; 25
(3) opcionalmente, tamizar en seco la premezcla a través de un tamiz para segregar las partículas cohesivas y mejorar la uniformidad del contenido;
(4) mezclar la premezcla de la etapa (2) o (3) en un mezclador, opcionalmente mediante la adición del resto de los excipientes a la mezcla y continuar el mezclado; y 30
(5) formar comprimidos de la mezcla final mediante su compresión en una prensa para comprimidos adecuada para producir comprimidos de matriz.
12. Método para fabricar la formulación en comprimidos de liberación extendida según una de las anteriores reivindicaciones 1 a 10, mediante un proceso de granulación en húmedo que comprende las etapas de 35
(1) producir una trituración del ingrediente activo, en la que el ingrediente activo es pramipexol, o su sal farmacéuticamente aceptable, mediante su mezcla con una porción de los excipientes en un mezclador, en donde se tritura el pramipexol, o su sal farmacéuticamente aceptable, preferiblemente se tritura con husillos, antes del uso; 5
(2) granular la trituración del ingrediente activo de la etapa (1) mediante la adición de un líquido de granulación, preferiblemente agua;
(3) secar los gránulos de la etapa (2) en un secador de lecho fluido o en una estufa de secado;
(4) mezclar los gránulos secos de la etapa (3) con el o los polímeros que se 10 expanden en agua y/o excipiente(s) en un mezclador para obtener la mezcla final;
(5) formar comprimidos de la mezcla final de la etapa (4) mediante su compresión en una prensa para comprimidos adecuada para producir comprimidos de matriz.
13. Método para fabricar la formulación en comprimidos de liberación extendida según 15 una de las anteriores reivindicaciones 1 a 10, mediante un proceso de granulación en seco, que comprende las etapas de
(1) mezclar el ingrediente activo pramipexol, o su sal farmacéuticamente aceptable, con una porción de las cargas o todos los excipientes en un mezclador, en donde se tritura el pramipexol, o su sal farmacéuticamente aceptable, 20 preferiblemente se tritura con husillos, antes del uso;
(2) compactar la mezcla de la etapa (1) en un compactador de rodillos adecuado;
(3) reducir las cintas obtenidas durante la etapa (1) a pequeños gránulos mediante unas etapas de trituración o tamizado adecuadas; 25
(4) opcionalmente, mezclar los gránulos de la etapa (3) con el resto de los excipientes en un mezclador para obtener la mezcla final;
(5) formar comprimidos de los gránulos de la etapa (3), o de la mezcla final de la etapa (4), mediante su compresión en una prensa para comprimidos adecuada para producir comprimidos de matriz. 30
14. Uso de una formulación en comprimidos de liberación extendida según una de las reivindicaciones anteriores 1 a 10, para preparar una composición médica para el tratamiento de la enfermedad de Parkinson y las complicaciones o trastornos asociados con ella.
Patentes similares o relacionadas:
FORMULACIÓN DE RESAGILINA DE LIBERACIÓN RETARDADA, del 26 de Diciembre de 2011, de TEVA PHARMACEUTICAL INDUSTRIES LTD.: Citrato de rasagilina
FORMULACIÓN DE RABEPRAZOL, del 21 de Diciembre de 2011, de LEK PHARMACEUTICALS D.D.: Composición farmacéutica que comprende un núcleo de comprimido que comprende rabeprazol sódico, hidróxido de calcio, al menos un excipiente farmacéuticamente […]
FORMULACIONES QUE CONTIENEN SALICILATOS Y SU USO PARA TRATAR LA ENFERMEDAD INFLAMATORIA INTESTINAL, del 4 de Marzo de 2011, de AGI THERAPEUTICS RESEARCH LIMITED: Una composición farmacéutica de liberación modificada que comprende: un salicilato y/o ácido salicílico elegidos entre ácido 4-aminosalicílico, ácido 5- profármacos de […]
 COMPRIMIDO DE LIBERACION MODIFICADA DE HIDROCLORURO DE BUPROPION, del 19 de Abril de 2010, de BIOVAIL LABORATORIES INTERNATIONAL SRL: Comprimido de liberación modificada que comprende:
(i) un núcleo que comprende una cantidad eficaz de una sal farmacéuticamente aceptable de bupropión, y […]
COMPRIMIDO DE LIBERACION MODIFICADA DE HIDROCLORURO DE BUPROPION, del 19 de Abril de 2010, de BIOVAIL LABORATORIES INTERNATIONAL SRL: Comprimido de liberación modificada que comprende:
(i) un núcleo que comprende una cantidad eficaz de una sal farmacéuticamente aceptable de bupropión, y […]
FORMULACIONES FARMACEUTICAS DE COMPUESTOS INHIBIDORES DE AMILOIDE, del 18 de Noviembre de 2009, de BELLUS HEALTH (INTERNATIONAL) LIMITED: Formulación que comprende una sustancia que se selecciona a partir de ácido 3-amino-1-propanosulfónico y sus sales farmacéuticamente aceptables, […]
 METODO PARA EL RECUBRIMIENTO DE FARMACOS Y COMPOSICIONES OBTENIDAS A PARTIR DEL MISMO, del 1 de Noviembre de 2008, de CENAVISA S.L.: Método para el recubrimiento de fármacos y composiciones obtenidas a partir del mismo. La presente invención está relacionada con el campo de la tecnologia farmacéutica, […]
METODO PARA EL RECUBRIMIENTO DE FARMACOS Y COMPOSICIONES OBTENIDAS A PARTIR DEL MISMO, del 1 de Noviembre de 2008, de CENAVISA S.L.: Método para el recubrimiento de fármacos y composiciones obtenidas a partir del mismo. La presente invención está relacionada con el campo de la tecnologia farmacéutica, […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE UNA FORMA DE DOSIFICACIÓN SÓLIDA A PRUEBA DE ABUSO, del 10 de Noviembre de 2011, de GRUNENTHAL GMBH: Procedimiento para la preparación de una forma de dosificación sólida a prueba de abuso que contiene al menos un principio activo susceptible de abuso […]
ELASTÓMEROS DE POLIURETANO, del 12 de Agosto de 2011, de CONTROLLED THERAPEUTICS (SCOTLAND) LTD: Una composición de liberación controlada, que comprende un polímero lineal que puede obtenerse haciendo reaccionar juntos (a) un polietilenglicol o polipropilenglicol; […]