FORMULACION DE 1-(3-HIDROXIADAMANT-1-ILAMINO)-ACETIL)-PIRROLIDINA-2(S)-CARBONITRILO DE LIBERACION MODIFICADA.
Una formulación de comprimido farmacéutica que comprende por forma de dosificación unitaria por ejemplo por comprimido los siguientes ingredientes:
(a) un compuesto como un ingrediente activo, en donde el compuesto es (S)-1-[(3-hidroxi-1-adamantil)amino]acetil-2-ciano-pirrolidina (vildagliptina) o la correspondiente cantidad de cualquiera de sus sales; y
(b) una hidroxipropilmetilceluosa con una viscosidad aparente de 80,000 cP a 120,000 cP (valor nominal 100,000 cP) cuando está en una solución del 1%, y opcionalmente un llenador y/o un lubricante
Tipo: Resumen de patente/invención. Número de Solicitud: W06022416US.
Solicitante: NOVARTIS AG
NOVARTIS PHARMA GMBH.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35,4056 BASEL.
Inventor/es: KOWALSKI,JAMES, LAKSHMAN,JAY,PARTHIBAN, SERAJUDDIN,ABU,T. M, JOSHI,YATINDRA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/40 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- A61K9/20H4B
- A61K9/20H6F2
- A61K9/20K4
- A61K9/20K4B
Clasificación PCT:
- A61K31/40 A61K 31/00 […] › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- A61K9/22 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
- A61K9/24 A61K 9/00 […] › en dosis unitarias constituidas por capas u hojas.
Fragmento de la descripción:
Formulación de 1-[(3-hidroxiadamant-1-ilamino)-acetil]-pirrolidina-2(S)-carbonitrilo de liberación modificada.
La presente invención se relaciona con una preparación de liberación sostenida que contiene un inhibidor IV dipeptidil peptidasa (DPP-IV) útil para prevenir o tratar diabetes mellitus, diabetes mellitus no dependiente de insulina, obesidad, artritis, osteoporosis, y otras enfermedades.
El DPP-IV es un fármaco útil para tratar diabetes mellitus, diabetes mellitus no dependiente de insulina, obesidad, artritis, osteoporosis, y otras enfermedades debido a que este inhibe la inactivación del péptido I similar a glucagón (GLP-I) en plasma sanguíneo e incrementa su acción de secreción interna (WO 02/062,764, WO 01/55105, WO 02/02560).
Sin embargo, como se describe en detalle adelante, existen algunos casos en los que no siempre es preferible la fuerte inhibición de la actividad DPP-IV en un cuerpo vivo.
Por ejemplo, se ha reportado que el inhibidor DPP-IV mejora la acción de vasodilatación mediante la sustancia O y que la actividad de DPP-IV se eleva cuando se trata rinosinusitis crónica debido a que existe una relación inversa entre la actividad de DPP-IV de mucosa nasal de un paciente con rinosinusitis crónica y densidad de células inflamatorias en la mucosa nasal (por ejemplo, FASEB J., 2002, 16:1132-1134).
De acuerdo con lo anterior, se considera indeseable inhibir fuertemente la actividad de DPP-IV en un paciente con diabetes que complica la inflamación crónica debido a que esta resulta en el agravamiento de la inflamación.
Se ha reportado que la actividad selectiva de DPP-IV es importante para homeóstasis de glucosa ya que la amida GLP-I (9-36), un metabolito de GLP-I con DPP-IV, reduce el nivel de glucosa en la sangre (Am. J. Physiol. Endocrinol. Metab., 2002, 282:E873-E879).
Adicionalmente se ha reportado que en el tratamiento de un paciente con Hepatitis tipo C utilizando interferón-a, la severidad de depresión y ansiedad se correlaciona con la reducción de la actividad de DPP-IV de suero (por ejemplo, Mol. Psychiatry, 2001, 6: 475-480).
En vista de las circunstancias actuales existen algunos casos en los que la fuerte inhibición de la actividad in vivo DPP-IV no siempre es preferible para los seres vivos, los actuales inventores consideran necesario desarrollar una preparación que puede inhibir apropiadamente la actividad de DPP-IV y también proporciona excelente conveniencia o confianza.
Los inventores describen aquí una formulación 1-[(3-Hidroxi-adamant-1-ilamino)-acetil]-pirrolidina-2(S)-carbonitrilo de liberación sostenida modificada (también conocido como LAF237 o vildagliptina (INN)) para estos propósitos. El desarrollo de una formulación de liberación modificada/sostenida (MR) que comprende vildagliptina es necesario para mejorar la calidad de tratamiento de los pacientes tratados. La vildagliptina es un inhibidor dipeptidilpeptidasa IV oralmente activo, para el mejoramiento del control glucémico en diabetes tipo II.
La LAF237 es describe específicamente en el Ejemplo 1 de WO 00/34241. La LAF237 se puede formular como se describe en la WO 00/34241, o en la Solicitud de Patente Internacional No. EP2005/000400 (número de Solicitud).
Ya que la vildagliptina es sensible a la humedad, uno de los énfasis principales durante el desarrollo de la Formulación Comercial (MF) es la estabilidad de producto. La hidrólisis es la ruta de degradación principal para la vildagliptina. Se sabe que la estabilidad de la vildagliptina se afecta por el contenido de humedad inicial del comprimido, excipientes con alta humedad intrínseca y la cantidad de excipientes presentes en el comprimido (% de carga de fármaco). La actual formulación de vildagliptina validada es un comprimido DC (compresión directa) con una carga de fármaco de 25%.
Considerando la sensibilidad al agua de vildagliptina, la forma de servicio clínico (CSF) y desarrollo de Formulación Comercial (MF) se planea para enfocarse en técnicas que no requerirían el uso de agua, tal como compresión directa.
La vildagliptina se clasifica como la Categoría II, por lo tanto, no se requieren prácticas de manipulación especiales.
La sustancia de fármaco vildagliptina (DS) es sensible a la humedad.
Es necesario el empaque hermético. La fecha de prueba actual es 30 meses con almacenamiento a 25ºC.
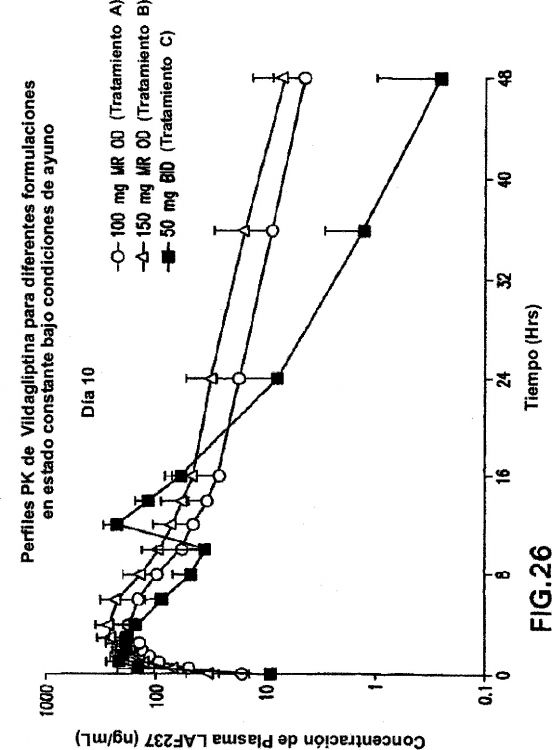
Se sabe bien que el cumplimiento terapéutico del paciente con un régimen de fármaco se correlaciona indirectamente con la frecuencia de dosificación es decir se ve mayor cumplimiento terapéutico con un régimen de dosificación una vez al día (OD) comparado con un régimen de dosificación dos veces al día (BID). La mayoría de datos disponibles actualmente para vildagliptina se derivan de los estudios con base en la formulación de liberación inmediata (IR) de vildagliptina dado el BID.
Reemplazar 50 mg de la dosis IR BID con una dosis de liberación modificada OD proporcionará el beneficio dual de conveniencia de dosificación al paciente y un producto innovador OD para tratar pacientes.
La presente invención proporciona una formulación de comprimido farmacéutico, capaz de ser comprimida, preferiblemente directamente comprimida, en un comprimido que tiene dureza/friabilidad adecuada, un tiempo de desintegración aceptable, baja sensibilidad a la humedad, estabilidad mejorada, un patrón de disolución aceptable y perfil farmacocinético mejorado en pacientes tratados. La formulación de comprimido farmacéutico, también se puede utilizar en por ejemplo una cápsula, comprimido, tableta comprimida, tabletas de compresión directa, gránulo.
Resumen de la invención
La invención objeto proporciona una formulación de comprimido farmacéutica que comprende por forma de dosificación unitaria por ejemplo los siguientes ingredientes por comprimido:
(a) un compuesto como un ingrediente activo, en donde el compuesto tiene una Fórmula:
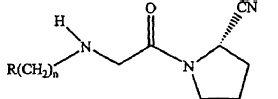
en donde R es adamantilo sustituido y n es un entero de 0 a 3; o una sal farmacéuticamente aceptable del mismo;
(b) una hidroxipropilmetilcelulosa con una viscosidad evidente de 80,000 cP a 120,000 cP (valor nominal 100,000 cP) cuando está presente en una solución al 1%;
(c) una celulosa microcristalina; y
(d) un estearato de magnesio
La invención objeto también proporciona una formulación de comprimido farmacéutico, que comprende por 400 mg de comprimido los siguientes ingredientes:
(a) vildagliptina o una sal farmacéuticamente aceptable del mismo en una cantidad de aproximadamente 100 mg;
(b) una hidroxipropilmetilcelulosa en una cantidad de aproximadamente 160 mg, en donde la hidroxipropilmetilcelulosa tiene una viscosidad evidente de 80,000 cP a 120,000 cP (valor nominal 100,000 cP) cuando está presente en una solución al 1%;
(c) una celulosa microcristalina en una cantidad de 120 mg;
(d) una lactosa en una cantidad de aproximadamente 16 mg; y
(e) un estearato de magnesio en una cantidad de 4 mg.
La invención objeto también proporciona una formulación de comprimido farmacéutica que comprende por forma de dosificación unitaria por ejemplo por comprimido los siguientes ingredientes:
(a) un compuesto como un ingrediente activo, en donde el compuesto tiene una Fórmula:
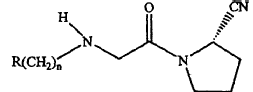
en donde R es adamantilo sustituido y n es un entero de 0 a 3; o una sal farmacéuticamente aceptable del mismo; y
(b) una hidroxipropilmetilcelulosa con una viscosidad evidente de 80,000 cP a 120,000 cP (valor nominal 100,000 cP) cuando está presente en una solución al 1%.
Breve descripción de las figuras
Figura 1. Flujo de proceso. Esta Figura muestra el proceso de fabricación seleccionado.
Figura 2. Perfil de disolución para liberación lenta y rápida.
Figura 3. Perfil de compresión del comprimido vildagliptina MR de 100 mg para formulación CSF que contiene 40% HPMC.
Figura 4. Friabilidad del comprimido de vildagliptina MR de 100 mg para formulación CSF que contiene 40% HPMC.
Figura 5. Efecto de compactación por rodillo y tiempo de inactivación, 30% HPMC, comprimido...
Reivindicaciones:
1. Una formulación de comprimido farmacéutica que comprende por forma de dosificación unitaria por ejemplo por comprimido los siguientes ingredientes:
- (a) un compuesto como un ingrediente activo, en donde el compuesto es (S)-1-[(3-hidroxi-1-adamantil)amino]acetil-2-ciano-pirrolidina (vildagliptina) o la correspondiente cantidad de cualquiera de sus sales; y
- (b) una hidroxipropilmetilceluosa con una viscosidad aparente de 80,000 cP a 120,000 cP (valor nominal 100,000 cP) cuando está en una solución del 1%, y opcionalmente un llenador y/o un lubricante.
2. Una formulación de comprimido farmacéutica de acuerdo con la reivindicación 1, en donde en la forma de dosificación unitaria, la proporción del peso de vildagliptina y cualesquiera de sus sales correspondientes al peso de hidroxipropilmetilceluosa es de 0.16 a 2.5, preferiblemente 0.3 a 1.16 o 0.4 a
3. Una formulación de comprimido farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 o 2 que comprende;
- (a) 15-55% preferiblemente 25-45% en peso de una base de peso seco de un llenador farmacéuticamente aceptable; y opcionalmente
- (b) 0.1-10% preferiblemente 0.1-3% en peso de una base de peso seco de un lubricante farmacéuticamente aceptable.
4. Una formulación de comprimido farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en donde el llenador es lactosa y/o celulosa microcristalina y/o el lubricante es estearato de magnesio.
5. Una formulación de comprimido farmacéutica de acuerdo con la reivindicación 4, en donde la lactosa está presente en una cantidad de 1% a 8% en peso.
6. Una formulación de comprimido farmacéutica de acuerdo a una cualquiera de las reivindicaciones precedentes, en donde el compuesto es una forma de cristal de vildagliptina preferiblemente la forma cristal "A" o cualquiera de sus sales.
7. Una formulación de comprimido farmacéutica de acuerdo a una cualquiera de las reivindicaciones precedentes, en donde con relación al peso de la formulación:
- (a) vildagliptina, o la correspondiente cantidad de cualquiera de sus sales está presente en una cantidad de 15% a 35% en peso;
- (b) el hidroxipropilmetilceluosa está presente en una cantidad de 30% a 50% en peso;
- (c) la celulosa microcristalina está presente en una cantidad de 25% a 35% en peso; y
- (d) el estearato de magnesio está presente en una cantidad de 0.1% a 3% en peso.
8. Una formulación de comprimido farmacéutica, que comprende por 600 mg de comprimido los siguientes ingredientes:
- (a) vildagliptina en una cantidad de 150 mg, o la cantidad correspondiente de cualquiera de sus sales;
- (b) una hidroxipropilmetilceluosa en una cantidad de aproximadamente 240 mg, en donde el hidroxipropilmetilceluosa tiene una viscosidad aparente de 80,000 cP a 120,000 cP (valor nominal 100,000 cP) cuando está en una solución del 1%;
- (c) una celulosa microcristalina en una cantidad de 180 mg;
- (d) una lactosa en una cantidad de aproximadamente 24 mg; y
- (e) un estearato de magnesio en una cantidad de 6 mg.
9. Una formulación de comprimido farmacéutica, que comprende por 400 mg de comprimido los siguientes ingredientes:
- (a) vildagliptina en una cantidad de 100 mg, o la correspondiente cantidad de cualquiera de sus sales;
- (b) una hidroxipropilmetilceluosa en una cantidad de aproximadamente 160 mg, en donde el hidroxipropilmetilceluosa tiene una viscosidad aparente de 80,000 cP a 120,000 cP (valor nominal 100,000 cP) cuando está en una solución del 1%;
- (c) una celulosa microcristalina en una cantidad de 120 mg;
- (d) una lactosa en una cantidad de aproximadamente 16 mg; y
- (e) un estearato de magnesio en una cantidad de 4 mg.
10. Un método para producir una formulación de comprimido farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en donde el método comprende combinar los ingredientes en las cantidades mencionadas en una cualquiera de estas reivindicaciones.
11. Un comprimido multicapa farmacéutico en donde la formulación de comprimido farmacéutica de acuerdo con cualquiera de las reivindicaciones 1 a 9, representa una de las capas del comprimido.
12. Un comprimido multicapa farmacéutico de acuerdo con la reivindicación 11, en donde la capa adicional contiene una glitazona (por ejemplo pioglitazona o rosiglitazona) o metformina.
13. Un comprimido multicapa farmacéutico de acuerdo con la reivindicación 12 en donde la capa adicional es una formulación de liberación inmediata.
14. Un comprimido farmacéutico obtenido por compresión de una formulación de comprimido farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 13.
15. Un comprimido farmacéutico obtenido por compresión de una formulación de comprimido farmacéutica de acuerdo con cualquiera de las reivindicaciones 1 a 13, en donde la formulación de comprimido farmacéutica se somete a compactación por rodillo antes de compresión en comprimido.
16. Un comprimido farmacéutico de acuerdo con la reivindicación 15 que comprende 100 mg de vildagliptina o una sal farmacéuticamente aceptable de la misma en donde el rango de dureza del comprimido está entre 10 a 13Kp.
17. Un comprimido farmacéutico de acuerdo con la reivindicación 15 que comprende 150 mg de vildagliptina o una sal farmacéuticamente aceptable del mismo en donde el rango de dureza del comprimido está entre 11 a 25Kp.
18. Una formulación de comprimido farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 9 o un comprimido farmacéutico de acuerdo con una cualquiera de las reivindicaciones 11 a 17, que comprende por lo menos un agente terapéutico adicional.
19. Una formulación de comprimido farmacéutica o un comprimido farmacéutico de acuerdo con la reivindicación 18, en donde el por lo menos un agente terapéutico adicional es un antidiabético.
20. Una formulación de comprimido farmacéutica o un comprimido farmacéutico de acuerdo con la reivindicación 19, en donde el agente antidiabético se selecciona de pioglitazona, rosiglitazona o metformina.
21. Una formulación de comprimido farmacéutica o un comprimido farmacéutico de acuerdo con la reivindicación 18, en donde el por lo menos un agente terapéutico adicional es un antagonista de angiotensin II o a estatina.
22. Un proceso para preparar un comprimido, en la forma de dosificación unitaria, el proceso que comprende las etapas de:
- (a) mezclar una formulación de comprimido farmacéutica de acuerdo a una cualquiera de las reivindicaciones precedentes;
- (b) comprimir la formulación preparada durante la etapa (a) para formar la tableta comprimida en forma de dosis unitaria.
23. Un proceso para preparar un comprimido, en la forma de dosificación unitaria, el proceso que comprende las etapas de:
- (a) mezclar una formulación de comprimido farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 21;
- (b) compactar con rodillo la formulación preparada durante la etapa (a); y
- (c) comprimir la formulación preparada durante la etapa (b) para formar la tableta comprimida en la forma de dosificación unitaria.
24. Un proceso para preparar un comprimido, en la forma de dosificación unitaria, el proceso que comprende las etapas de:
- (a) mezclar una formulación de comprimido farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 21;
- (b) compactar con rodillo la formulación preparada durante la etapa (a) con una fuerza de compactación comprendida entre 10 y 16 KN y;
- (c) comprimir la formulación preparada durante la etapa (b) para formar la tableta comprimida en la forma de dosificación unitaria.
25. Una forma de dosificación farmacéutica oral sólida de liberación sostenida de acuerdo con cualquiera de las reivindicaciones precedentes que es:
26. Una forma de dosificación farmacéutica oral sólida de liberación sostenida de acuerdo con cualquiera de las reivindicaciones precedentes que es:
27. Una forma de dosificación farmacéutica oral sólida de liberación sostenida de acuerdo con una cualquiera de las reivindicaciones 25 o 26, que comprende una formulación de comprimido farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 25.
28. Una forma de dosificación farmacéutica oral sólida de liberación sostenida de acuerdo con una cualquiera de las reivindicaciones 25 o 26, que comprende una hidroxipropilmetilceluosa, preferiblemente entre 20% y 60%, entre 30% y 50% en peso sobre una base de peso seca de una hidroxipropilmetilceluosa.
29. Una forma de dosificación farmacéutica oral sólida de liberación sostenida de acuerdo con una cualquiera de las reivindicaciones 25 o 26, que comprende a hidroxipropilmetilceluosa con una viscosidad aparente de 80,000 cP a 120,000 cP (valor nominal 100,000 cP) cuando está presente en una solución del 1%, preferiblemente entre 20% y 60%, o entre 30% y 50% en peso sobre una base de peso seca de una hidroxipropilmetilceluosa con una viscosidad aparente de 80,000 cP a 120,000 cP (valor nominal 100,000 cP) cuando está en una solución del 1%.
30. Una forma de dosificación farmacéutica oral sólida de liberación sostenida de acuerdo con una cualquiera de las reivindicaciones 25 o 26, en donde:
31. Uso de los ingredientes en las cantidades mencionadas en una cualquiera de las reivindicaciones 1 a 30, en la fabricación de una formulación de comprimido farmacéutica, para inhibir la actividad peptidasa dipeptidilo IV en un sujeto.
32. Uso de los ingredientes en las cantidades mencionadas en una cualquiera de las reivindicaciones 1 a 30, en la fabricación de una formulación de comprimido farmacéutica, para tratar una afección aliviada por la inhibición de peptidasa dipeptidilo IV en un sujeto que sufre de la afección.
33. Uso de acuerdo con la reivindicación 32, en donde la afección es diabetes mellitas no dependiente de insulina.
34. Uso de acuerdo con la reivindicación 32, en donde la afección es obesidad, artritis u osteoporosis.
35. Uso de acuerdo con una cualquiera de las reivindicaciones 31 a 34, en donde la formulación de comprimido farmacéutica se utiliza en combinación con una dosis terapéuticamente efectiva de un antidiabético, fármaco para artritis o fármaco anti-obesidad.
Patentes similares o relacionadas:
Novedosa forma cristalina de la sal 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)-N-metilmetanamina, del 22 de Julio de 2020, de DAEWOONG PHARMACEUTICAL CO., LTD.: Una forma cristalina I de clorhidrato de 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)- N-metilmetanamina que tiene picos en ángulos de difracción […]
Nueva sal de adición de ácido de 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)-N-metilmetanamina, del 15 de Julio de 2020, de DAEWOONG PHARMACEUTICAL CO., LTD.: Una sal de adición de ácido de 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)-Nmetilmetanamina en la que el ácido es ácido […]
Análogos de (E)-N''-(1-feniletiliden) benzohidrazida sustituida como inhibidores de desmetilasas de histonas, del 15 de Julio de 2020, de UNIVERSITY OF UTAH RESEARCH FOUNDATION: Un compuesto que tiene una estructura representada por una fórmula: **(Ver fórmula)** en donde m es 1; n es un número entero de 0 a […]
Conjugados de ligadores (ADCs) con inhibidores de KSP, del 24 de Junio de 2020, de Bayer Pharma Aktiengesellschaft: Conjugado de un ligador o un derivado del mismo con una o varias moléculas de principio activo, en donde la molécula de principio activo es un inhibidor de la proteína del huso […]
Formulaciones farmacéuticas de estatinas y ácidos grasos omega-3 para encapsulación, del 27 de Mayo de 2020, de Catalent Ontario Limited: Una cápsula de gelatina blanda multifase para administración oral, comprendiendo la cápsula de gelatina blanda: una forma de dosificación […]
Procedimiento de estabilización de tamaño de partícula, del 27 de Mayo de 2020, de INKE, S.A.: Un procedimiento para obtener una sal de glicopirronio estable que comprende las siguientes etapas: a) micronizar la sal de bromuro de glicopirronio, opcionalmente […]
Utilización de estatinas para la enfermedad periodontal y regeneración ósea, del 20 de Mayo de 2020, de Rosenberg Messina, David Rafael: Atorvastatina o una sal farmacéuticamente aceptable de la misma para usar en la prevención o tratamiento de la enfermedad periodontal humana […]
Proteínas de unión a antígeno para proproteína convertasa subtilisina kexina tipo 9 (PCSK9), del 6 de Mayo de 2020, de AMGEN INC.: Una proteína de unión a antígeno, donde dicha proteína de unión a antígeno (i) comprende (a) un dominio variable de cadena ligera que comprende una secuencia […]