FORMAS NUEVAS DEL ACIDO (R-(R*,R*))-2-(4-FLUOROFENIL)-B,B-DIHIDROXI-5-(1-METILETIL)-3-FENIL-4-((FENILAMINO)CARBONIL)1H-PIRROL-1-HEPTANOICO, DE MAGNESIO.
Una atorvastatina magnésica de forma A que tiene: (a) bien un patrón de difracción en polvo de rayos X que contiene los siguientes valores de 2theta medidos usando radiación de CuKalfa:
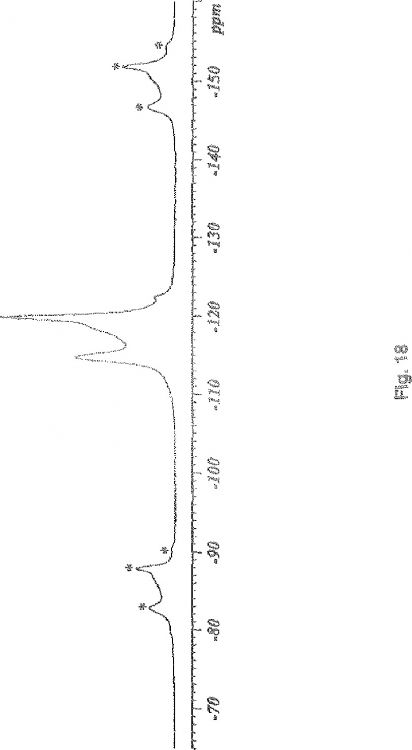
9,3, 14,3 y 18,4; o bien (b) un espectro de RMN 13 C en el estado sólido que contiene los valores: 118,7, 124,4, 140,3 y 141,7 ppm, o bien (c) un espectro de RMN 19 F en el estado sólido que contiene los valores: -108,4 y -112,6 ppm
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2006/003239.
Solicitante: WARNER-LAMBERT COMPANY LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 235 EAST 42ND STREET,NEW YORK, NY 10017.
Inventor/es: LEONARD,JASON,ALBERT, MILLER,JONATHAN,MARK.
Fecha de Publicación: .
Fecha Concesión Europea: 5 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C07D207/34 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 207/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros no condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
Clasificación PCT:
- A61K31/40 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- A61P19/10 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 19/00 Medicamentos para el tratamiento de problemas del esqueleto. › para la osteoporosis.
- A61P25/28 A61P […] › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › de los problemas neurodegenerativos del sistema nervioso central, p. ej. noótropos, activadores del conocimiento, medicamentos para el tratamiento del Alzheimer o de otras formas de demencia.
- A61P3/06 A61P […] › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › Antihiperlipidémicos.
- C07D207/34 C07D 207/00 […] › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
Fragmento de la descripción:
Formas nuevas del ácido [R-(R*,R*)]-2-(4-fluorofenil)-ß,d-dihidroxi-5-(1-metiletil)-3-fenil-4-[(fenilamino)carbonil]-1H-pirrol-1-heptanoico, de magnesio.
Campo de la invención
La presente invención se refiere a una forma nueva de la sal de magnesio de ácido [R-(R*,R*)]-2-(4-fluorofenil)-ß,d-dihidroxi-5-(1-metiletil)-3-fenil-4-[(fenilamino)carbonil]-1H-pirrol-1-heptanoico, denominada forma E, que se caracteriza por uno o más de su difracción de rayos X de polvo, desplazamiento químico de carbono en RMN en estado sólido y desplazamiento químico de flúor en RMN en estado sólido. La presente invención también se refiere a composiciones farmacéuticas que contienen tal compuesto y a dicho compuesto para usar en el tratamiento de la hiperlipidemia, la hipercolesterolemia, la osteoporosis, la hiperplasia prostática benigna (HPB) y la enfermedad de Alzheimer.
Antecedentes de la invención
La conversión de la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) en mevalonato es una etapa temprana y limitante de la velocidad en la vía de la biosíntesis del colesterol. Esta etapa está catalizada por la enzima HMG-CoA reductasa. Las estatinas inhiben la HMG-CoA reductasa e impiden que catalice esta conversión. Como tales, las estatinas son, en conjunto, potentes agentes hipolipemiantes.
Actualmente, la atorvastatina cálcica, divulgada en la patente de Estados Unidos Nº 5.273.995 se comercializa como LIPITOR®, que tiene el nombre químico de sal de calcio trihidrato de ácido [R-(R*,R*)]-2-(4-fluorofenil)-ß,d-dihidroxi-5-(1-metiletil)-3-fenil-4-[(fenilamino)carbonil]-1H-pirrol-1-heptanoico (2:1).
La atorvastatina cálcica es un inhibidor competitivo y selectivo de la HMG-CoA reductasa. Como tal, la atorvastatina cálcica es un potente compuesto hipolipemiante y, por tanto, es útil como agente hipolipidémico y/o hipocolesterolémico.
Se han presentado numerosas patentes en las que se divulga la atorvastatina, formulaciones de atorvastatina, así como procedimientos y productos intermedios clave para preparar atorvastatina. Estas incluyen: las patentes de Estados Unidos números 4.881.893, 5.273.995, 5.003.080, 5.097.045, 5.103.024, 5.124.482, 5.149.837, 5.155.251, 5.216.174, 5.245.047, 5.248.793, 5.280.126, 5.397.792, 5.342.952, 5.298.627, 5.446.054, 5.470.981, 5.489.690, 5.489.691, 5.510.488, 5.686.104, 5.998.633, 6.087.511, 6.128.971, 6.433.213 y 6.476.235.
Además, en numerosas solicitudes de patente internacional publicadas y patentes se han divulgado formas cristalinas de atorvastatina, así como procedimientos para preparar atorvastatina amorfa. Éstas incluyen: la patente de EE.UU. 5.969.156; la patente de EE.UU. 6.121.461; la patente de EE.UU. 6.605.729; el documento WO 00/71116; el documento WO 01/28999; el documento WO 01/36384;el documento WO 01/42209; el documento WO 02/41834; el documento WO 02/43667; el documento WO 02/43732; el documento WO 02/051804; el documento WO 02/057228; el documento WO 02/057229; el documento WO 02/057274; el documento WO 02/059087; el documento WO 02/072073; el documento WO 02/083637; el documento WO 02/083638; el documento WO 03/050085; el documento WO 03/070702; y el documento WO 04/022053.
La atorvastatina se prepara en forma de su sal de calcio, es decir como sal de calcio de ácido [R-(R*,R*)]-2-(4-fluorofenil)-ß,d-dihidroxi-5-(1-metiletil)-3-fenil-4-[(fenilamino)carbonil]-1H-pirrol-1-heptanoico (2:1). La sal de calcio es deseable, ya que permite formular de un modo conveniente la atorvastatina en, por ejemplo, comprimidos, cápsulas, pastillas, polvos y similares, para administración oral.
El procedimiento por el cual se produce atorvastatina cálcica tiene que ser uno que pueda aplicarse a la producción a gran escala. Adicionalmente, es deseable que el producto esté en una forma que sea fácilmente filtrable y que se seque con facilidad. Por último, es económicamente deseable que el producto sea estable durante periodos extendidos de tiempo sin la necesidad de condiciones de almacenamiento especializadas.
Además se ha divulgado que las formas amorfas en una serie de fármacos exhiben diferentes características de disolución y, en algunos casos, diferentes patrones de biodisponibilidad en comparación con las formas cristalinas (Konno T., Chem. Pharm. Bull., 1990; 38; 2003-2007). Para algunas indicaciones terapéuticas, un patrón de biodisponibilidad puede verse favorecido sobre otro.
En el transcurso del desarrollo farmacológico, generalmente se asume que es importante descubrir la forma cristalina más estable del fármaco. Esta forma cristalina más estable es la forma que es probable que tenga la mejor estabilidad química y, por tanto, la vida de caducidad más prolongada en una formulación. No obstante, también es ventajoso tened múltiples formas de un fármaco, por ejemplo sales, hidratos, polimorfos, formas cristalinas y no cristalinas. No hay una forma física ideal de un fármaco porque diferentes formas proporcionan diferentes ventajas. La búsqueda de la forma más estable y de otras formas es ardua y el resultado es impredecible.
El desarrollo con éxito de un fármaco requiere que cumpla ciertos requisitos para ser un tratamiento terapéuticamente eficaz para pacientes. Estos requisitos entran dentro de dos categorías: (1) requisitos para la fabricación con éxito de formas de dosificación y (2) requisitos para la liberación exitosa del fármaco y eliminación después de que la formulación farmacológica se haya administrado al paciente.
Hay muchas clases de formulaciones farmacológicas para la administración por varias vías y es probable que la forma óptima del fármaco para diferentes formulaciones sea diferente. Como se ha mencionado en lo que antecede, una formulación farmacológica debe tener suficiente vida de almacenamiento para permitir una distribución satisfactoria a los pacientes que necesiten el tratamiento. Además, una formulación farmacológica debe proporcionar el fármaco en una forma que se disolverá en el tracto gastrointestinal del paciente cuando se administra por vía oral. Para la administración oral en una forma de dosificación de liberación inmediata, tal como un comprimido, cápsula, suspensión o sello de liberación inmediata, generalmente es deseable tener una sal del fármaco o forma del fármaco que tenga una solubilidad elevada con el fin de asegurar la disolución completa de la dosis y una biodisponibilidad óptima. Para algunos fármacos, particularmente fármacos de solubilidad baja o fármacos de mala humidificación, puede ser ventajoso utilizar una forma farmacológica no cristalina, que generalmente tendrá una solubilidad inicial más elevada que una forma cristalina cuando se administra en el tracto gastrointestinal. Una forma no cristalina de un fármaco con frecuencia es menos químicamente estable que una forma cristalina. Por tanto, es ventajoso identificar formas farmacológicas no cristalinas que sean suficientemente químicamente estables para proporcionar un producto práctico que es lo suficiente estable como para mantener su potencia durante tiempo suficiente para permitir la fabricación de la forma de dosificación, envasado, almacenamiento y distribución a los pacientes de todo el mundo.
Por otro lado, hay formas de dosificación que funcionan mejor si la forma del fármaco es menos soluble. Por ejemplo, una forma de dosificación de comprimido masticable o una suspensión o un sello expone la lengua al fármaco directamente. Para dichas formas de dosificación, es deseable para minimizar la solubilidad del fármaco en la boca, con el fin de mantener una porción del fármaco en estado sólido, minimizando el mal gusto. Para dichas formas de dosificación, a menudo es deseable usar una sal o forma cristalina de baja solubilidad.
Para las formas de dosificación oral o inyectable, por ejemplo subcutánea o intramuscular, de liberación controlada, la solubilidad deseada del fármaco es una función compleja de la vía de administración, la dosis, el diseño de la forma de dosificación y la duración deseada de la liberación. Para un fármaco que tiene una solubilidad elevada, puede ser deseable utilizar una sal cristalina o polimorfo de solubilidad menor para una forma de dosificación de liberación controlada, para ayudar en la consecución de la liberación lenta a través de una disolución lenta. Para un fármaco que tenga solubilidad baja, puede ser necesario utilizar una sal cristalina o polimorfo, o una forma no cristalina, de mayor solubilidad, con el fin de conseguir una tasa de disolución suficiente para soportar la tasa de liberación farmacológica deseada a partir de la forma de dosificación de...
Reivindicaciones:
1. Una forma E de atorvastatina de magnesio que tiene un espectro de RMN de 13C en estado sólido que contiene valores: 122,0, 128,9 y 137,8 ppm.
2. Una forma E de atorvastatina según la reivindicación 1, que tiene un espectro de RMN en 19F en estado sólido que contiene valores: -113,2,0, -118,9 y -122,1 ppm.
3. Una composición farmacéutica que comprende una forma E de atorvastatina de magnesio, según la reivindicación 1 o la reivindicación 2, y al menos un excipiente, diluyente o vehículo farmacéuticamente aceptable.
4. Una forma E de atorvastatina de magnesio según la reivindicación 1 o la reivindicación 2, para su uso como medicamento.
5. Una forma E de atorvastatina de magnesio según la reivindicación 1 o la reivindicación 2, para su uso en el tratamiento de hiperlipidemia, hipercolesterolemia, osteoporosis, hiperplasia prostática benigna o enfermedad de Alzheimer.
6. El uso de una forma E de atorvastatina de magnesio según la reivindicación 1 o la reivindicación 2, para la fabricación de un medicamento para el tratamiento de hiperlipidemia, hipercolesterolemia, osteoporosis, hiperplasia prostática benigna o enfermedad de Alzheimer.
Patentes similares o relacionadas:
Proceso para la preparación de antagonistas de receptor androgénico e intermedios de los mismos, del 26 de Febrero de 2020, de ORION CORPORATION: Un proceso para la preparación de 2-cloro-4-(1H-pirazol-3-il)benzonitrilo de fórmula (V) **(Ver fórmula)** que comprende las etapas de […]
Derivados de pirrolamida sustituidos con glioxamida y su uso como medicamentos para el tratamiento de la hepatitis B, del 4 de Diciembre de 2019, de Janssen Sciences Ireland Unlimited Company: Un compuesto seleccionado entre los siguientes compuestos 1-102: Compuesto 1: (R)-4-(2-(sec-butilamino)-2-oxoacetil)-N-(4-fluoro-3-metilfenil)-1-metil-1H-pirrol-2-carboxamida; […]
Fenilpirrolcarboxamidas sustituidas con actividad terapéutica en VIH, del 6 de Noviembre de 2019, de NEW YORK BLOOD CENTER, INC.: Un compuesto representado por una fórmula A: **(Ver fórmula)** en donde Ph es fenilo opcionalmente sustituido; **(Ver fórmula)** […]
Compuestos de heteroarilo con una unidad acíclica como puente, del 31 de Julio de 2019, de INTERVET INTERNATIONAL B.V: Un compuesto de fórmula (I) y solvatos, N-óxidos y sales farmacéuticamente aceptables del mismo,**Fórmula** en la que R1 es halógeno, alquilo, […]
Formas de sal de de atorvastatina con benetamina, del 3 de Julio de 2019, de PFIZER PRODUCTS INC.: Una Forma A de atorvastatina con benetamina que tiene un patrón de difracción de rayos x en polvo que contiene los siguientes máximos 2θ medidos usando […]
Cristal de (S)-1-(2-Hidroxietil)-4-metil-N-[4-(metilsulfonil)fenil]-5-[2-(trifluorometil)fenil]-1H-pirrol-3-carboxamida, del 20 de Febrero de 2019, de DAIICHI SANKYO COMPANY, LIMITED: Un cristal de (S)-1-(2-hidroxietil)-4-metil-N-[4-(metilsulfonil)fenil]-5-[2-(trifluorometil)fenil]-1H-pirrol-3- carboxamida representado por el […]
Derivados de pirrol bicíclicos útiles como agonistas de GPR120, del 9 de Enero de 2019, de JANSSEN PHARMACEUTICA NV: Un compuesto de fórmula (I)**Fórmula** en el que R1 se selecciona del grupo que consiste de 3-fluorofenilo, 4-fluorofenilo, 2,4-difluorofenilo, […]
Derivados de pirrolamida sustituidos con glioxamida y su uso como medicamentos para el tratamiento de la hepatitis B, del 21 de Febrero de 2018, de Janssen Sciences Ireland UC: Un compuesto de Fórmula (IA)**Fórmula** o un estereoisómero o una forma tautomérica de este, donde: cada X representa independientemente CR7; R1, R2 […]