Formas cristalinas de saxagliptina.
Formas cristalinas anhidras de monoclorhidrato de saxagliptina que tienen un contenido en agua de no más del 1,5% p/p.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2010/054692.
Solicitante: SANDOZ AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35 4056 BASEL SUIZA.
Inventor/es: WIESER, JOSEF, PICHLER,ARTHUR, LANGES,CHRISTOPH, VUKICEVIC,MILICA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/403 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con carbociclos, p. ej. carbazol.
- A61P3/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00).
- C07D209/52 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 209/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros, condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › condensados con un ciclo diferente del de seis miembros.
PDF original: ES-2548386_T3.pdf




Fragmento de la descripción:
Formas cristalinas de saxagliptina
La presente invención se refiere a formas polimórficas novedosas de clorhidrato de saxagliptina, a su preparación y a composiciones que las contienen. Los términos "clorhidrato" y "monoclorhidrato" se usan de manera intercambiable en el presente documento.
La saxagliptina, (1 S,3S,5S)-2-[(2S)-2-amino-2-(3-hidroxi-1-adamant¡l)acetil]-2-azabiciclo[3.1.0]hexano-3-carbonitr¡lo o su sal de clorhidrato es un inhibidor de dipeptidil peptidasa-4 (DD4) reversible activo por vía oral, que es un agente terapéutico para el tratamiento de diabetes mellitus tipo 2, obesidad o enfermedades relacionadas, y se da a conocer por ejemplo en el documento US 6.395.767 B2, ejemplo 60.
Determinadas formas cristalinas de saxagliptina y determinadas sales de adición de ácido incluyendo clorhidrato de saxagliptina se dan a conocer en el documento WO 2008131149 A2. La aparición de diferentes formas cristalinas de un único compuesto se conoce como polimorfismo y es una propiedad de algunos compuestos y complejos y pseudopolimorfos. Las formas polimórficas tienen cada una propiedades físicas distintas, tales como un perfil de solubilidad distinto, diferente punto de fusión y/o diferentes picos de difracción de rayos X.
Puesto que la solubilidad de cada polimorfo puede variar, la identificación de la existencia de polimorfos farmacéuticos es importante para proporcionar composiciones farmacéuticas con perfiles de solubilidad predecibles. Es deseable investigar todas las formas en estado sólido de un fármaco, incluyendo todas las formas polimórficas, pseudopolimorfos e hidratos, y determinar las propiedades de estabilidad, disolución y flujo de cada forma polimórfica. Para una revisión general de polimorfos y la relevancia de las propiedades en estado sólido para productos farmacéuticos véase por ejemplo Rolf Hilfiker, Polymorphism in the Pharmaceutical industry, Wiley-VCH 2006.
El descubrimiento de nuevas formas polimórficas de un compuesto farmacéuticamente útil proporciona una nueva oportunidad para mejorar las características de rendimiento de un producto farmacéutico. Amplía el repertorio de materiales que un científico de formulación tiene a su disposición para diseñar, por ejemplo, una forma de dosificación farmacéutica de un fármaco con un perfil de liberación objetivo u otra característica deseada.
Las formas polimórficas conocidas de clorhidrato de saxagliptina son todas formas hidratadas que tienen un contenido en agua relativamente alto. Las formas con un alto contenido en agua tienen determinadas desventajas, ya que un compuesto propenso a la hidrólisis como saxagliptina puede mostrar una estabilidad química disminuida cuando está presente en tales formas. Además, desde un punto de vista galénico, cantidades a granel de principios farmacéuticos activos que tienen un alto contenido en agua tienden formar grumos o adherirse entre sí, teniendo por tanto algunas veces un mal comportamiento de procesamiento en los procesos de formulación para la producción de composiciones farmacéuticas.
Por tanto, hay una necesidad de formas sólidas de clorhidrato de saxagliptina que eviten uno o más problemas de las formas cristalinas conocidas.
Según la presente invención se proporcionan nuevas formas anhidras de clorhidrato de saxagliptina preferiblemente de fórmula
H
**(Ver fórmula)**que tienen un contenido en agua de no más del 1,5% p/p preferiblemente en forma sustancialmente pura como
a) una forma anhidra denominada forma l-S
b) una forma anhidra denominada forma HT-S
c) una forma anhidra denominada forma HT-IV-S
d) una forma anhidra denominada forma IV-S.
5 El contenido en agua se determina según el método de Karl Fischer.
Una forma anhidra de clorhidrato de saxagliptina en el contexto de la presente invención se define como una forma de clorhidrato de saxagliptina que, tras su almacenamiento a una humedad relativa del 30% a 25°C durante 24 horas, muestra un contenido en agua de no más del 1,5 % p/p según el método de Karl Fischer.
Descripción detallada
10 El clorhidrato de saxagliptina usado como educto es una de las formas conocidas que contienen agua, por ejemplo las formas H2-1, FU.25-2 o H.75-3 identificadas en el documento WO 2008/131149 A2 en la página 2.
Forma l-S
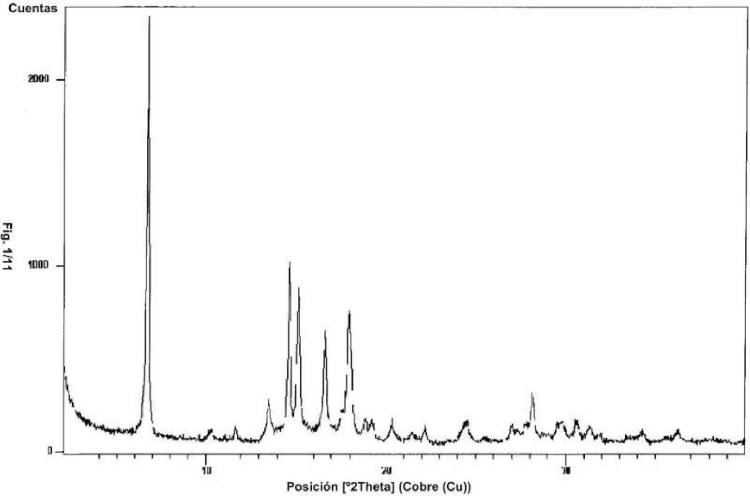
En un primer aspecto la presente invención proporciona una forma cristalina de clorhidrato de saxagliptina, denominada forma l-S, que puede caracterizarse por reflexiones de difracción de polvo de rayos X a 15 aproximadamente 6,7, 14,6, 15,2, 16,6 y 17, 9 + 0,2 grados dos-theta, en particular que comprende picos adicionales a aproximadamente 13,5, 24,5 y 28,1. La forma l-S de saxagliptina puede caracterizarse adicionalmente por un patrón de PXRD sustancialmente según la figura 1. Alternativamente, la forma cristalina l-S de clorhidrato de saxagliptina puede describirse por un espectro de infrarrojos que comprende picos a números de onda de 2907, 2853, 1637, 1589, 1462, 1391, 1318, 1045, 1014 y 775 +/- 2 cm'1. La forma l-S de clorhidrato de saxagliptina puede 20 caracterizarse adicionalmente por un espectro de FTIR sustancialmente según la figura 2.
El clorhidrato de saxagliptina cristalino anhidro en forma de la forma l-S puede prepararse mediante cristalización de clorhidrato de saxagliptina en un alcohol, preferiblemente etanol en presencia de simientes de la forma l-S, por ejemplo tal como se describe en el ejemplo 2. Se obtuvieron sorprendentemente simientes de la forma l-S mediante la disolución de la base libre de saxagliptina hemihidratada en un disolvente orgánico, precipitación con un haluro de 25 alquilo dihidratado, separación del monoclorhidrato de saxagliptina precipitado deshidratado y cristalización en las aguas madre tras enfriar, véase el ejemplo 1. La forma l-S de clorhidrato de saxagliptina cristalino es una forma cristalina particularmente preferida decido a su alta estabilidad química combinada con su alta velocidad de disolución.
Forma HT-S
30 En un segundo aspecto la presente invención proporciona una forma cristalina de clorhidrato de saxagliptina, denominada forma HT-S, que puede caracterizarse por reflexiones de difracción de polvo de rayos X a aproximadamente 6,6, 11,5, 13,3, 16,7 y 17,6 + 0,2 grados dos-theta, en particular que comprende picos adicionales a aproximadamente 11,5 y 15,3. La forma HT-S de saxagliptina puede caracterizarse adicionalmente por un patrón de PXRD sustancialmente según la figura 4. Alternativamente, la forma cristalina HTS de clorhidrato de saxagliptina 35 puede describirse por un espectro de infrarrojos que comprende picos a números de onda de 2906, 2854, 1649, 1574, 1513, 1459, 1338, 1124, 1032 y 851 +/- 2 cm'1. La forma HT-S de clorhidrato de saxagliptina puede caracterizarse adicionalmente por un espectro de FTIR sustancialmente según la figura 5. El clorhidrato de saxagliptina cristalino en la forma de HT-S puede prepararse calentando formas conocidas de clorhidrato de saxagliptina hasta de aproximadamente 160°C a 180°C y aislando la forma HT-S. En particular, la forma HT-S puede 40 prepararse tal como se describe en el ejemplo 3.
Forma HT-IV-S
En un tercer aspecto la presente invención proporciona una forma cristalina de clorhidrato de saxagliptina, denominada forma HT-IV-S, que puede caracterizarse por reflexiones de difracción de polvo de rayos X a aproximadamente 2,6, 4,5, 6,8, 14,6 y 18,1 + 0,2 grados dos-theta. La forma HT-IV-S de saxagliptina puede 45 caracterizarse adlcionalmente por un patrón de PXRD sustancialmente según la figura 7.
Alternativamente, la forma cristalina HT-IV-S de clorhidrato de saxagliptina puede describirse por un espectro de Infrarrojos que comprende picos a números de onda de 3495, 2921, 1637, 1616, 1464, 1242, 1103, 1013, 940 y 774 +/- 2 cm'1. La forma HT-IV-S de clorhidrato de saxagliptina puede caracterizarse adicionalmente por un espectro de
FTIR sustancialmente según la figura 8.
El clorhidrato de saxagllptlna cristalino en la forma HT-IV-S puede prepararse eliminando el disolvente unido de la saxagliptlna-IV-S. En particular la forma HT-IV-S puede obtenerse secando la forma IV-S descrita a continuación a vacío, por ejemplo a de temperatura ambiental a aproximadamente 100°C, por ejemplo a aproximadamente 80°C + 5 10°C durante varias horas, por ejemplo durante de 3 a 24 horas. En particular la forma HT-IV-S puede prepararse tal
como se describe en el ejemplo 4. En una realización preferida se prepara la forma HT-IV-S de clorhidrato de saxagllptlna en un procedimiento que comprende las etapas de
a) disolver monoclorhidrato de saxagliptina en n-butanol,
b) eliminar n-butanol a presión reducida para obtener un residuo,
... [Seguir leyendo]
Reivindicaciones:
1. Formas cristalinas anhidras de monoclorhidrato de saxagliptina que tienen un contenido en agua de no más del 1,5% p/p.
2. Monoclorhidrato de saxagliptina según la reivindicación 1 de fórmula
**(Ver fórmula)**3. Forma cristalina l-S de monoclorhidrato de saxagliptina según al menos una de las reivindicaciones 1 y 2, caracterizada por un patrón de difracción de polvo de rayos X que comprende picos a 6,7 + 0,2, 14,6 + 0,2, 15,2 + 0,2, 16,6 + 0,2 y 17,9 + 0,2 grados dos-theta, en particular que comprende además picos a 24,5 ± 0,2 y 28,2 + 0,2 grados dos-theta y/o por un espectro de infrarrojos que comprende picos a números de onda de 2907, 2853, 1637, 1589, 1462, 1391, 1318, 1045, 1014 y 775 +/-2crrf1.
4. Forma cristalina HT-S de monoclorhidrato de saxagliptina según al menos una de las reivindicaciones 1 y 2, caracterizada por un patrón de difracción de polvo de rayos X que comprende picos a 6,6 + 0,2, 13,3 + 0,2 y 17,6 + 0,2 grados dos-theta, en particular que comprende además picos a 11,5 + 0,2 y 16,7 + 0,2 grados dos-theta y/o por un espectro de infrarrojos que comprende picos a números de onda de 2906, 2854, 1649, 1574, 1513, 1459, 1338, 1124, 1032 y 851 +/- 2cm'1.
5. Forma cristalina HT-IV-S de monoclorhidrato de saxagliptina según al menos una de las reivindicaciones 1 y 2, caracterizada por un patrón de difracción de polvo de rayos X que comprende picos a 2,6 + 0,2, 4,5 + 0,2, 6,8 + 0,2, 14,6 + 0,2 y 18,1 + 0,2 grados dos-theta, y/o por un espectro de infrarrojos que comprende picos a números de onda de 3495, 2921, 1637, 1616, 1464, 1242, 1103, 1013, 940 y 774 +/- 2 cm'1.
6. Forma cristalina IV-S de monoclorhidrato de saxagliptina caracterizada por un patrón de difracción de polvo de rayos X que comprende picos a 2,4 + 0,2, 4,1 + 0,2, 4,7 + 0,2, 6,3 + 0,2 y 15,6 + 0,2 grados dos-theta.
7. Composición farmacéutica que comprende una forma cristalina de saxagliptina según una cualquiera de las reivindicaciones 1 a 5 en una cantidad eficaz.
8. Composición farmacéutica según la reivindicación 7, para su uso en un método de tratamiento de diabetes.
9. Procedimiento para la preparación de la forma l-S de monoclorhidrato de saxagliptina cristalino según la reivindicación 3, que comprende la etapa de permitir que el monoclorhidrato de saxagliptina cristalice en un alcohol en presencia de cristales simiente de la forma l-S de monoclorhidrato de saxagliptina.
10. Procedimiento para la preparación de la forma HT-S de monoclorhidrato de saxagliptina cristalino según la reivindicación 4, que comprende la etapa de calentar las siguientes formas cristalinas de monoclorhidrato de saxagliptina:
la forma de sal de monoclorhidrato H2-1 que contiene 2 equivalentes de H20 y que tiene un patrón de difracción de rayos X que comprende picos a 6,8, 11,1, 13,7, 14,6, 15,2, 16,4, 17,0, 20,2 y 21,1 grados 26+0,1, cuando se mide con radiación de Kcx de Cu;
la forma de monoclorhidrato H1.25-2 que contiene 1,25 equivalentes de H20 y que tiene las siguientes dimensiones de celda unitaria;
| Temperatura | a -50°C | a +22°C |
| a (A) | 31,198(8) A | 31,290(4) A |
| b (A) | 6,860(1) A | 6,880(1) A |
| c (A) | 19,652(6) A | 19,706(3) A |
| a° | ||
| P° | 114,98(2)° | 114,79(1)° |
| 7o | ||
| Grupo de espacio | C2 | C2 |
| Moléculas/unidad asimétrica |
o la forma de monoclorhidrato H.75-3 que contiene 0,75 equivalentes de H2O y que tiene un patrón de difracción de rayos X que comprende picos a 5,0, 7,0, 8,1, 11,4, 13,4, 14,0, 14,5, 18,6, 19,4 y 20,0 grados 2ftt0,1, cuando se mide con radiación de Kcx de Cu;
5 hasta de 160°C a 180°C, y aislar la forma HT-S.
11. Uso de monoclorhidrato de saxagllptlna cristalino según una cualquiera de las reivindicaciones 1 a 5 solo o en combinación con uno o más tipos de agentes a ntl di abéticos y/o uno o más de otros tipos de agentes terapéuticos que pueden administrarse por vía oral en la misma forma de dosificación para la preparación de un medicamento en una forma de dosificación separada o mediante inyección.
10 12. Composición farmacéutica que comprende monoclorhidrato de saxagliptina cristalino según una cualquiera de
las reivindicaciones 1 a 6, en la que la humedad relativa en equilibrio de la composición es menor del 50%.
13. Composición farmacéutica según la reivindicación 12, en la que la humedad relativa en equilibrio de la composición es de desde el 10% hasta el 40%.
14. Uso de la forma IV-S de monoclorhidrato de saxagliptina según la reivindicación 6 para la preparación de la 15 forma HT-IV-S de monoclorhidrato de saxagliptina según la reivindicación 5.
Patentes similares o relacionadas:
Reducción de tejido adiposo, del 22 de Julio de 2020, de Dobak, John, Daniel: Una formulacion farmaceutica inyectable que comprende: (i) polidocanol en una cantidad del 0,5 % p/v al 2,0 % p/v; e (ii) un alcohol C3-C6 en una cantidad del […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Macrocíclico y composición que comprende el mismo, del 8 de Julio de 2020, de Shenzhen TargetRx, Inc: Un compuesto macrocíclico sustituido, que es un compuesto macrocíclico representado por la fórmula (I), o una forma cristalina, una sal farmacéuticamente […]
Compuestos de 6-aril-4-(morfolin-4-il)-1H-piridin-2-ona útiles para el tratamiento del cáncer y la diabetes, del 1 de Julio de 2020, de Sprint Bioscience AB: Un compuesto de la fórmula (I) **(Ver fórmula)** en donde R1 es arilo o heteroarilo, dicho arilo y dicho heteroarilo son mono o bicíclicos […]
Derivados de pirimidina como moduladores del receptor GLP-1, del 1 de Julio de 2020, de RECEPTOS LLC: Un compuesto que tiene la estructura de Fórmula I-R o I-S: **(Ver fórmula)** o un enantiómero, diastereómero, racemato, sal, hidrato o solvato farmacéuticamente […]
Composición para la utilización de cinamaldehído y zinc para gestionar el peso, del 1 de Julio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición la cual comprende cinamaldehído y zinc, para su uso en la prevención de la obesidad o el sobrepeso en un individuo con riesgo de padecerla, el tratamiento de […]
Compuestos de 6-heterociclil-4-morfolin-4-ilpiridin-2-ona útiles para el tratamiento del cáncer y la diabetes, del 1 de Julio de 2020, de Sprint Bioscience AB: Un compuesto de la Fórmula (I) **(Ver fórmula)** en donde R1, R2 y R3 se seleccionan independientemente de hidrógeno, haloalquiloC1-C3 […]
 Método para inhibir la reabsorción ósea, del 24 de Junio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina o fragmento del mismo para su uso en un método para el tratamiento de un trastorno relacionado con el hueso mediante […]
Método para inhibir la reabsorción ósea, del 24 de Junio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina o fragmento del mismo para su uso en un método para el tratamiento de un trastorno relacionado con el hueso mediante […]