FORMA CRISTALINA DE 1-CLORO-4-(BETA-D-GLUCOPIRANOS-1-IL)-2-(4-((S)-TETRAHIDROFURAN-3-ILOXI)-BENCIL)-BENCENO, UN METODO PARA SU PREPARACION Y SU USO PARA PREPARAR MEDICAMENTOS.
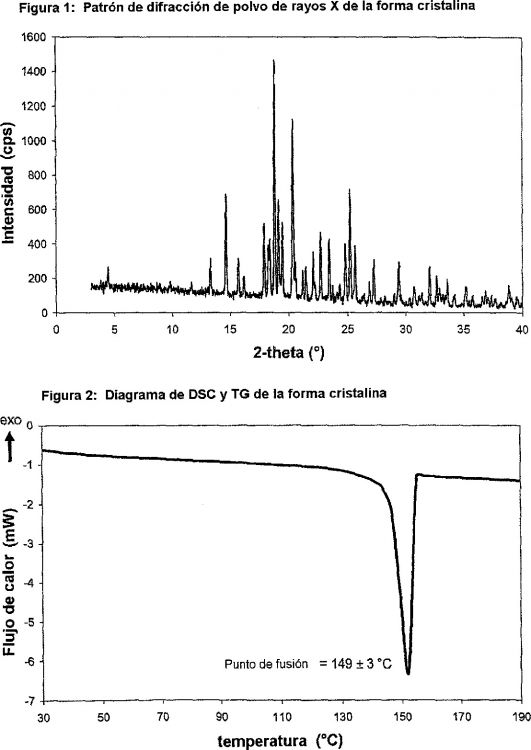
Forma cristalina de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((S)-tetrahidrofuran-3-iloxi)-bencil]-benceno que tiene un patrón de difracción de polvo de rayos X que comprende picos a 18,
84, 20,36 y 25,21 grados 2 ? (±0,05 grados 2 ?), donde dicho patrón de difracción de polvo de rayos X se realiza usando radiación de CuKa 1
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/061956.
Solicitante: BOEHRINGER INGELHEIM INTERNATIONAL GMBH
BOEHRINGER INGELHEIM PHARMA GMBH & CO.KG.
Nacionalidad solicitante: Alemania.
Dirección: BINGER STRASSE 173,55216 INGELHEIM AM RHEIN.
Inventor/es: ECKHARDT, MATTHIAS, HIMMELSBACH, FRANK, SICK,SANDRA, SCHUEHLE,MARTIN, MARTIN,HANS-JURGEN.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07D405/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 405/00 Compuestos heterocíclicos que contienen a la vez uno o más heterociclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo y uno o más heterociclos que tienen átomos de nitrógeno como único heteroátomo del ciclo. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación PCT:
- A61K31/351 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no condensados con otro ciclo.
- C07D309/10 C07D […] › C07D 309/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo, no condensados con otros ciclos. › Atomos de oxígeno.
Fragmento de la descripción:
Forma cristalina de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((S)-tetrahidrofuran-3-iloxi)-bencil]-benceno, un método para su preparación y su uso para preparar medicamentos.
La invención se refiere a una forma cristalina de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((S)-tetrahidrofuran-3-iloxi)-bencil]-benceno, a un método para la preparación del mismo, así como al uso del mismo para preparar medicamentos.
Antecedentes de la invención
Fenil-C-glucósidos de la fórmula general
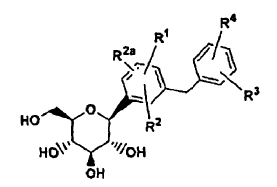
y su preparación y su posible actividad como inhibidores de SGLT2 y su posible uso en el tratamiento de diabetes son conocidos a partir de la solicitud internacional publicada WO 02/083066, que corresponde al documento EP 1 385 856.
El compuesto 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((S)-tetrahidrofuran-3-iloxi)-bencil]-benceno (en lo sucesivo citado como "compuesto A") se describe en la solicitud de patente internacional WO 2005/092877 y tiene la estructura química de acuerdo con la fórmula
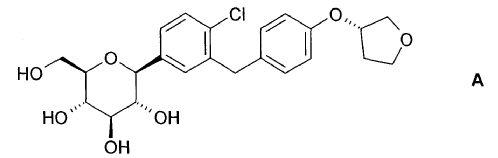
Los compuestos descritos en este documento tienen un efecto inhibidor valioso sobre el cotransportador de glucosa dependiente de sodio SGLT, particularmente SGLT2. El método de fabricación del compuesto A como se describe en este documento no produce una forma cristalina.
Por supuesto, el pre-requisito básico a cumplir por un agente farmacéuticamente activo antes de aprobarlo como medicamento en el mercado es una cierta actividad farmacéutica. Sin embargo, existe una diversidad de requisitos adicionales que tiene que cumplir un agente farmacéuticamente activo. Estos requisitos se basan en diversos parámetros que están relacionados con la naturaleza de la propia sustancia activa. Sin ser restrictivo, son ejemplos de estos parámetros la estabilidad del agente activo en diversas condiciones ambientales, su estabilidad durante la producción de la formulación farmacéutica y la estabilidad del agente activo en las composiciones de medicamento final. La sustancia farmacéuticamente activa usada para preparar las composiciones farmacéuticas debe ser tan pura como sea posible y su estabilidad en el almacenamiento a largo plazo debe garantizarse en diversas condiciones ambientales. Esto es esencial para prevenir el uso de composiciones farmacéuticas que contengan, además de la sustancia activa real, productos de degradación de la misma, por ejemplo. En estos casos, el contenido de la sustancia activa en el medicamento podría ser menor que el especificado.
La distribución uniforme del medicamento en la formulación es un factor crítico, particularmente cuando el medicamento tiene que administrarse en bajas dosis. Para asegurar una distribución uniforme, el tamaño de partículas de la sustancia activa puede reducirse hasta un nivel adecuado, por ejemplo por trituración. Como tiene que evitarse la degradación de la sustancia farmacéuticamente activa como efecto secundario de la trituración (o micronización) en la medida de lo posible, a pesar de las duras condiciones requeridas durante el proceso, es esencial que la sustancia activa sea muy estable a lo largo del proceso de trituración. Sólo si la sustancia activa es suficientemente estable durante el proceso de trituración, es posible producir una formulación farmacéutica homogénea que siempre contenga la cantidad especificada de sustancia activa de una manera reproducible.
Otro problema que puede surgir en el proceso de trituración para preparar la formulación farmacéutica deseada es la entrada de energía producida por este proceso y la tensión sobre la superficie de los cristales. En ciertas circunstancias, esto puede ocasionar cambios polimórficos, una amorfización o un cambio en la red cristalina. Como la calidad farmacéutica de una formulación farmacéutica requiere que la sustancia activa siempre tenga la misma morfología cristalina, también desde este punto de vista la estabilidad y las propiedades de la sustancia cristalina activa están sujetas a requisitos rigurosos.
La estabilidad de una sustancia farmacéuticamente activa también es importante en las composiciones farmacéuticas para determinar el periodo de validez del medicamento particular; el periodo de validez es el periodo de tiempo durante el cual el medicamento puede administrarse sin riesgo alguno. Por lo tanto, es una ventaja adicional tanto para el paciente como para el fabricante la alta estabilidad de un medicamento en las composiciones farmacéuticas mencionadas anteriormente en diversas condiciones de almacenamiento.
La absorción de humedad reduce el contenido de sustancia farmacéuticamente activa como resultado del aumento de peso debido a la captación de agua. Las composiciones farmacéuticas con tendencia a absorber humedad tienen que protegerse de la humedad durante el almacenamiento, por ejemplo mediante la adición de agentes de secado adecuados o conservando el fármaco en un medio en el que esté protegido de la humedad. Por lo tanto, preferiblemente, una sustancia farmacéuticamente activa debe ser sólo ligeramente higroscópica.
Además, la disponibilidad de una forma cristalina bien definida permite la purificación del fármaco por recristalización.
Aparte de los requisitos indicados anteriormente, en general debe tenerse presente que cualquier cambio en el estado sólido de una composición farmacéutica que es capaz de mejorar su estabilidad física y química proporciona una ventaja significativa con respecto a formas estables del mismo medicamento.
De esta manera, el objetivo de la invención es proporcionar una forma cristalina estable del compuesto A que satisface requisitos importantes impuestos sobre sustancias farmacéuticamente activas como los mencionados anteriormente.
Objeto de la invención
En un primer aspecto, la presente invención se refiere a una forma cristalina del compuesto A.
En un segundo aspecto, la presente invención se refiere a la forma cristalina del compuesto A que tiene un patrón de difracción de polvo de rayos X que comprende picos a 18,84, 20,36 y 25,21 grados 2? (
En un tercer aspecto, la presente invención se refiere al compuesto A en el que al menos 50% de dicha sustancia está presente en forma de una forma cristalina como se ha definido anteriormente y como se define a continuación en este documento.
En vista de la eficacia farmacéutica del compuesto A, un cuarto aspecto de la presente invención se refiere a una composición farmacéutica o medicamento que comprende una forma cristalina como se ha definido anteriormente y como se define a continuación en este documento.
En un quinto aspecto, la presente invención se refiere a un uso de una forma cristalina como se ha definido anteriormente o como se define a continuación en este documento para preparar una composición farmacéutica que es adecuada para el tratamiento o prevención de enfermedades o afecciones que pueden estar influenciadas por la inhibición del cotransportador de glucosa dependiente de sodio SGLT, preferiblemente SGLT2.
En un sexto aspecto, la presente invención se refiere a un uso de una forma cristalina como se ha definido anteriormente o como se define a continuación en este documento para preparar una composición farmacéutica que es adecuada para el tratamiento o prevención de trastornos metabólicos.
En un séptimo aspecto, la presente invención se refiere a un uso de una forma cristalina como se ha definido anteriormente o como se define a continuación en este documento para preparar una composición farmacéutica para inhibir el cotransportador de glucosa dependiente de sodio SGLT2.
En un octavo aspecto, la presente invención se refiere a un uso de una forma cristalina como se ha definido anteriormente o como se define a continuación en este documento para preparar una composición farmacéutica para prevenir la degeneración de células beta pancreáticas y/o para mejorar y/o restablecer la funcionalidad de células beta pancreáticas.
En un noveno aspecto, la presente invención se refiere a un uso de una forma cristalina como se ha definido anteriormente y como se define a continuación en este documento para preparar una composición farmacéutica para prevenir, ralentizar, retardar o tratar enfermedades o afecciones...
Reivindicaciones:
1. Forma cristalina de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((S)-tetrahidrofuran-3-iloxi)-bencil]-benceno que tiene un patrón de difracción de polvo de rayos X que comprende picos a 18,84, 20,36 y 25,21 grados 2 ? (
2. La forma cristalina de acuerdo con la reivindicación 1, donde el patrón de difracción de polvo de rayos X comprende además picos a 14,69, 19,16 y 19,50 grados 2 ? (
3. 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((S)-tetrahidrofuran-3-iloxi)-bencil]-benceno, en donde al menos 50% de dicha sustancia está presente en forma de la forma cristalina de acuerdo con la reivindicación 1 ó 2.
4. Una composición farmacéutica que comprende la forma cristalina de acuerdo con la reivindicación 1 ó 2.
5. Uso de la forma cristalina de acuerdo con la reivindicación 1 ó 2 para preparar una composición farmacéutica que es adecuada para el tratamiento o prevención de enfermedades o afecciones que pueden estar influenciadas por la inhibición del cotransportador de glucosa dependiente de sodio SGLT.
6. Uso de la forma cristalina de acuerdo con la reivindicación 1 ó 2 para preparar una composición farmacéutica que es adecuada para el tratamiento o prevención de trastornos metabólicos, en particular de un trastorno metabólico seleccionado entre el grupo consistente en diabetes mellitus de tipo 1 y de tipo 2, complicaciones de la diabetes, acidosis o cetosis metabólica, hipoglucemia reactiva, hiperinsulinemia, trastorno metabólico de glucosa, resistencia a la insulina, síndrome metabólico, dislipidemias de diferentes orígenes, aterosclerosis y enfermedades relacionadas, obesidad, hipertensión arterial, insuficiencia cardiaca crónica, edema y hiperuricemia.
7. Uso de la forma cristalina de acuerdo con la reivindicación 1 ó 2 para preparar una composición farmacéutica para tratar la diabetes, en particular diabetes mellitus de tipo 1 y de tipo 2, y/o complicaciones diabéticas.
8. Uso de la forma cristalina de acuerdo con la reivindicación 1 ó 2 para preparar una composición farmacéutica para inhibir el cotransportador de glucosa dependiente de sodio SGLT2.
9. Uso de la forma cristalina de acuerdo con la reivindicación 1 ó 2 para preparar una composición farmacéutica para prevenir la degeneración de células beta pancreáticas y/o para mejorar y/o restablecer la funcionalidad de las células beta pancreáticas.
10. Uso de la forma cristalina de acuerdo con la reivindicación 1 ó 2 para preparar una composición farmacéutica para prevenir o tratar el sobrepeso, la obesidad, la obesidad visceral y/o la obesidad abdominal.
11. Un método para preparar la forma cristalina de acuerdo con la reivindicación 1 ó 2, comprendiendo dicho método las siguientes etapas:
(a) disolver 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((S)-tetrahidrofuran-3-iloxi)-bencil]-benceno en un disolvente o una mezcla de disolventes para formar una solución saturada o casi saturada;
(b) almacenar la solución para precipitar la forma cristalina de acuerdo con la reivindicación 1 ó 2 de la solución y para producir de esta manera una suspensión;
(c) aislar el precipitado de la suspensión ; y
(d) secar el precipitado hasta que se haya retirado cualquier exceso de dicho disolvente o mezcla de disolventes.
Patentes similares o relacionadas:
Compuestos heterocíclicos que activan AMPK y métodos de uso de los mismos, del 29 de Julio de 2020, de RIGEL PHARMACEUTICALS, INC.: Un compuesto que es N-((cis)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; N-((3S,4S)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Compuestos utilizados como inhibidores de la quinasa reordenada durante la transfección (RET), del 1 de Julio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto de acuerdo con la Fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: X es N o CR5; Y es un enlace; […]
Forma cristalina de un derivado de benzimidazol y un método de preparación del mismo, del 24 de Junio de 2020, de HK INNO.N CORPORATION: Una forma cristalina A de un compuesto representado por la siguiente Fórmula 1 que tiene un patrón de difracción de rayos X en polvo usando radiación Cu-Kα, con picos […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]
Derivados de N-piperidinil acetamida como bloqueadores de canales de calcio, del 20 de Mayo de 2020, de Praxis Precision Medicines, Inc: Una composición farmacéutica que comprende un compuesto que tiene la estructura: **(Ver fórmula)** o una sal o conjugado farmacéuticamente […]