Composición farmacéutica para terapia de reemplazo enzimático.
Una proteína que se selecciona de (a) y (b) a continuación:
(a) una proteína que tiene actividad α
-galactosidasa, que comprende una secuencia de aminoácidos de SEC ID Nº: 6 donde el aminoácido 202 de la secuencia de aminoácidos de SEC ID Nº: 6 se sustituye por ácido glutámico o ácido aspártico mientras que el aminoácido 205 de la secuencia de aminoácidos de SEC ID Nº: 6 se sustituye por leucina, valina o isoleucina; y
(b) una proteína que tiene actividad α-galactosidasa y que comprende una secuencia de aminoácidos donde de uno a diez aminoácidos distintos de los aminoácidos sustituidos 202 y 205 se suprimen, sustituyen o añaden en la secuencia de aminoácidos en (a) y donde los aminoácidos 42 a 45, 59, 91 a 95, 131 a 141, 164 a 172, 206, 223 a 234, 256 a 268 y 364 en la secuencia de aminoácidos en (a) no están mutados.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2008/059604.
Solicitante: Tokyo Metropolitan Institute of Medical Science.
Nacionalidad solicitante: Japón.
Dirección: 1-6, Kamikitazawa 2-chome Setagaya-ku Tokyo 156-0057 JAPON.
Inventor/es: SAKURABA,HITOSHI, TAJIMA,YOUICHI, KAWASHIMA,IKUO, AIKAWA,SEIICHI, AIKAWA,FUMIKO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/43 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Enzimas; Proenzimas; Sus derivados.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- A61P3/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00).
- C07K19/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N1/15 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N1/19 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/09 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12N9/40 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre los enlaces alfa-galactosa-glicósido, p. ej. alfa-galactosidasa.
PDF original: ES-2549121_T3.pdf
Fragmento de la descripción:
Composición farmacéutica para terapia de reemplazo enzimático Campo de la invención
La presente invención se refiere a una nueva enzima altamente funcional con una especificidad de sustrato alterada, específicamente una proteína recombinante que tiene actividad a-galactosidasa. La enzima puede usarse en una composición farmacéutica para terapia de reemplazo enzimático, específicamente para tratar enfermedad de Fabry.
Antecedentes de la técnica
Para la deficiencia enzimática hereditaria, para la que no se conocen hasta la fecha tratamientos radicales, se ha desarrollado gradualmente terapia de reemplazo enzimático en la que se produce una enzima por ingeniería genética y después se administra al vaso sanguíneo por goteo intravenoso o similar. Como ejemplo, la deficiencia enzimática hereditaria, cuya frecuencia es relativamente alta y que se designa como una enfermedad especifica (enfermedad intratable), la enfermedad de Fabry (deficiencia de a-galactosidasa hereditaria, también denominada enfermedad lisosómica, que es una de las enfermedades genéticas) es muy conocida (véase Kenneth J. Dean et al., Fabry Disease, "Practical Enzymology of the Sphingolipidoses", U.S.A., Aln R. Liss, Inc., 1997, p. 173-216).
La enfermedad de Fabry es un trastorno metabólico de glucolípidos que se desarrolla de la siguiente manera: como resultado de una disminución de la actividad o deficiencia de una enzima denominada "a-galactosidasa", presente en el lisosoma, uno de los orgánulos intracelulares humanos, un glucolípido denominado globotriaosilceramida (GL-3; también denominado trihexósido de ceramida (THC)), que es un sustrato in vivo de la enzima, no se degrada y por lo tanto se acumula en el organismo (por ejemplo, en los vasos sanguíneos, piel, córnea, nervios, riñones y en el corazón).
Dado que un gen que codifica la a-galactosidasa se encuentra en el cromosoma X, esta enfermedad tiene una herencia asociada al cromosoma X. Por lo tanto, en esta enfermedad, se presenta una característica clínica definida principalmente en hombres hemicigotos. Se cree que la "enfermedad de Fabry clásica", que sigue una evolución clínica típica, se desarrolla en aproximadamente uno de cada 40.000 niños. Síntomas tales como dolor en la mano y en el pie, hlpohldrosls, angloqueratoma y opacidad de la córnea, aparecen durante la infancia y la adolescencia; estos síntomas progresan y después provocan daño orgánico sistémico tal como insuficiencia renal, insuficiencia cardiaca y trastorno cerebrovascular en la edad adulta o posteriormente, lo que se convierte en una causa de muerte. También existe la "enfermedad de Fabry variante", que no sigue dicha evolución clínica típica, tal como la "enfermedad de Fabry clásica" y que se desarrolla tarde y sigue una evolución relativamente moderada. En pacientes con este tipo de enfermedad, se observa una actividad a-galactosidasa remanente, aunque es baja. Como una enfermedad de Fabry variante, por ejemplo, se conoce la "enfermedad de Fabry cardiaca", que provoca la acumulación de glucolípidos anteriormente mencionada principalmente en el corazón. En consecuencia, se produce hipertrofia cardiaca, y se provocan trastornos tales como insuficiencia cardiaca y arritmia. Por otro lado, en mujeres pacientes heterocigotas con enfermedad de Fabry, se observan diversos tipos de características clínicas de acuerdo con las características del cromosoma X. Específicamente, los casos varían de casos graves, que son similares a los de hombres hemicigotos, a casos en los que no se observan sustancialmente ningún síntoma. Sin embargo, de acuerdo con investigaciones recientes, se ha puesto de manifiesto que la mayoría de las mujeres pacientes heterocigotas con enfermedad de Fabry desarrollan algún tipo de síntoma con la edad. Existe el punto de vista de que estas mujeres no deberían considerarse "portadoras" sino "pacientes".
Recientemente, también se ha establecido la terapia de reemplazo enzimático para enfermedad de Fabry, y se ha usado ampliamente una a-galactosidasa humana recombinante producida en una célula derivada de mamíferos como un elemento activo de un agente terapéutico de enfermedad de Fabry en la terapia anterior (véase Eng CM et al., Am J Hum Genet, 68: 711-722 (2001); Eng CM et al., N Engl J Med, 345: 9-16 (2001); y Schiffmann R et al., Proc Nati Acad Sci USA, 97: 365-370 (2000)).
También se ha propuesto un método en el que puede usarse una a-galactosidasa humana recombinante producida con una célula no animal (por ejemplo, de levadura) como un hospedador para el tratamiento de la enfermedad de Fabry (terapia de reemplazo enzimático) (véase la Publicación de Solicitud de Patente No Examinada Japonesa n° 2002-369692), un método terapéutico génlco en el que una enzima se reemplaza introduciendo un gen que codifica la a-galactosidasa humana en una célula de un tejido afectado para expresar el gen (véase Publicación de Solicitud de Patente No Examinada Japonesa (Traducción de la Solicitud de PCT) N° 2002-522509), y similares.
Divulgación de la invención
Sin embargo, dado que con frecuencia se administra un agente enzimático existente, usado para el reemplazo enzimático para el tratamiento de enfermedad de Fabry, a pacientes que no tienen la enzima (a-galactosidasa humana) desde el principio, la enzima contenida en el agente terapéutico se reconoce como una sustancia extraña
en muchos pacientes a los que se administra el agente enzimático, y se produce un anticuerpo, dando como resultado un problema de efectos secundarios adversos a una alta frecuencia, principalmente, reacciones alérgicas. Dicho problema se produce de forma similar en el caso en el que la enzima se reemplace usando un procedimiento terapéutico génico.
Además, dicho agente enzimático usado para el reemplazo enzimático se administra en los vasos sanguíneos, pero la a-galactosidasa es en sí misma inestable en la sangre. En consecuencia, en la terapia actual, el agente enzimático debe administrarse frecuentemente (una vez cada dos semanas), y puede ser necesario aumentar la dosificación por cada administración. Además, la a-galactosidasa humana (a-GAL) tiene un número relativamente pequeño de cadenas de azúcares (cadenas de azúcares de tipo N) con los que puede unirse un resto de manosa-6- fosfato (M6P) para la captación por una célula (más específicamente, por un lisosoma en una célula) de un órgano afectado. Por lo tanto, la captación de a-GAL por una célula a través de la sangre es difícil. En particular, las eficacias de captación en el riñón o corazón, órganos afectados predominantemente por la enfermedad de Fabry, son bajas, y por lo tanto el efecto terapéutico para nefropatía o cardiopatía apenas es suficiente. Por consiguiente, para permitir que una célula diana capte una determinada cantidad de enzima después de la terapia, se requiere una gran cantidad de enzima. En consecuencia, para el reemplazo enzimático, es necesario administrar un agente enzimático más frecuentemente y en mayor cantidad. Dicha terapia supone una gran carga física, mental y económica para los pacientes y, por lo tanto, afecta de forma adversa a la "calidad de vida (CDV)".
Por consiguiente, es un objeto de la presente Invención proporcionar una composición farmacéutica para tratar la enfermedad de Fabry, que usa una proteína que tiene actividad a-GAL, que no muestra efectos secundarios alérgicos, que es altamente estable en sangre (en plasma) y que puede captar fácilmente una célula de un órgano afectado. También es un objeto de la presente Invención proporcionar una nueva enzima altamente funcional con una especificidad de sustrato alterada, como la proteína anteriormente mencionada que tiene actividad a-GAL.
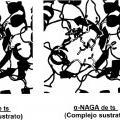
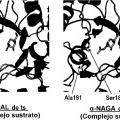
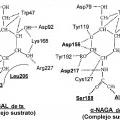
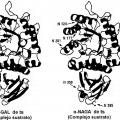
Los presentes inventores realizaron estudios intensivos para resolver los problemas anteriores. Como resultado, los presentes Inventores se centraron en una "a-N-acetilgalactosamlnldasa (a-NAGA)", una proteína que tiene una especificidad de sustrato diferente de la de a-GAL pero que tiene una estructura general muy similar a la de a-GAL. Los presentes Inventores han pensado que el problema anterior puede resolverse si se usa una nueva enzima altamente funcional (un muíante de a-NAGA), obtenida alterando la especificidad de sustrato de a-NAGA mediante la alteración de la estructura del sitio activo de a-NAGA para adquirir actividad a-GAL, como un elemento activo de una composición farmacéutica para tratar la enfermedad de Fabry que puede usarse para terapia de reemplazo enzimático.
Sin embargo, en la técnica, se conocen generalmente los siguientes hechos.
1) Cuando una parte de los aminoácidos de una proteína se sustituye por un aminoácido diferente, es posible que se altere el estado de la acción mutua (enlace... [Seguir leyendo]
Reivindicaciones:
1. Una proteína que se selecciona de (a) y (b) a continuación:
(a) una proteína que tiene actividad a-galactosidasa, que comprende una secuencia de aminoácidos de SEC ID N°: 6 donde el aminoácido 202 de la secuencia de aminoácidos de SEC ID N°: 6 se sustituye por ácido glutámico o ácido aspártico mientras que el aminoácido 205 de la secuencia de aminoácidos de SEC ID N°: 6 se sustituye por leucina, valina o isoleucina; y
(b) una proteína que tiene actividad a-galactosidasa y que comprende una secuencia de aminoácidos donde de uno a diez aminoácidos distintos de los aminoácidos sustituidos 202 y 205 se suprimen, sustituyen o añaden en la secuencia de aminoácidos en (a) y donde los aminoácidos 42 a 45, 59, 91 a 95, 131 a 141, 164 a 172, 206, 223 a 234, 256 a 268 y 364 en la secuencia de aminoácidos en (a) no están mutados.
2. Una proteína de acuerdo con la reivindicación 1, en la que el aminoácido sustituido 202 de la proteína de la reivindicación 1 (a) es ácido glutámico mientras que el aminoácido sustituido 205 de la proteína de (a) anterior es leucina.
3. Una proteína de acuerdo con la reivindicación 1 o 2 para uso en un método para tratar la enfermedad de Fabry.
4. Un gen que se selecciona de (a) y (b) a continuación:
(a) un gen que codifica la proteína de acuerdo con una cualquiera de las reivindicaciones 1 a 3; y
(b) un gen que codifica una proteína que tiene actividad a-galactosidasa y que comprende ADN que comprende una secuencia de nucleótidos de SEC ID N°: 5 donde los nucleótidos 604-606 de la secuencia de nucleótidos de SEC ID N°: 5 se sustituyen por nucleótidos de un codón de ácido glutámico o ácido aspártico, donde los nucleótidos 613-615 de la secuencia de nucleótidos de SEC ID N°: 5 se sustituyen por nucleótidos de un codón de leucina, valina o isoleucina y donde los nucleótidos 124 a 135, 175 a 177, 271 a 285, 391 a 423, 490 a 516, 616 a 618, 667 a 702, 766 a 804 y 1.090 a 1.092 de la secuencia de nucleótidos de SEC ID N°: 5 no están mutados.
5. Un gen de acuerdo con la reivindicación 4, donde los nucleótidos sustituidos 604-606 del gen de la reivindicación 4 (b) anterior son nucleótidos de un codón de ácido glutámico mientras que los nucleótidos sustituidos 613-615 del gen de la reivindicación 4 (b) son nucleótidos de un codón de leucina.
6. Un vector recombinante que comprende el gen de acuerdo con la reivindicación 4 o 5.
7. Un transformante que comprende un vector recombinante de acuerdo con la reivindicación 6.
8. Un método para producir una proteína, que comprende las etapas de: cultivar el transformante de acuerdo con la reivindicación 7; y recoger una protelna que tiene actividad a-galactosidasa del producto cultivado resultante.
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Plekhg5 como diana farmacéutica para trastornos neurológicos, del 15 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Plekhg5 como diana farmacéutica para trastornos neurológicos. La invención hace referencia al uso del gen Plekhg5 como diana farmacológica para el cribado, […]
Ratón nuligénico para Pint que muestra un fenotipo asociado a envejecimiento prematuro, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un ratón cuyo genoma comprende una inactivación de un locus del ARN no codificante largo (ARNlnc) Pint endógeno, en donde la inactivación (i) da como resultado que el […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]