Composición farmacéutica novedosa que comprende un fármaco inmunosupresor macrólido.
Una composición farmacéutica tópica que comprende:
- un principio terapéuticamente activo seleccionado del grupo que consiste en sirolimus,
everolimus, tacrolimus, pimecrolimus, ridaforolimus, temsirolimus y zotarolimus,
- un componente hidrófilo;
- un componente lipófilo; y
- un componente anfifílico,
en la que la microemulsión se formula como una microemulsión; en la que el componente hidrófilo comprende una combinación de agua y un glicol líquido que se selecciona preferentemente entre glicerol, propilenglicol,
1,2-pentilenglicol y polietilenglicol; y en la que la relación de agua con respecto al glicol líquido está en el intervalo de 1:10 a 10:1.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2010/064965.
Solicitante: Skinomics GmbH.
Nacionalidad solicitante: Alemania.
Dirección: Weinbergweg 23 06120 Halle (Saale) ALEMANIA.
Inventor/es: GÖBEL,ALEXANDRA SABINE BÄRBEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/436 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo el sistema heterocíclico un ciclo de seis eslabones teniendo el oxígeno como heteroátomo del ciclo, p. ej. rapamicina.
- A61K9/107 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Emulsiones.
PDF original: ES-2552803_T3.pdf
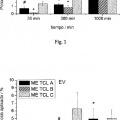



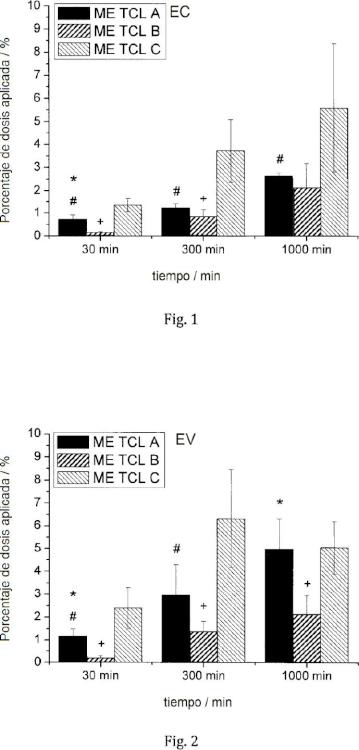
Patentes similares o relacionadas:
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Tratamiento de disfunción eréctil y otras indicaciones, del 1 de Julio de 2020, de STRATEGIC SCIENCE & TECHNOLOGIES, LLC: Una composición para su uso en un método de tratamiento de la disfunción sexual en un sujeto, preferiblemente un sujeto humano, comprendiendo la composición: […]
Formulaciones parenterales mejoradas de agentes farmacéuticos lipófilos y procedimientos de preparación y uso de las mismas, del 1 de Julio de 2020, de PLATFORM BRIGHTWORKS TWO, LTD: Una solución homogénea no acuosa que comprende un agente farmacéutico lipófilo solubilizado y un disolvente polimérico líquido anfifílico, que […]
COMPLEJO MICELAR TERNARIO FORMADO POR UN SIALOGLICOESFINGOLÍPIDO, UNA SUSTANCIA TERAPÉUTICAMENTE ACTIVA Y UN ANTICUERPO, del 18 de Junio de 2020, de CONSEJO NACIONAL DE INVESTIGACIONES CIENTIFICAS Y TECNICAS (CONICET) (33.3%): Una composición farmaceútica soluble en solución acuosa caracterizada porque comprende sialoglicoesfingolípidos; polipéptidos seleccionados del conjunto comprendido […]
Producto de solubilización de resveratrol para fines farmacéuticos, del 27 de Mayo de 2020, de AQUANOVA AG: Producto de solubilización que consiste en resveratrol y polisorbato 80 y polisorbato 20 así como al menos un triglicérido de cadena media […]
Composición farmacéutica tópica a base de alcanos semifluorados, del 13 de Mayo de 2020, de NOVALIQ GMBH: Una composición farmacéutica tópica para usar en la prevención o el tratamiento de una enfermedad o afección que afecta la piel o un apéndice de la piel, que comprende […]
Agente terapéutico para la disfunción meibomiana, del 6 de Mayo de 2020, de SANTEN PHARMACEUTICAL CO., LTD.: Una composición farmacéutica que comprende sirolimus a una concentración de 0,01 a 0,5% (p/v) como único ingrediente activo para uso en la supresión de la obstrucción de […]
Agente de direccionamiento para células cancerosas o fibroblastos asociados con cáncer, del 29 de Abril de 2020, de NITTO DENKO CORPORATION: Composición para su uso en el tratamiento de cáncer en el que están implicados fibroblastos asociados con cáncer, caracterizada porque la composición comprende un portador […]