Composición farmacéutica en aerosol.
Composición estéril para la administración como un aerosol, que comprende un agente activo muy poco soluble en agua,
un componente tensioactivo no iónico y un componente fosfolipídico, en la que el agente activo no es un tensioactivo, en la que la relación en peso entre el componente tensioactivo no iónico y el componente fosfolipídico es de 1:5 a 1:20, y en la que la composición está en forma de un líquido acuoso que es una disolución o dispersión coloidal isotrópica o anisotrópica que comprende estructuras coloidales que son liposomas.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/003147.
Solicitante: PARI PHARMA GMBH.
Nacionalidad solicitante: Alemania.
Dirección: MOOSSTRASSE 3 82319 STARNBERG ALEMANIA.
Inventor/es: KELLER, MANFRED, LINTZ,FRANK-CHRISTOPHE, FRIEDRICH,INGO, JAUERNIG,JÜRGEN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/58 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que contienen heterociclos, p. ej. aldosterona, danazol, estanozolol, pancuronium, digitogenina (digitoxina A61K 31/704).
- A61K38/13 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Ciclosporinas.
- A61K9/12 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aerosoles; Espumas.
- A61M15/00 A61 […] › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › Inhaladores.
- A61P11/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del aparato respiratorio.
- A61P37/02 A61P […] › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Inmunomoduladores.
PDF original: ES-2548857_T3.pdf
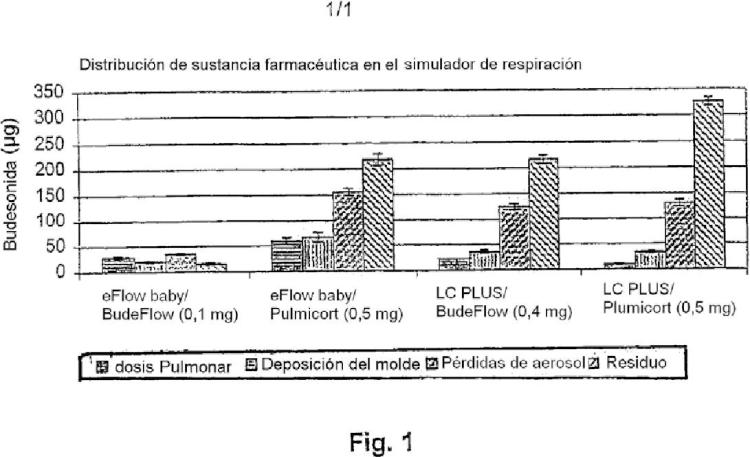
Fragmento de la descripción:
Composición farmacéutica en aerosol Campo técnico de la invención
La invención se refiere a composiciones, que son útiles como medicamentos, o componentes de medicamentos, 5 para inhalación en forma de aerosol. Las composiciones contienen un agente activo y pueden ser usadas farmacéuticamente o para promover bienestar general. En particular, la invención se refiere a preparaciones acuosas estériles para inhalación usando una bomba de rocío, un nebulizador, tal como un nebulizador de chorro, ultrasónico o de membrana vibrante, u otro sistema de generación de aerosol adecuado para líquidos acuosos. Además se refiere a la administración nasal o pulmonar de agentes activos fisicoquímica, organoléptica o 10 fisiológicamente problemáticos. De conformidad con realizaciones adicionales, la invención se refiere a métodos para la fabricación de tales composiciones y sus usos.
Antecedentes de la invención
El tratamiento de enfermedades pulmonares por medio de aerosoles permite una terapia farmacéutica selectiva, porque el agente activo puede ser suministrado directamente al sitio diana farmacológico por medio de dispositivos 15 de inhalación [D. Kóhler y W. Fleischer: Therorie and Praxis der Inhalationstherapie, Arcis Verlag GmbH, München, 2000, ISBN 3-89075-140-7], Esto requiere que las gotas o partículas inhaladas alcancen el tejido diana y se depositen allí. Cuanto menor es el diámetro de las partículas de aerosol, mayor es la probabilidad de que los agentes activos alcancen las partes periféricas de los pulmones. Dependiendo del tipo y extensión de la deposición, se pueden tratar enfermedades tales como asma, enfermedad pulmonar obstructiva crónica (COPD) o enfisema 20 pulmonar, casi tópicamente por inhalación. Además, agentes sistémicamente activos tales como insulina pueden ser administrados al pulmón y absorbidos en la circulación sanguínea por absorción predominante alveolar. En la actualidad, para la administración de agentes activos por inhalación se usan inhaladores de dosis medida impulsados principalmente por gas propulsor, inhaladores en polvo y nebulizadores. El tipo y extensión de la deposición en el sitio diana depende del tamaño de partícula o gota, la anatomía del aparato respiratorio de seres 25 humanos o animales, y del patrón de respiración. Para la deposición de aerosoles en los pulmones de roedores tales como ratas, debido a las menores dimensiones del aparato respiratorio, se requieren gotas mucho más pequeñas que, por ejemplo, para caballos.
Para deposición pulmonar en adultos, las gotas o partículas en aerosol deben tener un diámetro aerodinámico menor que 5-6 pm, y para lactantes, menor que 2-3 pm. Además, los lactantes respiran a través de la nariz; esta 30 es la razón por la que deben ser usados sistemas de nebulización con una máscara nasal para la administración de agentes activos por inhalación. Esta restricción también se aplica en el caso de otras especies tal como roedores. Las influencias en la generación y deposición de aerosol están Influidas principalmente por 3 factores, los cuales pueden ser categorizados como sigue:
(1) factores bio-fisiológicos, los cuales se caracterizan por:
35 - el tipo de maniobra de respiración, tal como frecuencia de respiración, flujo, caudal y volumen,
- la anatomía del aparato respiratorio, en particular la reglón glotal;
- la edad y el estado de salud del paciente;
(2) el espectro de gota o partícula, el cual está, a su vez, influido por:
- el tipo y construcción del dispositivo de inhalación,
40 - el intervalo de tiempo entre generación e inhalación (propiedades de secado),
- la modificación del espectro de gota o partícula por el flujo respiratorio,
- la estabilidad o integridad de la nube de aerosol generada;
(3) el agente activo o preparación del agente activo, cuyas propiedades están influidas por:
- el tamaño de partícula
45 - la forma de dosificación (por ejemplo, disolución, suspensión, emulsión, dispersión de liposoma),
- las propiedades de forma y superficie de las partículas del agente activo o las partículas portadoras (esferas lisas o estructuras porosas plegadas) en el caso de aerosoles en polvo,
- la higroscopia (influencia del crecimiento de las partículas),
- las propiedades interfaciales tales como humectabilidad y capacidad de dispersión,
- las propiedades de evaporación del medio portador.
Las ventajas y desventajas de los diversos dispositivos inhaladores y las posibilidades para compensar las desventajas inherentes se han discutido por M. Keller [Development and Treds in Pulmonary Drug Delivery, Chimica Oggi, Chemistry today, NO. 11/12, 1998].
La cuestión sobre dónde se depositan las partículas en aerosol en el árbol bronquial ha sido el sujeto de numerosas investigaciones durante varios años. Estas investigaciones son complementadas por modelos computacionales constantemente mejorados de deposición pulmonar. El patrón de deposición regional en la respiración a través de la boca muestra un alto grado de variabilidad debido a la maniobra de respiración y la anatomía variable del árbol bronquial. El intervalo de tamaño resplrable de 0,5-0,6 pm, el cual es frecuentemente mencionado en la bibliografía, no toma en cuenta las regiones de solapamiento de deposición ni las velocidades de deposición cuantitativas o relativas.
En un adulto saludable que respira a través de la boca, alrededor de 40-60% de las partículas en el intervalo de 2,5- 4,5 pm son depositadas preferiblemente en la región alveolar. Una deposición bronquial del orden de magnitud de alrededor de 5 - 28% es exhibida por partículas de 2 a 8 pm, mientras que la deposición orofaríngea se incrementa en paralelo. Para partículas de 6 pm, la deposición en el orofarlnge ya asciende a 25-45% y aumenta hasta 60-80% para partículas con un diámetro de 10 pm. Se concluye a partir de esto que, para una deposición alveolar cuantitativa y cualitativa óptima en adulto, son ventajosos tamaños de partícula de 1,5 - 3 pm si la deposición orofaríngea y bronquial ha de ser la mas baja posible. La deposición bronquial de alrededor de 18-28% para partículas en el Intervalo de tamaños de 6-9 pm, es relativamente baja y siempre está acompañada de una deposición orofaríngea correspondientemente mayor. Dependiendo del estado de salud, la geometría del sistema bronquial y la edad del paciente, el orden de magnitud señalado anteriormente cambia hacia tamaños de partículas más pequeños, en particular en niños y bebés. En el caso de lactantes de menos de 1 año de edad, se supone que únicamente gotas o partículas con un diámetro aerodinámico menor que 2-3 pm alcanzan las regiones más profundas de los pulmones en un grado significativo.
Para el tratamiento de sinusitis, también se conoce que solamente las gotas en aerosol más pequeñas alcanzan los senos paranasales a través de las aberturas de ostia pequeñas, de manera tal que más agente activo puede ser depositado en el sitio diana por medio de un pulso de aerosol que con nebulización continua.
La deposición de partículas en aerosol en el aparato respiratorio está determinada esencialmente por los siguientes cuatro parámetros:
el tamaño de las partículas,
la velocidad de las partículas,
la geometría del aparato respiratorio, y
la técnica de inhalación o maniobra de respiración.
Se puede derivar de las leyes de Stokes que la velocidad y densidad de flujo de partículas de aerosol son relevantes; esta es la razón por la que se usa el diámetro aerodinámico y no el diámetro geométrico de partículas como la cantidad a medir para el comportamiento de la deposición en el aparato respiratorio. Se conoce de diversas investigaciones que solamente se pueden emplear para terapia pulmonar tamaños de gota o partícula con un diámetro aerodinámico de alrededor de 0,6 - 6 pm. Las partículas con un diámetro aerodinámico mayor que alrededor de 6 pm impactan en las vías respiratorias altas, mientras que aquellas que son menores que 1 pm son exhaladas tras la inhalación. Esto implica que, por ejemplo, polvos con densidad muy baja y un diámetro aerodinámico de alrededor de 3 pm pueden tener un diámetro geométrico de, por ejemplo, mayor que 10 pm. Por el contrario, en sistemas acuosos con una densidad de alrededor de 1 mg/cm , los diámetros geométricos y aerodinámicos son aproximadamente iguales.
Las composiciones y forma de gota de aerosoles son muy diversas. Dependiendo en la composición, los aerosoles pueden tener un tiempo de vida corto o largo; su tamaño de gota o partícula está sometido a cambios, lo cual está influido por las propiedades fisicoquímicas... [Seguir leyendo]
Reivindicaciones:
1. Composición estéril para la administración como un aerosol, que comprende un agente activo muy poco soluble en agua, un componente tensioactivo no iónico y un componente fosfolipídico, en la que el agente activo no es un tensioactivo, en la que la relación en peso entre el componente tensioactivo no iónico y el componente fosfolipídico es de 1:5 a 1:20, y en la que la composición está en forma de un líquido acuoso que es una disolución o dispersión coloidal isotrópica o anisotrópica que comprende estructuras coloidales que son liposomas.
2. La composición de la reivindicación 1, en la que el componente tensioactivo no iónico comprende al menos un miembro del grupo que consiste en tiloxapol, polisorbatos, vitamina E TPGS, e hidroxiestearatos de macrogol.
3. La composición de la reivindicación 1, en la que el componente fosfolipídico comprende un fosfolípido bipolar o saturado, o una mezcla de tales fosfolípidos, y se selecciona preferiblemente del grupo que consiste en lecitina, lecitina purificada y/o enriquecida, fracciones de fosfatidilcolina extraídas de lecitina, dimiristoil fosfatidilcolina (DMPC), dipalmitoil fosfatidilcolina (DPPC) y diestearoil fosfatidilcolina (DSPC).
4. La composición de la reivindicación 1, que comprende además uno o más excipientes seleccionados de disolventes, codisolventes, ácidos, bases, agentes tamponantes, agentes osmóticos, estabilizantes, antioxidantes, agentes que enmascaran en sabor, sabores, agentes edulcorantes, tensioactivos iónicos, espesantes, agentes colorantes, cargas, y agentes para dar volumen.
5. La composición de la reivindicación 4, en la que el antioxidante se selecciona del grupo de acetato de vitamina E, sal (di)sódica de EDTA, y una mezcla de los mismos.
6. La composición de la reivindicación 1, en la que el tamaño medio de partículas de las estructuras coloidales es de 10 nm a 200 nm, y preferiblemente de 10 nm a 100 nm, con un índice de polidispersidad no mayor que 0,5, en particular no mayor que 0,3, estando la composición sustancialmente libre de partículas sólidas capaces de sedimentar.
7. La composición de la reivindicación 1, que tiene un contenido de componente tensioactivo no iónico de 0,01 a 5,0% en peso, y en particular de 0,05 a 2,0% en peso.
8. La composición de la reivindicación 1, que tiene un contenido de componente fosfolipídico 0,5 a 5% en peso, y en particular de 0,5 a 3% en peso.
9. La composición de la reivindicación 1, en la que el líquido acuoso tiene una tensión superficial de 30 a 75 mN/m, y preferiblemente de 40 a 70 mN/m.
10. La composición de la reivindicación 1, en la que el líquido acuoso tiene una viscosidad dinámica de 0,8 a 3,0 mPas, preferiblemente de 1,0 a 2,0 mPas.
11. La composición déla reivindicación 1, en la que el líquido acuoso tiene un pH de 4 a 8, preferiblemente de 4 a 6.
12. La composición de la reivindicación 1, en la que el líquido acuoso tiene una osmolalidad de 200 a 500 mOsmol/kg y preferiblemente de 220 a 350 mOsmol/kg.
13. La composición de la reivindicación 1, en la que la composición está sustancialmente libre de (a) propilenglicol, glicerol y polietilenglicol; y/o (b) un conservante.
14. La composición de la reivindicación 1, en la que la composición tiene un contenido del agente activo muy poco soluble en agua de entre 0,001% en peso y 1% en peso.
15. La composición de la reivindicación 1, en la que el agente activo muy poco soluble en agua se selecciona del grupo de corticosteroides, betasimpatomiméticos, anticolinérgicos, inmunomoduladores, antiinfecciosos, y citostáticos.
16. La composición de la reivindicación 1, en la que el agente activo muy poco soluble en agua tiene (a) un mal sabor, y/o (b) un potencial de irritación de la mucosa, y/o (c) un potencial inductor de la tos, y/o (d) un potencial para inducir broncoconstricción.
17. La composición de la reivindicación 1, en la que el agente activo muy poco soluble en agua es un corticosteroide y/o ciclosporina.
18. La composición de la reivindicación 17, en la que el corticosteroide se selecciona de budesonida, fluticasona, ciclesonida y compuestos que comprenden el resto activo de cualquiera de estos corticosteroides, tales como sales, derivados, y profármacos de los mismos.
19. La composición de la reivindicación 18, en la que el corticosteroide es budesonida.
20. La composición de la reivindicación 19, en la que el contenido de budesonida es 0,10 a 0,5 mg/ml.
21. La composición de la reivindicación 18, en la que el corticosteroide está presente en un estado coloidalmente disuelto o disperso.
22. La composición de la reivindicación 1, que comprende un agente activo adicional.
23. La composición de la reivindicación 22, en la que se selecciona al menos uno del agente activo del grupo que 5 consiste en fármacos antiinflamatorios, tales como corticosteroides, fármacos antiinflamatorios no esteroideos
(AINEs), antagonistas de leucotrienos, betasimpatomiméticos, anticolinérgicos, inhibidores de fosfodiesterasas, sustancias que abren el canal de potasio, antagonistas de cinina y taquicinina, inhibidores de la síntesis de IgE, antagonistas del receptor de endotelina, anestésicos, inmunomoduladores, antiinfecciosos, interferones, vasodilatadores, inhibidores de la enzima conversora de angiotensina (ACE), citostáticos, en particular: budesonida, 10 ciclesonida, fluticasona, mometasona, beclometasona, flunisolida; ibuprofeno, quetoprofeno, valdecoxib, celecoxib; zileutón, montelukast, pranlukast, roflumilast, cilomilast, zafirlukast; albuterol, formoterol, salmeterol, levalbuterol; terbutalina, pirbuterol; tiotropio, oxitropio, ipratropio; teofilina, pentoxifilina, cilomast, rolipram, amrinona, cilostazol, zardaverina, benzafentrina; cromacalim, levocromacalim, pinacidilo; nolpitantium, saredutant, nepadutant, osanetant; icatibant; cromoglicato, nedocromilo, glucanosulfatos, suplatast, batimastat, omalizumab; lidocaína, prolocaína, 15 mepivacaina, bupivacaina, articaina, ciclosporina, tacrolimus, sirolimus, everolimus, rapamicina, leflunomida, midostaurina, azatioprina; cloroquina, hidroxicloroquina; trimetoprim, tetraciclina, doxiciclina, ciprofloxacina, moxifloxacina, gatifloxacina, carbapenems, azitromicina, claritromicina, eritromicina, cetólidos, penems, aminoglicósidos, tobramicina, filgrastim, pentamidina, microcidina, clerocidina; metronidazol, quetoconazol, itraconazol, voriconazol, clotrimazol, bifonazol, fluconazol, anfotericina B, natamicina, nistatina, amicacina, aciclovir, 20 famciclovir, valaciclovir, didanosina, saquinavir, ritonavir, lamivudina, estavudina, zidovudina, ribavirina, captopril, lisinopril, perindopril, trandolapril, cilazapril, lovastatina, relaxina; suramina; sildenafilo, tadalafilo, vardenafilo, nitrendipina, amlodipina, prostaciclinas, beraprost, iloprost, bosentano, carmustina, lomustina, taxol, etopósido, cisplatino; glutationa reducida, anticuerpos anti-alfa-TNF, incluyendo los derivados farmacéuticamente aceptables de estas sustancias tales como, por ejemplo, las sales, conjugados, enantiómeros, racematos, epímeros, 25 diastereómeros o complejos de uno cualquiera de estos agentes activos.
24. La composición de la reivindicación 23, que comprende una combinación de dos agentes activos, seleccionada de las combinaciones de: (a) un corticosteroide y un inmunomodulador; (b) un corticosteroide y un beta-agonista; (c) un corticosteroide y un agente anticolinérgico; (d) un inmunomodulador y un beta-agonista; (e) un inmunomodulador y un agente anticolinérgico; y (f) un beta-agonista y un agente anticolinérgico.
30 25. La composición de la reivindicación 24, que comprende una combinación de dos agentes activos, seleccionada
de las combinaciones de: (a) budesonida y formoterol; (b) budesonida y tiotropio; (c) fluticasona y formoterol; (d) fluticasona y tiotropio; (e) ciclesonida y formoterol; (f) ciclesonida y tiotropio; (g) mometasona y formoterol; (h) mometasona y tiotropio.
26. Una composición en forma de un material sólido seco adaptado para preparar la composición líquida acuosa de 35 la reivindicación 1.
27. La composición de la reivindicación 26, que se puede obtener liofilizando la composición de la reivindicación 1.
28. Un medicamento que comprende la composición de la reivindicación 1.
29. El medicamento de la reivindicación 28, que se envasa en uno o más medios de envasado primarios de dosis individual, a partir de los cuales es dispensable, tal como mediante dosificación gota a gota, con una variabilidad de
40 dispensación menor que 20%, preferiblemente menor que 10%, en el que el medio de envasado se adapta para contener un volumen de llenado de 0,2 mi a 5 mi.
30. El medicamento de la reivindicación 29, en el que cada medio de envasado es un recipiente de plástico que comprende un elemento de cierre retirable, y en el que el recipiente se fabrica opcionalmente usando un diseño de procedimiento de soplado-llenado-cierre aséptico.
45 31. El medicamento de la reivindicación 30, en el que la composición es una forma líquida acuosa, y en el que la
eliminación del elemento de cierre produce una abertura en el recipiente de un diámetro que corresponde aproximadamente al diámetro interior o exterior de una conexión luer macho.
32. El medicamento de la reivindicación 30, en el que el recipiente de plástico se diseña para que, al eliminar los elementos de cierre retirables, se pueda conectar herméticamente a un elemento conector de un nebulizador.
50 33. El medicamento de la reivindicación 30, en el que la composición está en forma de un líquido acuoso, y en el que
el recipiente de plástico comprende una o más marcas de volumen o de dosificación y/o una o más impresiones.
34. El medicamento de la reivindicación 28, que se envasa en uno o más medios de dosificación primarios de múltiples dosis que se adapta para contener un volumen de llenado de 2 mi a 50 mi.
35. El medicamento de la reivindicación 34, en el que el recipiente de plástico comprende una o más marcas de volumen o de dosificación y/o una o más impresiones.
36. Uso de la composición de la reivindicación 1 para la fabricación de un medicamento para el diagnóstico, profilaxis o terapia de un síntoma, enfermedad o afección en un animal, preferiblemente un mamífero, comprendiendo dicho diagnóstico, profilaxis o terapia la administración tópica u oromucosal, y/o la inhalación oral o nasal.
37. Uso de la composición de la reivindicación 36, en el que el mamífero es un recién nacido, lactante, niño o joven humano, y en el que el diagnóstico, profilaxis o terapia comprende la inhalación oral o nasal.
38. El uso de la reivindicación 36, en el que el medicamento se adapta para la administración en un régimen de dosificación de una vez al día.
39. El uso de la reivindicación 36, en el que el medicamento está destinado a la profilaxis y/o tratamiento de una o más enfermedades, síntomas o afecciones que afectan a las vías respiratorias superiores o inferiores.
40. Uso de la reivindicación 39, en el que la una o más enfermedades, síntomas o afecciones afectan a la mucosa de la cavidad nasal y/u oral, tales como estomatitis, aftas, rinitis alérgica, rinitis vasomotora, rinitis estacional, rinitis perenne, rinitis crónica, o pólipos nasales.
41. El uso de la reivindicación 40, en el que el medicamento está adaptado para la nebulización por medio de un atomizador mecánico o un nebulizador para la pulverización en la nariz o la boca, o para inhalación.
42. El uso de la reivindicación 39, en el que la una o más enfermedades, síntomas o afecciones afectan a la mucosa de los senos frontales, maxilares y/o paranasales, tales como sinusitis crónica o alérgica, o pólipos.
43. El uso de la reivindicación 42, en el que el medicamento está adaptado para la nebulización por medio de un nebulizador de chorro o se Inhala a través de la nariz, en el que dicho nebulizador de chorro comprende una boquilla nasal para dirigir el aerosol a una o ambas fosas nasales de un paciente y genera una salida de aerosol con cambios de presión pulsátil, tal como el nebulizador PARI Sinus.
44. El uso de la reivindicación 39, en el que la una o más enfermedades, síntomas o afecciones se seleccionan del grupo que consiste en asma, asma pediátrica, bronquitis obstructiva, bronquitis obstructiva crónica, enfermedad pulmonar obstructiva crónica (COPÓ), enfisema, infecciones pulmonares, neumopatía vascular, neumopatía parenquimatosa, sarcoidosls, fibrosis pulmonar, fibrosis cística, bronconeumonía obliterante, hipertensión pulmonar y cáncer de pulmón.
45. El uso de la reivindicación 44, en el que el medicamento está adaptado para la nebulización con un nebulizador del tipo ultrasónico, de chorro o electrohidrodinámico, y/o con un nebulizador que funciona con una membrana vibrante o con poros de tamaño definido, tal como eFlow, eFlow Baby, AeroNeb, AeroDose o AERx.
46. El uso de la reivindicación 44, en el que el medicamento se adapta para la administración en dosis individuales que tienen un volumen de líquido de 0,2 a 5 mi, y en particular de 0,5 a 1,0 mi.
47. El uso de la reivindicación 44, en el que el medicamento está adaptado para suministro al ser humano a una velocidad de salida total de 0,2 a 0,8 mi, o de 200 a 800 mg por minuto.
48. El uso de la reivindicación 44, en el que el medicamento está adaptado para la administración en 5 minutos o menos, y en particular en 2 minutos o menos, por dosis individual.
49. Uso según la reivindicación 36 de una composición acuosa estéril que comprende un corticosteroide o inmunomodulador muy poco soluble en agua, un componente tensioactivo no iónico y un componente fosfolipídico según la reivindicación 1, para la fabricación de un medicamento para tratar un sujeto humano que sufre una enfermedad o afección seleccionada del grupo de asma, asma pediátrica, bronquitis obstructiva, y bronquitis obstructiva crónica, enfermedad pulmonar obstructiva crónica (COPD), enfisema, infecciones pulmonares, neumopatía vascular o parenquimatosa, sarcoidosis, fibrosis pulmonar y cística, bronconeumonía obliterante, hipertensión pulmonar, y cáncer de pulmón, en el que el tratamiento comprende la administración repetida del medicamento nebulizando dicha composición por medio de un nebulizador que tiene una membrana vibrante con poros de tamaño definido, y en el que el medicamento se suministra desde dicho nebulizador en forma de aerosol a una velocidad de salida total de 0,2 a 0,8 mi por minuto.
50. El uso de la reivindicación 49, en el que el aerosol tiene un diámetro de la mediana másico de 1 a alrededor de 5 pm, y más particularmente de alrededor de 2 a alrededor de 4 pm.
51. El uso de la reivindicación 49, en el que al menos alrededor de 60% del aerosol consiste en partículas de aerosol que tienen un diámetro de 2 a 5 pm.
52. El uso de la reivindicación 49, en el que el corticosteroide muy poco soluble en agua es budesonida.
53. El uso de la reivindicación 49, en el que el inmunomodulador muy poco soluble en agua es ciclosporina, y en el que la ciclosporina se administra opclonalmente en combinación con budesonida.
54. El uso de la reivindicación 49, en el que el componente tensioactivo no iónico comprende al menos un miembro del grupo que consiste en tlloxapol, pollsorbatos, vitamina E-TPGS, e hidroxiestearatos de macrogol.
55. El uso de la reivindicación 49, en el que el componente fosfolipídico comprende un fosfolípido bipolar o saturado, o una mezcla de tales fosfolípldos, y se selecciona preferiblemente del grupo que consiste en lecitina, lecitina purificada y/o enriquecida, fracciones de fosfatidilcolina extraídas de lecitina, dimiristoil fosfatidilcolina (DMPC), dipalmitoil fosfatidilcolina (DPPC) y diestearoil fosfatidilcolina (DSPC).
56. El uso de la reivindicación 49, en el que la administración se repite alrededor de una vez al día.
57. Uso según la reivindicación 36 de una composición acuosa estéril según la reivindicación 1, que comprende:
(a) budesonida
(b) un componente tensioactivo no iónico seleccionado del grupo que consiste en tiloxapol, polisorbatos, vitamina E TPGS, e hidroxiestearatos de macrogol, y
(c) lecitina,
para la fabricación de un medicamento para tratar un sujeto humano que sufre asma o asma pediátrica, en el que el tratamiento comprende la administración una vez al día o dos veces al día de la composición nebulizando la composición por medio de un nebulizador que tiene una membrana vibrante con poros de tamaño definido; en el que una dosis individual del medicamento tiene un volumen de 0,2 mi a 1 mi y un contenido de budesonida de 0,2 a 0,5 mg/ml; y en el que la composición se suministra desde dicho nebulizador en forma de aerosol a una velocidad de salida total de 0,2 a 0,8 mi por minuto.
58. El uso de la reivindicación 57, en el que el sujeto humano es un paciente pediátrico, y en el que se administra una dosis diaria total de budesonida de 50 pg a 400 pg.
59. Método para la fabricación de la composición de la reivindicación 1, que comprende las siguientes etapas:
(a) proporcionar los ingredientes;
(b) preparar una composición líquida acuosa a partir de los ingredientes proporcionados en la etapa (a);
(c) filtrar de forma estéril la composición obtenida en la etapa (b); y
(d) introducir la composición filtrada de forma estéril procedente de la etapa (c) en recipientes estériles en condiciones asépticas
60. El método de la reivindicación 59, en el que al menos uno de los ingredientes proporcionados en la etapa (a) es estéril.
61. El método de la reivindicación 59, en el que la etapa (b) comprende una subetapa de homogeneización a presión elevada, de ultrasonidos y/o de calentamiento hasta al menos 45°C.
62. El método de la reivindicación 59, en el que los recipientes estériles de la etapa (d) son viales de plástico fabricados mediante un procedimiento de soplado-llenado-cierre aséptico.
63. El método de la reivindicación 59, caracterizado además por la presencia de cualesquiera etapas o subetapas en las que el agente activo muy poco soluble en agua está presente en forma sólida y en las que su tamaño de partículas se reduce mecánicamente.
Patentes similares o relacionadas:
 Inhalador, del 29 de Julio de 2020, de Norton (Waterford) Limited: Un módulo electrónico para un inhalador , comprendiendo el módulo electrónico:
una tapa del módulo electrónico que comprende una guía […]
Inhalador, del 29 de Julio de 2020, de Norton (Waterford) Limited: Un módulo electrónico para un inhalador , comprendiendo el módulo electrónico:
una tapa del módulo electrónico que comprende una guía […]
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
 Inhalador de polvo seco de dosis única, del 29 de Julio de 2020, de Iconovo AB: Inhalador de polvo seco que comprende:
un alojamiento con una parte de alojamiento inferior para formar por […]
Inhalador de polvo seco de dosis única, del 29 de Julio de 2020, de Iconovo AB: Inhalador de polvo seco que comprende:
un alojamiento con una parte de alojamiento inferior para formar por […]
 Inhalador, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Inhalador para la inhalación de una formulación desde un soporte preferentemente en forma de banda, en forma de tira, a modo de blíster […]
Inhalador, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Inhalador para la inhalación de una formulación desde un soporte preferentemente en forma de banda, en forma de tira, a modo de blíster […]
Inhalador de polvo seco, del 29 de Julio de 2020, de Iconovo AB: Inhalador de polvo seco con un extremo distal y un extremo proximal, comprendiendo el inhalador de polvo seco: por lo menos una entrada […]
Inhalador de polvo seco que comprende un mecanismo de bloqueo, del 22 de Julio de 2020, de Iconovo AB: Inhalador de medicamento en polvo seco para medir una inhalación de un medicamento en polvo seco, que comprende: por lo menos una entrada […]
Pulverizador de aerosol aséptico, del 22 de Julio de 2020, de JOHNSON & JOHNSON CONSUMER INC: Un dispositivo de pulverización portátil (también llamado 'pulverizador', 'nebulizador' o 'atomizador') que comprende un armazón que incluye una […]
Dispositivo dispensador de doble cámara, del 1 de Julio de 2020, de Cambium Medical Technologies LLC: Un dispositivo dispensador de un solo uso que comprende: una cámara seca que comprende material liofilizado; una cámara húmeda […]