FACTOR VIIA O EQUIVALENTES DE FACTOR VIIA PARA PREVENIR O ATENUAR EL CRECIMIENTO HEMORRAGICO, Y/O LA GENERACION DE EDEMA DESPUES DE UNA HEMORRAGIA INTRACEREBRAL (ICH).
Uso de un primer agente de coagulación comprendiendo factor VIIa o un equivalente de factor VIIa para la producción de un medicamento para prevenir o atenuar una o más complicaciones de hemorragia intracerebral (ICH) en un paciente,
donde dicho paciente no ha sido diagnosticado de un trastorno de sangrado congénito y no ha sido tratado previamente con terapias de anticoagulación
Tipo: Resumen de patente/invención. Número de Solicitud: W05052890EP.
Solicitante: NOVO NORDISK HEALTH CARE AG.
Nacionalidad solicitante: Suiza.
Dirección: ANDREASSTRASSE 15,8050 ZURICH.
Inventor/es: BRUN,NIKOLAI CONSTANTIN, ERHARDTSEN,ELISABETH, SKOLNICK,BRETT E.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K38/48K21
Clasificación PCT:
- A61K38/48 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que actúan sobre enlaces peptídicos (3.4).
- A61P7/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Antihemorrágicos; Procoagulantes; Hemostáticos; Antifibrinolíticos.
Clasificación antigua:
- A61K38/48 A61K 38/00 […] › que actúan sobre enlaces peptídicos (3.4).
Fragmento de la descripción:
Factor VIIa o equivalentes de Factor VIIa para prevenir o atenuar el crecimiento hemorrágico, y/o la generación de edema después de una hemorragia intracerebral (ICH).
Campo de la invención
La invención se refiere a la producción de un medicamento para prevenir o minimizar la gravedad de complicaciones en pacientes de ICH.
Antecedentes de la invención
Hemostasis es un proceso fisiológico complejo que en última instancia resulta en el cese del sangrado. Esto depende de la función apropiada de tres componentes principales: vasos sanguíneos (especialmente el revestimiento endotelial), factores de coagulación, y plaquetas. Una vez formado un tapón hemostático, la activación oportuna del sistema fibrinolítico es igualmente importante para prevenir la activación hemostática innecesaria adicional. Cualquier malfuncionamiento de este sistema (debido a un número reducido, o disfunción molecular, de los componentes hemostáticos o activación aumentada de los componentes fibrinolíticos) pueden llevar al sangrado clínico tal como, p. ej., diátesis hemorrágica de gravedad variable.
En la mayoría de las situaciones fisiológicas, la hemostasis es desencadenada por la interacción del factor de coagulación VII activado (FVIIa) circulante con el factor tisular (TF) después de la exposición de TF en el lugar de una herida. FVIIa endógeno se vuelve proteolíticamente activo sólo después de formar un complejo con TF. Normalmente, TF es expresado en las capas profundas de la pared del vaso y es expuesto después de la herida. Esto asegura una activación altamente localizada de coagulación e impide la coagulación diseminada. TF también parece existir en una forma no activa denominada TF encriptado. La regulación de encriptado contra TF activo sigue siendo desconocida.
La hemorragia intracerebral (ICH) es una condición neurológica que ocurre espontánea y resulta en sangre acumulándose en el tejido cerebral intraparenquimal. Los resultados de una ICH han sido demostrados para suponer morbilidad y mortalidad significantes. En los últimos años se ha mostrado que ICH aumenta en volumen en las horas siguientes al traumatismo inicial. Esto ocurre en aproximadamente el 38% de los pacientes que sufren de ICH. La razón para el aumento no está clara, pero está considerada que es bien a través de una filtración continua del hematoma original o a través de un proceso complejo de resangrados.
Días después del traumatismo inicial una zona de edema puede ser identificada en escáneres TC ... rodeando la sangre en el hematoma. El mecanismo para la generación del edema está también mal entendido pero puede ser debido a una combinación de una reacción inflamatoria en el tejido que rodea el coágulo al igual que un efecto de masa directo del coágulo que ejerce presión en el tejido cerebral circundante. El impacto del edema aislado puede ser significante pero no evaluado en el contexto de una hemorragia significante pero puede tener efectos en el volumen del tejido cerebral comprometido después de una ICH que ha sido estimada para ser hasta 3 veces el volumen real del hematoma. La importancia del volumen de tejido global efectuado representará uno de los predictores más fuertes de resultados después de ICH. Por tanto hay un interés clínico en reducir cualquier expansión de hemorragia y en reducir y/o minimizar el volumen de lesión total (sangre y edema resultante).
Así, hay una necesidad en la técnica para composiciones mejoradas para el tratamiento agudo de ICH, al igual que para la prevención y atenuación de complicaciones posteriores que se originan de ICH y de modalidades convencionales que se utilizan para tratar pacientes con ICH.
Resumen de la invención
La invención proporciona el uso de un primer agente de coagulación comprendiendo factor VIIa, o un factor VIIa equivalente, para la producción de un medicamento para la prevención o atenuación de una o más complicaciones de hemorragia intracerebral (ICH) en un paciente, donde dicho paciente no ha sido diagnosticado con un trastorno de sangrado congénito y no ha sido tratado previamente con terapias de anticoagulación.
En un aspecto, dicho paciente ha experimentado ICH espontánea o traumática.
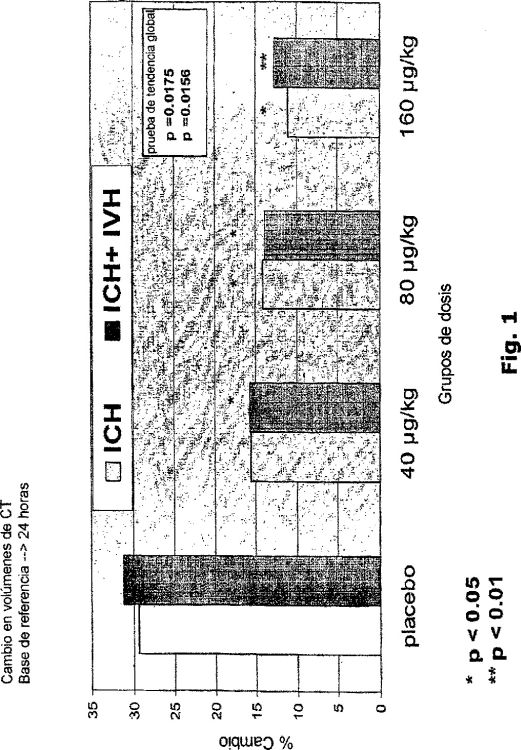
En un segundo aspecto, la cantidad administrada de factor VIIa o factor VIIa equivalente comprende al menos aproximadamente 40 µg/kg, tal como al menos aproximadamente 80 µg/kg, tal como al menos aproximadamente 120 µg/kg.
En un tercer aspecto, el factor VIIa o factor VIIa equivalente es administrado dentro de aproximadamente 24 horas de la incidencia del ICH.
En un cuarto aspecto, el factor VIIa o factor VIIa equivalente es administrado dentro de aproximadamente 4 horas de la incidencia del ICH.
En un quinto aspecto, el medicamento además comprende un segundo agente de coagulación; donde las cantidades de dicho primero y segundo agentes de coagulación juntos son eficaces en dicha prevención o atenuación de ICH. Este segundo agente de coagulación puede ser un factor de coagulación, seleccionado, por ejemplo, de cualquiera del grupo que consiste en factor VIII, factor IX, factor V, factor XI, factor XIII, un factor VII o factor VIIa. El segundo agente de coagulación puede también ser un agente antifibrinolítico, seleccionado del grupo que consiste en PAI-1, aprotinina, ácido e-aminocaproico, ácido tranexámico y combinaciones de cualquiera de los precedentes.
En otro aspecto, dicho efecto de prevención o atenuación resulta en la reducción en uno o varios días que un paciente de ICH es hospitalizado después de ICH y una reducción en el riesgo de muerte en un paciente de ICH.
En otro aspecto, la invención proporciona, el uso de factor VIIa o un factor VIIa equivalente para la producción de un medicamento para reducir el número de días de hospitalización de un paciente de ICH, incluso días en la unidad de cuidados intensivos (UCI), confinamiento en cama, y/o calidad de vida según está medido por la calidad europea de calidad de vida (EuroQOL), o instrumentos similares, en el periodo desde el inicio del tratamiento (SOT) hasta el día 90, preferiblemente día 15 después del inicio del tratamiento o para reducir el riesgo de muerte en un paciente de ICH . En una forma de realización, (i) una cantidad de 40, 80 o 160 µg/kg de factor VIIa o factor VIIa equivalente es administrada al paciente al principio del tratamiento como un bolo lento único.
Descripción detallada de la invención
La presente invención proporciona composiciones que pueden ser usadas ventajosamente para prevenir o atenuar el crecimiento de la hemorragia, y/o generación de edema después de ICH, que el paciente puede experimentar después de su herida y/o como resultado de intervenciones médicas que pueden ser usadas para tratar sus heridas. Los métodos son realizados administrando, a un paciente de ICH, un factor VIIa o un factor VIIa, equivalente en cierto modo que es eficaz para prevenir o atenuar el crecimiento de hemorragia, formación de edema al igual que una o más complicaciones relacionadas con ICH. Una manera eficaz para prevenir o atenuar el crecimiento de hemorragia, formación de edema y las complicaciones posteriores pueden comprender administrar una cantidad predeterminada de factor VIIa o un factor VIIa equivalente, y/o utilizar un régimen de dosificación particular, formulación, modo de administración, combinación con otros tratamientos, y similares. La eficacia de los métodos de la invención en la reducción del crecimiento de hemorragia, formación de edemas o en prevenir complicaciones de ICH pueden ser evaluadas usando uno o más métodos de imaginería convencionales (p. ej., escáner TC, MRI) o usando parámetros que evalúan complicaciones (véase abajo). Complicaciones que pueden ser evitadas por el uso según la presente invención, o cuya gravedad puede ser atenuada, incluyen, sin limitación, crecimiento de hemorragia, generación de edema, y calidad de vida reducida inclusive muerte provocada por uno o más de estos síndromes.
Selección de pacientes
Pacientes que pueden beneficiarse del uso según la presente invención incluyen, sin limitación, pacientes que han sufrido de ICH espontánea o traumática. ICH espontánea incluye pacientes que sufren un sangrado intracerebral normalmente asociado a la incidencia de edad avanzada, hipertensión, o deposición de amiloide en la vasculatura cerebral. ICH normalmente resultada de la rotura de un único vaso que provoca daño extensivo al tejido cerebral circundante contiguo al vaso dañado. ICH traumático puede estar asociado a accidentes que...
Reivindicaciones:
1. Uso de un primer agente de coagulación comprendiendo factor VIIa o un equivalente de factor VIIa para la producción de un medicamento para prevenir o atenuar una o más complicaciones de hemorragia intracerebral (ICH) en un paciente, donde dicho paciente no ha sido diagnosticado de un trastorno de sangrado congénito y no ha sido tratado previamente con terapias de anticoagulación.
2. Uso tal y como se define en reivindicación 1, donde dicho paciente ha experimentado ICH espontánea o traumática.
3. Uso tal y como se define en cualquiera de las reivindicaciones 1-2, donde la cantidad administrada de factor VIIa o equivalente de factor VIIa comprende al menos aproximadamente 40 µg/kg.
4. Uso tal y como se define en la reivindicación 3, donde la cantidad administrada de factor VIIa o equivalente de factor VIIa comprende al menos aproximadamente 80 µg/kg.
5. Uso tal y como se define en la reivindicación 4, donde la cantidad administrada de factor VIIa o equivalente de factor VIIa comprende al menos aproximadamente 120 µg/kg.
6. Uso tal y como se define en cualquiera de las reivindicaciones 1-5, donde la administración de factor VIIa o equivalente de factor VIIa se realiza dentro de aproximadamente 24 horas a partir de la incidencia de la ICH.
7. Uso tal y como se define en reivindicación 6, donde dicha administración se realiza dentro de aproximadamente 4 horas a partir de la incidencia de la ICH.
8. Uso tal y como se define en cualquiera de las reivindicaciones 1-7, donde el medicamento además comprende un segundo agente de coagulación, y donde las cantidades de dicho primero y segundo agentes de coagulación juntos son eficaces en dicha prevención o atenuación.
9. Uso tal y como se define en la reivindicación 8, donde el segundo agente de coagulación es un factor de coagulación.
10. Uso tal y como se define en la reivindicación 9, donde dicho segundo agente de coagulación es seleccionado del grupo que consiste en: factor VIII, factor IX, factor V, factor XI, factor XIII, un factor VII o factor VIIa diferente del primer agente de coagulación, y combinaciones de cualquiera de los anteriores.
11. Uso tal y como se define en la reivindicación 8, donde dicho segundo agente de coagulación es un agente antifibrinolítico.
12. Uso tal y como se define en reivindicación 11, donde dicho agente antifibrinolítico es seleccionado del grupo que consiste en PAI-1, aprotinina, ácido aminocaproico, ácido tranexámico, y combinaciones de cualquiera de los anteriores.
13. Uso tal y como se define en cualquiera de las reivindicaciones 1-12, donde dicha prevención o atenuación resulta en uno o más de: una reducción en el número de días que un paciente de ICH es hospitalizado después de la ICH y una reducción en el riesgo de muerte en un paciente con ICH.
Patentes similares o relacionadas:
COMPOSICIONES PARA USO EN TERAPIA GÉNICA PARA EL TRATAMIENTO DE HEMOFILIA, del 29 de Marzo de 2011, de THE CHILDREN'S HOSPITAL OF PHILADELPHIA: Una composición que comprende una partícula vírica, comprendiendo dicha partícula vírica un vector de virus adenoasociado recombinante que comprende al menos dos repeticiones […]
VARIANTES DE DOMINIO DE GLA DEL FACTOR VII O VIIA, del 7 de Mayo de 2010, de BAYER HEALTHCARE LLC: Una variante de polipéptido de factor VII (FVII) o factor VIIa (FVIIa) que presenta una secuencia de aminoácidos que difiere en 1 a 15 residuos de aminoácidos respecto […]
COMPOSICION FARMACEUTICA LIQUIDA, ACUOSA DE POLIPEPTIDOS FACTOR VII, del 7 de Abril de 2010, de NOVO NORDISK HEALTH CARE AG: Una composición farmacéutica acuosa líquida comprendiendo un polipéptido factor VII (i); un agente amortiguador (ii) adecuado para mantener el pH en el rango de […]
COMPOSICIONES PARA EL TRATAMIENTO DE LA HEMORRAGIA CON UN FACTOR ACTIVO VIIA Y FIBRINOGENO, del 5 de Enero de 2010, de U.S. ARMY MEDICAL RESEARCH AND MATERIEL COMMAND: Una composición farmacéutica que comprende factor VIIa funcional y fibrinógeno en un vehículo farmacéuticamente aceptable, estando la composición libre de […]
Preparaciones de hidrogel térmico reversible para su uso en el tratamiento de trastornos del urotelio, del 15 de Julio de 2020, de UroGen Pharma Ltd: Una composición de hidrogel termorreversible mucoadhesiva biocompatible que incorpora toxina botulínica y que comprende al menos un agente de gelificación […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Formulaciones de productos biológicos para instilación intravesical, del 1 de Julio de 2020, de ALLERGAN, INC.: Composición farmacéutica que comprende una cantidad terapéuticamente eficaz de un derivado de Clostridium y al menos un agente de permeabilización, en la que […]
Compuestos para el tratamiento de Trastornos Neuropsiquiátricos, del 24 de Junio de 2020, de Curemark LLC: Una composición que comprende enzimas digestivas para uso en el tratamiento del Trastorno Esquizofreniforme, en donde las enzimas digestivas comprenden amilasa, lipasa […]