FACTOR IXA PARA EL TRATAMIENTO DE TRASTORNOS HEMORRÁGICOS.
Utilización de Factor IXa en la fabricación de una primera preparación farmacéutica para tratar a un sujeto con una patología hemorrágica,
caracterizada porque la primera preparación farmacéutica contiene al menos un 10% de Factor IXa (mg/mg de proteína total) y no contiene Factor VIII y no se debe administrar de forma simultánea, simultánea por separado o secuencialmente en el mismo régimen de tratamiento con una segunda preparación que comprende Factor VIII
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/006527.
Solicitante: BAXTER INTERNATIONAL INC.
BAXTER HEALTHCARE S.A..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE BAXTER PARKWAY DEERFIELD, IL 60015 ESTADOS UNIDOS DE AMERICA.
Inventor/es: DONOVAN,Shane, BAKER,Donald,A.
Fecha de Publicación: .
Fecha Solicitud PCT: 28 de Febrero de 2005.
Clasificación Internacional de Patentes:
- A61K38/36 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de coagulación sanguínea o de fibrinolisis.
Clasificación PCT:
- A61K38/36 A61K 38/00 […] › Factores de coagulación sanguínea o de fibrinolisis.
- A61P7/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Antihemorrágicos; Procoagulantes; Hemostáticos; Antifibrinolíticos.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania.
PDF original: ES-2357132_T3.pdf


Fragmento de la descripción:
Esta solicitud reivindica la prioridad de la solicitud provisional de Estados Unidos 60/554.726, presentada a 19 de marzo de 2004.
Campo de la Invención 5
La presente invención se refiere al tratamiento de patologías de la coagulación sanguínea con preparaciones farmacéuticas que contienen Factor IXa.
Antecedentes de la Invención
La coagulación de la sangre es un proceso biológico dinámico y complejo que depende de una serie de reacciones bioquímicas interdependientes. En cada etapa de la serie se genera una proteasa activa a partir de un precursor 10 inactivo. Cada proteasa nuevamente generada, a su vez, actúa en su sustrato, otra proteasa precursora, para generar una reacción en cascada. Esta cascada produce esencialmente la suficiente trombina activa para generar un coágulo estable.
La parte terminal de esta cascada tiene lugar en la membrana fosfolipídica de las plaquetas. En su superficie, el Factor IXa (activado por el Factor XIa o VIIa, ilustrado en la Figura 1), y en presencia de su co-factor, el Factor VIII, activa el 15 Factor X en Factor Xa. El Factor Xa activa la protrombina en trombina, que activa luego el fibrinógeno para formar el coágulo de fibrina; el papel específico del Factor VIII consiste en potenciar la catálisis del Factor X por el Factor IXa, ya que el Factor IXa solo sólo puede activar lentamente el Factor X in vitro (Van Dieijen y col., J. Biol. Chem. 10 de abril de 1981:256(7):3433-42).
La patología de la coagulación sanguínea más común, la Hemofilia A, es una deficiencia hereditaria ligada a X que 20 conduce a niveles reducidos de Factor VIII circulante en la sangre de los individuos afectados. Se utilizan preparaciones concentradas de Factor VIII para tratar a estos individuos con el fin de restablecer sus niveles de FVIII circulante a niveles funcionales. Sin embargo, en aproximadamente un 20% de estos pacientes se producen allo-anticuerpos inhibidores contra FVIII, anulando la eficacia de este tratamiento.
El tratamiento de pacientes que se han vuelto refractarios a la terapia de reemplazo de FVIII incluye la inducción de 25 tolerancia inmune (ITI), la terapia de reemplazo por FVIII Porcino y una variedad de preparaciones de las que se supone emulan los requisitos para el tratamiento con FVIII en la coagulación. Estas preparaciones alternativas incluyen FVIIa recombinante, Concentrados de Complejo de Protrombina y Concentrados de Complejo de Protrombina activado (aPCCs).
Se ha especulado sobre la posibilidad de que las sustancias terapéuticamente eficaces sobre los aPCCs sean diversas 30 combinaciones de los factores siguientes: Trombina, Factor VIIa, Factor IXa, Factor Xa, Factor XIa, Factor XIIa, complejo Protrombina/Factor Xa. Sin embargo, el mecanismo preciso de acción in vivo para los aPCCs sigue siendo controvertido.
La EP 1 635 861 de NIBSC representa la técnica anterior bajo A54(3) y describe la utilización en medicina de una preparación que comprende Factor IXa. Esta preparación contiene Factor VIII o se emplea para la administración de 35 forma simultánea, simultánea por separado o secuencialmente, en el mismo régimen de tratamiento, con una segunda preparación que comprende Factor VIII, objeto que es rechazado por el presente paciente.
Sumario de la Invención
La presente invención proporciona un método para tratar trastornos hemorrágicos en un sujeto mediante la administración de una preparación enriquecida con Factor IXa. El Factor IXa para su utilización en la presente invención 40 se puede producir por medio de la activación proteolítica de Factor IX obtenido de forma recombinante. El ADNc que codifica para el Factor IX se aísla, se caracteriza y se clona en vectores de expresión. Véase, por ejemplo, Choo y col., Nature 299:178-180 (1982); Fair y col., Blood 64:194-204 (1984) y Kurachi y col., Proc. Nat. Acad. Sci. USA 79:6461-6464 (1982). Se ha obtenido un Factor IX recombinante mediante técnicas recombinantes, tal como se describe en la Patente US 4.770.999, de Kaufmann y col., Sep. 13, 1988, la cual se incorpora aquí como referencia. La invención 45 proporciona asimismo un método para preparar y aislar Factor IXa de una fracción plasmática tal como pasta de la Fracción IV-1 de Cohn. Se lleva a cabo por catálisis lenta la conversión del Factor IX en Factor IXa, introduciéndose una etapa de intercambio iónico como modificación de los procedimientos existentes, (descritos en las Patentes US 3.560.475 y 4.286.056) para purificar selectivamente el Factor IXa de las impurezas presentes. Esta preparación enriquecida con Factor IXa es capaz de corregir el fenotipo hemorrágico del Factor VIII del ratón deficiente en Factor VIII 50 (ratón-fviii-I). Por tanto, posee utilidad clínica en el tratamiento de trastornos hemorrágicos asociados a la Hemofilia. Además, otra utilidad adicional de la invención consiste en que elimina la actividad de la precalicreína (PKA) del material de partida de Autoplex-T.
Breve Descripción de las Figuras
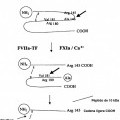
Figura 1:muestra la activación del Factor IX por el Factor XIa y calcio o el factor tisular-Factor VIIa, que resulta en la segmentación de un enlace de Arginina (Arg) Alanina (Ala) y la formación del Factor IXα, intermedio inactivo del Factor IXa. La segmentación de un segundo enlace, Arg 180-Valina 181 (Val) resulta en la formación del Factor IXαβ, la forma activa del Factor IX (denominado Factor IXa) y la liberación de un fragmento peptídico de aproximadamente 10 kDa (la 5 figura se modifica a partir de Royal A McGraw y col., Clinics in Haematology-Vol. 14, 2 de junio de 1985). Los experimentos de inmunoblot utilizados en las figuras posteriores emplean una electroforesis en gel de poliacrilamida y sulfato de dodecil-sodio (SDS-PAGE) para reducir las proteínas en preparaciones específicas. Debido a que estos geles se obtuvieron en condiciones de reducción, el enlace disulfuro que une el heterodímero se rompe y las cadenas pesadas y ligeras del Factor IX se reducen como especies discretas. Por ejemplo, en el caso del Factor IXαβ, las 10 cadenas pesadas y ligeras se reducirán a aproximadamente 30 y 20 kDa respectivamente. En esta estrategia, la concentración de las enzimas catalíticas sería significativamente más baja que el Factor IX, facilitando su eliminación posterior mediante una cromatografía adicional, tal como una columna de afinidad monoclonal para el Factor IX.
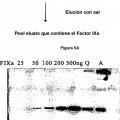
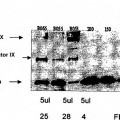
Figura 2a:es un inmunoblot que mide la cantidad de Factor IX activado en preparaciones específicas de Autoplex-T mediante un anticuerpo monoclonal específico de la cadena pesada del Factor IX. Se cargaron en el gel las cantidades 15 indicadas de Factor IXa purificado activado. Se cargaron en cada calle cinco μl de cada preparación de Autoplex-T. Por tanto, la concentración aproximada de Factor IX activado en 2839B065 y 2839B055 se encuentra entre 20 y 50 ng/μl. Las Unidades de Corrección del Factor Ocho (FECUs) para cada preparación de Autoplex-T (Números de lotes 2839B065, 2839B055, 2839B053) vienen indicadas debajo de la calle apropiada. Estos resultados indican también que la cantidad de Factor IX activado está en correlación positiva con la potencia FECU. 20
Figura 3:es un inmunoblot con un anticuerpo monoclonal específico de la cadena pesada del Factor IX que utiliza un panel de lotes de fabricación de Autoplex-T producidos en 2002 y 2003 que se situaban por encima de la potencia mínima aceptable (> a 6 unidades FECU por ml). Las Unidades de Corrección del Factor Ocho (FECUs) para cada preparación de Autoplex-T vienen indicadas debajo de cada calle apropiada. En todos los casos, el Factor IX ha sido activado en Factor IXa. 25
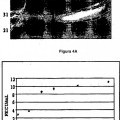
Figuras 4A y B:muestran la dosis-respuesta del Factor IX purificado activado en una prueba de coagulación FECU. En este experimento se utilizan cantidades crecientes de Factor XIa (0, 10, 20, 30, 50 y 75 ng por ml) para regular la cantidad de Factor IXa activado, que se utilizó posteriormente en una prueba de coagulación FECU. La Figura 4A es un gel de SDS-PAGE teñido con azul de Coomassie que muestra que, a concentraciones crecientes de Factor XIa, se produce más Factor IX activado. Para comparar, se redujeron en el mismo gel estándares purificados de Factor IXa y 30 Factor IX. En la Figura 4B, cada parte alícuota del producto de digestión se analizó entonces mediante un ensayo de tiempo de tromboplastina parcial activada procedente de plasma deficiente en FVIII. Las cantidades de Factor XIa (0-75 ng/ml) añadidas no tienen una actividad FECU significativa en este experimento. Estos resultados muestran que el Factor IX activado... [Seguir leyendo]
Reivindicaciones:
1.Utilización de Factor IXa en la fabricación de una primera preparación farmacéutica para tratar a un sujeto con una patología hemorrágica, caracterizada porque la primera preparación farmacéutica contiene al menos un 10% de Factor IXa (mg/mg de proteína total) y no contiene Factor VIII y no se debe administrar de forma simultánea, simultánea por separado o secuencialmente en el mismo régimen de tratamiento con una segunda preparación que comprende Factor VIII. 5
2.Primera preparación farmacéutica que contiene al menos un 10% de Factor IXa (mg/mg de proteína total) para su utilización en el tratamiento de un sujeto con patología hemorrágica, caracterizada porque la primera preparación farmacéutica no contiene Factor VIII y no se debe administrar de forma simultánea, simultánea por separado o secuencialmente en el mismo régimen de tratamiento con una segunda preparación que comprende Factor VIII.
3.Utilización según la reivindicación 1 de la primera preparación farmacéutica para su empleo según la reivindicación 2, 10 caracterizada porque dicha primera preparación farmacéutica está exenta esencialmente de actividad de activador de la precalicreína.
4.Utilización según la reivindicación 1 de la primera preparación farmacéutica para su empleo según la reivindicación 2, caracterizada porque el Factor IXa se produce mediante activación proteolítica del Factor IX producido de forma recombinante. 15
5.Utilización según la reivindicación 1, 3 ó 4 de la primera preparación farmacéutica para su empleo según la reivindicación 2, 3 ó 4, caracterizada porque dicha patología hemorrágica es causada por la presencia de inhibidores del FVIII en la sangre del sujeto.
6.Utilización según la reivindicación 1, 3 ó 4 de la primera preparación farmacéutica para su empleo según la reivindicación 2, 3 ó 4, caracterizada porque dicha patología hemorrágica es causada por la ausencia de actividad 20 endógena del FVIII en la sangre del sujeto.
7.Utilización según la reivindicación 1, 3 ó 4 de la primera preparación farmacéutica para su empleo según la reivindicación 2, 3 ó 4, caracterizada porque dicha patología hemorrágica es causada por la ausencia de actividad endógena del FIX en la sangre del sujeto.
8.Método para elaborar una preparación farmacéutica que contiene Factor IXa y que está exenta esencialmente de 25 actividad de precalicreína, comprendiendo dicho método:
a) disolución de una pasta de la fracción IV-1 de Cohn;
b) adsorción de los factores de coagulación contenidos en dicha fracción IV-1 de Cohn sobre fosfato de calcio;
c) elución de dichos factores de coagulación de dicho fosfato de calcio para formar un primer eluato;
d) aplicación de dicho primer eluato a una resina de intercambio iónico, adsorbiendo así el Factor IXa en dicha 30 resina y permitiendo que las impurezas que tienen actividad de precalicreína entren en una fracción de desecho; y
e) elución y recogida de dicho Factor IXa de dicha resina.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Trombina estabilizada, del 27 de Mayo de 2020, de OMRIX BIOPHARMACEUTICALS LTD.: Un método para estabilizar la actividad de la trombina en una solución, el método comprende: inhibir la actividad de la trombina poniendo en contacto la trombina con un oligonucleótido […]
Medicamento para tratamiento terapéutico y/o mejoría de la sepsis, del 8 de Abril de 2020, de ASAHI KASEI PHARMA CORPORATION: Un medicamento que comprende trombomodulina como un ingrediente activo para uso en el tratamiento terapéutico y/o mejoría de la sepsis, donde se ha de administrar […]
Uso terapéutico sinérgico de concentrados de complejo de protrombina con concentrados de FVIII, del 18 de Marzo de 2020, de CSL BEHRING GMBH: Composición que comprende factores de coagulación FII, FIX, FX y FVII aislados y una composición que comprende FVIII aislado y, opcionalmente, VWF aislado para […]
Métodos y composiciones para la condrogénesis in vitro e in vivo, del 18 de Diciembre de 2019, de Lineage Cell Therapeutics, Inc: Una composición que comprende una línea celular progenitora embrionaria clonal para su uso en un método in vivo de generación de cartílago, comprendiendo la composición: […]
Complejo del factor VIII con XTEN y proteína del factor de Von Willebrand y sus usos, del 27 de Noviembre de 2019, de Bioverativ Therapeutics Inc: Una proteína quimérica que comprende (i) un fragmento del factor de von Willebrand Factor (VWF) que comprende el dominio D' y el dominio D3 de VWF, (ii) […]
Direccionamiento de factores de coagulación al TLT-1 en plaquetas activadas, del 23 de Octubre de 2019, de NOVO NORDISK HEALTH CARE AG: Una proteína procoagulante que comprende (i) al menos un factor de coagulación, que es un polipéptido de FVII o un polipéptido de FIX, unido covalentemente […]