EXPRESIÓN RECOMBINANTE DE VARIANTES DE PROTEÍNA DE CUBIERTA DE RUBEOLA E1 COMO PROTEÍNAS DE FUSIÓN CHAPERONAS, Y UTILIZACIÓN DE LAS MISMAS EN LA DETECCIÓN DE ANTICUERPOS ANTI-RUBEOLA.
Antígeno E1 soluble de rubeola y variantes de este péptido, caracterizado porque:
(i) no presenta en el extremo C-terminal por lo menos la región transmembranal y el segmento de anclaje, así como por lo menos los aminoácidos 143 a 168, e (ii) contiene por lo menos la región que comprende los puentes disulfuro Cys349-Cys35 y Cys368-Cys401, y que comprende por lo menos los aminoácidos 315 a 412 de la secuencia de E1 de rubeola, en el que el antígeno E1 de rubeola se fusiona con una chaperona FKBP
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06022216.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Alemania.
Dirección: GRENZACHERSTRASSE 124 4070 BASEL SUIZA.
Inventor/es: FAATZ, ELKE, ENGEL, ALFRED, SCHOLZ, CHRISTIAN, UPMEIER, BARBARA, SCHAARSCHMIDT,PETER, Bollhagen,Ralf, Zarnt,Toralf.
Fecha de Publicación: .
Fecha Solicitud PCT: 24 de Octubre de 2006.
Clasificación Internacional de Patentes:
- C07K14/19 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Virus de la rubeola.
Clasificación PCT:
- C07K14/19 C07K 14/00 […] › Virus de la rubeola.
- C12N15/40 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Proteínas de virus ARN, p. ej. Flavivirus.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- G01N33/569 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para microorganismos, p. ej. protozoarios, bacterias, virus.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356383_T3.pdf
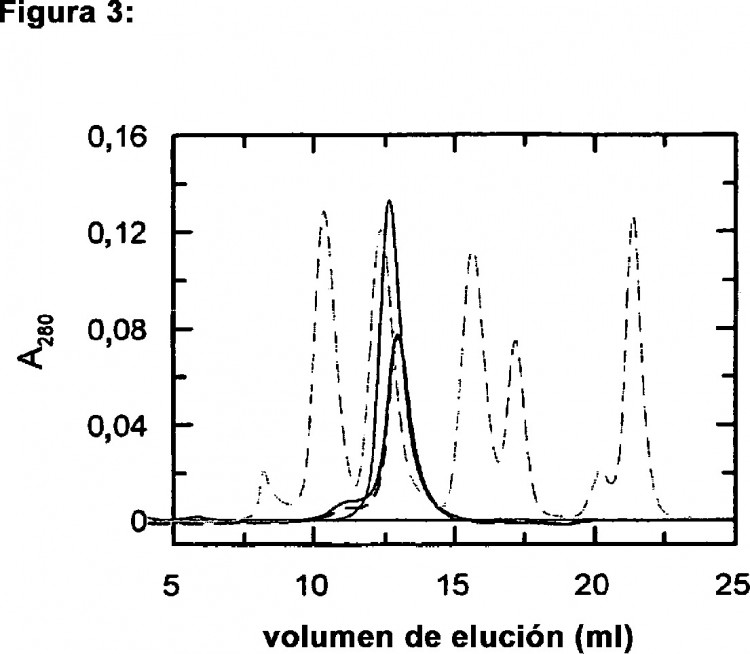
Fragmento de la descripción:
Expresión recombinante de variantes de proteína de cubierta de rubeola E1 como proteínas de fusión chaperonas, y utilización de las mismas en la detección de anticuerpos anti-rubeola.
Campo de la invención
La invención se refiere a un antígeno soluble de la rubeola E1 y a variantes de este péptido caracterizados porque no presentan en el extremo C-terminal por lo menos la región transmembranal y el segmento de anclaje, así como por lo menos los aminoácidos 143 a 168 y que contiene por lo menos la región comprendida entre los puentes disulfuro Cys 349-Cys 352 y Cys 368-401 y que comprende por lo menos los aminoácidos 315 a 412 de la secuencia de rubeola E1, mientras que el antígeno de rubeola E1 se encuentra fusionado con una chaperona FKBP.
Antecedentes de la invención
El virus de la rubeola (RV) es un togavirus y el único representante del subgrupo Rubivirus. El virus, pequeño y con cubierta, presenta un tamaño de 65 nm y consiste de una única molécula de ARN de una cadena de 10 kb encapsulado en una nucleocápside icosahédrica que se encuentra circundada por una cubierta lipídica. El virus de la rubeola provoca una enfermedad infantil relativamente leve (sarampión alemán) que habitualmente resulta en inmunidad permanente que se cree que se encuentra mediada por tanto linfocitos T como anticuerpos. Las posibles consecuencias de las infecciones por rubeola en adultos son artritis transitoria/crónica, síndromes musculoesqueléticos, diabetes mellitus insulino-dependiente y aparición retardada de secuelas neurológicas.
El virus de la rubeola es un parámetro importante durante las primeras etapas del embarazo. La detección específica de IgM anti-rubeola y/o de IgG anti-rubeola, respectivamente, resulta crucial para la clarificación de si se ha producido una infección aguda o una reinfección activa.
La infección materna por virus de la rubeola durante el embarazo se asocia a riesgo de síndrome de rubeola congénita (CRS) en el feto, siendo más alta la incidencia de malformaciones congénitas cuando la infección primaria se produce en las primeras 12 semanas de la gestación. Por este motivo, la prevención de anormalidades congénitas causadas por la infección por RV durante el embarazo temprano requiere la determinación del estado inmunológico del individuo mediante serología, es decir una determinación selectiva de los anticuerpos IgG e IgM específicos para los antígenos del virus de la rubeola. La infección primaria por rubeola se asocia a una respuesta específica de anticuerpos IgM, mientras que los niveles elevados de IgG en ausencia de IgM detectable indica un estado inmunológico que es protector frente a la infección aguda por virus de la rubeola.
En el caso de que el cribado prenatal indique que la mujer ha adquirido una infección primaria por rubeola durante las etapas iniciales del embarazo, con frecuencia se recomienda un aborto terapéutico. En consecuencia, resulta imperativo que los resultados de la prueba sean exactos.
Para detectar anticuerpos contra RV, el diagnóstico rutinario de laboratorio se basa principalmente en los ensayos ELISA (ensayo de inmunosorción ligada a enzima), mientras que el método más ampliamente aceptado para determinar el estado inmunológico del RV en Europa central es la prueba de inhibición de la hemoaglutinación (HAI) para verificar el ensayo ELISA de Ig del RV (Weber, 1997).
La detección de anticuerpos específicos de una determinada clase de inmunoglobulina puede llevarse a cabo uniendo la inmunoglobulina a una fase sólida en la que se ha inmovilizado antígeno específico. La inmunoglobulina unida posteriormente se detecta con un anticuerpo marcado específico para inmunoglobulinas humanas de una clase determinada. Este formato de ensayo únicamente puede llevarse a cabo mediante un formato de ensayo de dos etapas, incluyendo una etapa de lavado para eliminar las inmunoglobulinas no unidas antes de la detección. Un formato de ensayo de una etapa con frecuencia realizado en analizadores automáticos de inmunoensayo requiere el formato de ensayo directo de un sándwich de doble antígeno, es decir, el anticuerpo específico forma un complejo inmunológico que se une a un primer antígeno que se inmoviliza en una fase sólida o que media en la inmovilización en una fase sólida, y un segundo antígeno que porta un marcaje, permitiendo de esta manera la detección cuantitativa o cualitativa del anticuerpo unido específicamente.
La determinación selectiva de anticuerpos IgG específicos en presencia de anticuerpos IgM de la misma especificidad en un formato sándwich de doble antígeno en una etapa requiere estrictamente la utilización de antígenos solubles monoméricos u oligoméricos definidos (patente EP nº 0 944 838), revelando conformaciones inmunorreactivas.
El virus de la rubeola incluye cuatro proteínas estructurales que se ha demostrado que son antigénicas en animales y en seres humanos. Existen tres glucoproteínas de cubierta: E1 (58 kDa), E2a (47 kDa) y E2b (42 kDa) y la proteína de cápside (C) no glucosilada (33 kDa) que decora la cadena positiva de ARN monocatenario que forma el genoma vírico (Waxham y Wolinsky, 1985a; Oker-Blom et al., 1984).
Se ha demostrado que E2a y E2b son variantes del mismo producto génico y la diferencia de migración en geles de poliacrilamida se debe a la glucosilación heterogénea de las proteínas. Se ha encontrado que E1 y E2 forman monómeros o complejos unidos por disulfuro (E1-E1 y E1-E2), mientras que C existe exclusivamente como homodímero (Waxham y Wolinsky, 1983; Wolinsky, 1996). Una revisión extensa de las propiedades biológicas, físicas y bioquímicas del RV, así como de las características clínicas de la infección ha sido publicada por Wolinsky (1996).
En la actualidad, se utilizan antígenos para la detección de una infección por rubeola, que se derivan de líneas celulares establemente infectadas/transfectadas y, en general, se originan en la sobreproducción eucariótica. Seppänen et al. (1991) describe la expresión de E1 y E2 del virus de la rubeola en células de insecto Sf9 de Spodoptera frugiperda mediante la utilización de un sistema de expresión baculovírico. Asimismo, Seto (1994) da conocer la expresión de E1 soluble en un sistema baculovírico. Además, se da a conocer en Hobman et al. (1994) una línea celular CHO establemente transfectada que expresa y secreta las proteínas estructurales E1, E2 y C del RV en forma de partículas de tipo RV (RLPs).
Las partículas de tipo rubeola están compuestas de los antígenos principales de la rubeola E1, E2 y C, que se expresan en forma de proteínas precursoras de polipéptidos víricos. Debido a secuencias de señal, estas proteínas precursoras no procesadas se secretan al medio y se forman partículas de tipo vírico. La superficie de estas RLPs presenta epítopos adecuados para la detección inmunológica de anticuerpo anti-RV en los sueros positivos para rubeola. La expresión de partículas de tipo RV no infecciosas (VLPs) que contienen las tres proteínas estructurales del RV en la línea celular BHK (células renales de hámster nenonato) se describe de manera general en Qui et al., 1994.
Sin embargo, la producción de antígenos del RV en sistemas celulares eucarióticos es laboriosa y requiere mucho tiempo, y el rendimiento es comparativamente reducido. El establecimiento de métodos diagnósticos in vitro de detección de anticuerpos anti-virus rubeola requiere procedimientos de producción de antígenos recombinantes del RV procedentes de organismos procarióticos como E. coli de calidad definida, soluble, funcional y reproducible, con claras ventajas respecto a las RLPs establecidas.
Aunque se está avanzando rápidamente en la materia del diseño y manipulación de proteínas, los antígenos de la rubeola E1, E2 y C se expresan con una abundancia muy reducida en las células huésped de E. coli y, además, presentan una solubilidad reducida.
El antígeno de rubeola inmunodominante, es decir, el antígeno de elección para la detección inmunológica de anticuerpos en sueros humanos, es la proteína de cubierta E1. La topología global de la proteína E1 comprende un gran ectodominio extracelular (1 a 452) que incluye una región α-helicoidal (438 a 452) con un dominio transmembranal (453 a 468), seguido de un segmento corto de anclaje C-terminal (hasta 481).
Un motivo de la insolubilidad de E1 del RV podría ser la conformación del ectodominio, que se supone que está estabilizado... [Seguir leyendo]
Reivindicaciones:
1. Antígeno E1 soluble de rubeola y variantes de este péptido, caracterizado porque: (i) no presenta en el extremo C-terminal por lo menos la región transmembranal y el segmento de anclaje, así como por lo menos los aminoácidos 143 a 168, e (ii) contiene por lo menos la región que comprende los puentes disulfuro Cys349-Cys35 y Cys368-Cys401, y que comprende por lo menos los aminoácidos 315 a 412 de la secuencia de E1 de rubeola, en el que el antígeno E1 de rubeola se fusiona con una chaperona FKBP.
2. Antígeno E1 soluble de rubeola según la reivindicación 1, caracterizado porque presenta adicionalmente en el extremo C-terminal, la región α-helicoidal entre los residuos aminoácidos 438 y 452.
3. Antígeno E1 soluble de rubeola según las reivindicaciones 1 y 2, caracterizado porque la región N-terminal que contiene por lo menos la región que comprende los puentes disulfuro Cys8-Cys13 y Cys59-Cys71.
4. Antígeno E1 soluble de rubeola según la reivindicación 3, caracterizado porque contiene adicionalmente por lo menos la región que comprende el puente disulfuro Cys117-Cys130.
5. Antígeno E1 soluble de rubeola según las reivindicaciones 4 y 5, caracterizado porque contiene adicionalmente por lo menos la región que comprende el puente disulfuro Cys225-Cys235.
6. Antígeno E1 soluble de rubeola según las reivindicaciones 4 y 5, caracterizado porque contiene adicionalmente por lo menos la región que comprende el puente disulfuro Cys176-Cys185.
7. Antígeno E1 soluble de rubeola según las reivindicaciones 1 a 6, en el que la proteína se produce en forma de una proteína de fusión recombinante.
8. Molécula de ADN recombinante, codificante de un antígeno E1 de rubeola, que comprende por lo menos una secuencia de nucleótidos codificante de un antígeno E1 de rubeola según las reivindicaciones 1 a 6, en la que cadena arriba de la misma se encuentra por lo menos una secuencia de nucleótidos codificante de una chaperona FKBP.
9. Molécula de ADN recombinante según la reivindicación 8, caracterizada porque la chaperona FKBP se selecciona de entre el grupo que consiste de FkpA, SlyD y factor trigger.
10. Molécula de ADN recombinante según las reivindicaciones 8 y 9, caracterizada además porque comprende por lo menos una secuencia de nucleótidos codificante de un línker peptídico de 10 a 100 aminoácidos situado entre dicha secuencia codificante de un antígeno E1 de rubeola y dicha secuencia codificante de la chaperona FKBP.
11. Molécula de ADN recombinante según las reivindicaciones 8 a 10, caracterizada además porque por lo menos dos secuencias codificantes de una chaperona FKBP se encuentran situadas cadena arriba de la secuencia codificante de un antígeno E de rubeola.
12. Molécula de ADN recombinante según la reivindicación 11, caracterizada además porque una secuencia codificante de una chaperona FKBP se encuentra situada cadena arriba de un antígeno E de rubeola y la otra secuencia codificante de una chaperona FKBP se encuentra situada cadena abajo de la secuencia codificante de un antígeno E1 de rubeola.
13. Molécula de ADN recombinante según las reivindicaciones 11 y 12, caracterizada además porque comprende dos secuencias de ácidos nucleicos codificantes de un polipéptido línker de 10 a 100 aminoácidos.
14. Molécula de ADN recombinante según la reivindicación 13, en la que las dos secuencias de ácidos nucleicos codificantes de un línker de 10 a 100 aminoácidos son diferentes.
15. Vector de expresión que comprende operablemente ligada una molécula de ADN recombinante según cualquiera de las reivindicaciones 8 a 14.
16. Célula huésped transformada con un vector de expresión según la reivindicación 15.
17. Método para producir una proteína de fusión soluble e inmunorreactiva de antígeno E1 de rubeola-chaperona FKBP, comprendiendo dicho método las etapas de:
18. Método según la reivindicación 17, en el que la chaperona FKBP se selecciona de entre el grupo que consiste de SlyD, FkpA y factor trigger.
19. Método para la detección y para la determinación y para la cuantificación de anticuerpos anti-rubeola de la subclase IgG y/o IgM en una muestra en la que el antígeno E1 de rubeola según las reivindicaciones 1 a 7 se utiliza como reactivo de captura y/o pareja de unión para los anticuerpos.
20. Inmunoensayo según el concepto del puente de doble antígeno, que comprende: un primer antígeno E1 de rubeola según las reivindicaciones 1 a 8, y un segundo antígeno E1 de rubeola.
21. Utilización de por lo menos un antígeno de E1 de rubeola según cualquiera de las reivindicaciones 1 a 8 en un ensayo diagnóstico in vitro para la detección de anticuerpos anti-rubeola.
22. Kit de reactivos para la detección de anticuerpos anti-rubeola, que contiene por lo menos un antígeno de los antígenos E1 de rubeola según cualquiera de las reivindicaciones 1 a 8.
Patentes similares o relacionadas:
Nuevas proteínas bacterianas con actividad plaguicida, del 21 de Agosto de 2013, de UNIVERSIDAD NACIONAL AUTONOMA DE MEXICO INSTITUTO: Uso de una proteína insecticida para controlar plagas de insectos, en el que dicha proteína se caracteriza por: a) ser insecticida para Epilachna […]
ESPECIFICIDAD MEJORADA EN LA DETECCION DE ANTICUERPOS IGM DE ANTI-RUBEOLA., del 16 de Julio de 2006, de VIRAL ANTIGENS, INC.: Un método para la detección de anticuerpos IgM de anti-rubéola que ccomprende Poner en contacto una muestra sospechosa de contener anticuerpos IgM de anti-rubéola con […]
COMPOSICION DE INTERFERON HIBRIDO Y PROCEDIMIENTO DE USO., del 1 de Diciembre de 2005, de UNIVERSITY OF FLORIDA: LA PRESENTE INVENCION DESCRIBE POLIPEPTIDOS HIBRIDOS DE FUSION DEL INTERFERON, FORMADOS POR UN PRIMER SEGMENTO QUE CONTIENE LA SECUENCIA DE AMINOACIDOS […]
PEPTIDOS, SUS ANALOGOS Y MEZCLAS PARA DETECTAR Y PRODUCIR ANTICUERPOS DE LAS PROTEINAS E1 Y E2 DEL VIRUS DE LA RUBEOLA., del , de BIOCHEM IMMUNOSYSTEMS INC.: ESTA INVENCION SE REFIERE A PEPTIDOS CICLICOS LINEALES DE LAS GLICOPROTEINAS E1 Y E2 DEL VIRUS DE LA RUBEOLA. ESTOS PEPTIDOS Y ANALOGOS, MEZCLAS Y COMBINACIONES […]
 CONJUGADO DE UNION FIBRINA/FIBRINOGENO, del 13 de Noviembre de 2009, de BAXTER AKTIENGESELLSCHAFT
BAXTER INTERNATIONAL INC: Conjugado de unión fibrina/fibrinógeno que comprende una fracción de unión fibrina/fibrinógeno que comprende el dominio C-terminal de VEGF165, y una sustancia farmacéuticamente […]
CONJUGADO DE UNION FIBRINA/FIBRINOGENO, del 13 de Noviembre de 2009, de BAXTER AKTIENGESELLSCHAFT
BAXTER INTERNATIONAL INC: Conjugado de unión fibrina/fibrinógeno que comprende una fracción de unión fibrina/fibrinógeno que comprende el dominio C-terminal de VEGF165, y una sustancia farmacéuticamente […]
 RECEPTOR DE QUIMIOCINAS CXCR3, ANTICUERPOS, ACIDOS NUCLEICOS Y METODOS DE USO, del 1 de Enero de 2008, de THEODOR-KOCHER INSTITUTE
LEUKOSITE, INC.: LA INVENCION SE REFIERE A PROTEINAS RECOMBINANTES DE MAMIFEROS (POR EJ., HUMANOS) RECEPTORAS DEL IP-10/MIG DESIGNADAS COMO RECEPTOR 3 DE LA QUEMOQUINA […]
RECEPTOR DE QUIMIOCINAS CXCR3, ANTICUERPOS, ACIDOS NUCLEICOS Y METODOS DE USO, del 1 de Enero de 2008, de THEODOR-KOCHER INSTITUTE
LEUKOSITE, INC.: LA INVENCION SE REFIERE A PROTEINAS RECOMBINANTES DE MAMIFEROS (POR EJ., HUMANOS) RECEPTORAS DEL IP-10/MIG DESIGNADAS COMO RECEPTOR 3 DE LA QUEMOQUINA […]
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Ensayo de toxina botulínica con sensibilidad mejorada, del 1 de Julio de 2020, de BioMadison, Inc: Un método para aumentar la sensibilidad de la detección basada en células de una toxina botulínica, que comprende: (i) proporcionar una célula […]