Expresión heteróloga de proteínas de Neisseria.
b) una secuencia de longitud completa con al menos un 70% de identidad con la secuencia y en donde el péptido líder de la proteína está eliminado
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06076718.
Solicitante: NOVARTIS VACCINES AND DIAGNOSTICS S.R.L..
Nacionalidad solicitante: Italia.
Dirección: VIA FIORENTINA 1 53100 SIENA (SI) ITALIA.
Inventor/es: PIZZA, MARIAGRAZIA, COMANDUCCI, MAURIZIO, GALEOTTI,CESIRA, MASIGNANI,VEGA, Arico,Maria B, GUILIANI,MARZIA MONICA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Neisseriaceae (F), p. ej. Acinetobacter.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N15/70 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores o sistemas de expresión especialmente adaptados a E. coli.
PDF original: ES-2391153_T3.pdf
Fragmento de la descripción:
Expresión heteróloga de proteínas de Neisseria.
5 CAMPO TECNICO
Esta invención corresponde al campo de la expresión de proteínas. En particular se refiere a la expresión heteróloga de proteínas de Neisseria (por ejemplo N.gonorrhoeae o, preferiblemente, N. meningitidis) .
TECNICA ANTERIOR
Las solicitudes de patente internacional WO 99/24578, WO 99/36544, WO 99/57280 y WO 00/22430 describen proteínas de Neisseria meningitidis y Neisseria gonorrhoeae. Típicamente estas proteínas se describen
como expresadas en E. coli (esto es, expresión heteróloga) como fusiones GST N-terminales o fusiones His-tag Cterminales, aunque también se describen otros sistemas de expresión, incluida la expresión en Neisseria nativa. El documento FRA- 2720408 describe la producción heteróloga de una proteína de N. meningitidis en la que se ha suprimido al menos un dominio.
Es un objetivo de la presente invención proporcionar enfoques alternativos y mejorados para la expresión heteróloga de estas proteínas. Estos enfoques afectarán típicamente al nivel de expresión, la facilidad de purificación, la localización celular de expresión y/o las propiedades inmunológicas de la proteína expresada.
DESCRIPCION DE LA INVENCION
Nomenclatura en la presente
[04] Las secuencias de las proteínas 2166 divulgadas en la WO99/24578, WO99/36544 y la WO99/57280 están referidas en la presente por los siguientes números de SEQ#:
Solicitud Secuencias de proteína SEQ# en la presente WO99/24578 Even SEQ IDs 2-892 SEQ#s 1-446 WO99/36544 Even SEQ IDs 2-90 SEQ#s 447-491 WO99/57280 Even SEQ IDs 2-3020 Even SEQ IDs 3040-3114 SEQ IDs 3115-3241 SEQ#s 492-2001 SEQ#s 2002-2039 SEQ#s 2040-2166Además de esta numeración de SEQ#, también se usan las convenciones de denominación usadas en la WO99/24578, la WO99/36544 y la WO99/57280 (por ejemplo, "ORFs4", "ORF40", "ORF40-1", etc. como se usan en la WO99/24578 y la WO99/36544: "m919", "g919" y "a919" etc. como se usan en la WO99/57280) .
Las proteínas 2160 NMB0001 a NMB2160 de Tettelin y otros [Science (2000) 287:1809-1815] son referidas en la presente como SEQ#s 2167-4326 [ver también la WO00/66791].
El término "proteína de la invención" como se usa en la presente se refiere a una proteína inmunogénica que comprende: 40 a) al menos 90 aminoácidos consecutivos de la secuencia
b) una secuencia de longitud completa con al menos un 70% de identidad con la secuencia
y en donde el péptido líder de la proteína se borra
El grado de "identidad de secuencia" al que se hace referencia en (b) es preferiblemente mayor del 50% (por ejemplo 60%, 70%, 80%, 90%, 95%, 99% o más) . Esto incluye mutantes y variantes alélicas [ver por ejemplo la WO0/66741]. La identidad es preferiblemente determinada por el algoritmo de búsqueda de homología Smith-Waterman como se implementa en el programa MPSRCH (Oxford Molecular) , usando una búsqueda de huecos por afinidad con parámetros gap open penalty=12 y Gap extension penalty=1. Típicamente, un 50% de identidad o más entre dos proteínas se considera que es una indicación de equivalencia funcional.
El "fragmento" referido en (a) debería comprender la menos n aminoácidos consecutivos de una de las SEQ#s 1-4326 y, dependiendo de la secuencia particular, n es 90 o más (por ejemplo 90, 100 o más) . Preferiblemente el fragmento comprende un epítopo de una de las SEQ#s 1-4326. Los fragmentos preferidos don aquellos divulgados en la WO00/71574 y l aWO01/04316.
Las proteínas preferidas de la invención se encuentran en el serogrupo B de la N. meningitidis.
Las proteínas preferidas para el uso de acuerdo a la invención son aquellas de la cepa 2996 o la cepa 394/98 (Una cepa de Nueva Zelanda) de la N. meningitidis del serogrupo B. A menos que se indique lo contrario, las proteínas mencionadas en la presente son de la cepa 2996 de la N. meningitidis. Se apreciará, sin embargo, que la invención no está limitada en general por la cepa. Las referencias a una proteína particular (por ejemplo "287, "919") pueden ser tomadas para incluir esa proteína desde cualquier cepa.
Deleción del péptido líder
En un enfoque a la expresión heteróloga, se elimina el péptido líder nativo de una proteína de la invención. Además, se prefiere que no se use ninguna pareja de fusión.
Por lo tanto la invención proporciona un método para la expresión heteróloga de una proteína de la invención, en el que (a) el péptido líder de la proteína se borra y, opcionalmente, (b) no se usa pareja de fusión.
La invención proporciona un método para la expresión heteróloga de una proteína inmunogénica que comprende:
a) al menos 90 aminoácidos consecutivos de la secuencia
b) una secuencia de longitud completa con al menos un 70% de identidad con la secuencia
y en donde el péptido líder de la proteína se elimina.
El método implicará típicamente los pasos de: obtener ácido nucleíco que codifica una proteína de la invención; manipular el mencionado ácido nucleíco para retirar los nucleótidos que codifican el péptido líder de la proteína. EL ácido nucleíco resultante puede ser insertado en un vector de expresión, o puede ser ya parte de un vector de expresión. El primer aminoácido de la proteína expresada será el de la proteína nativa madura.
este método puede aumentar los niveles de expresión. Para la proteína 919, por ejemplo, los niveles de expresión en la E. coli son mucho más altos cuando el péptido líder se elimina. La expresión aumentada puede deberse a una localización alterada en ausencia del péptido líder.
El método se usa para la expresión de la 287.
Expresión basada en el dominio
En un cuarto enfoque de la expresión heteróloga, la proteína se expresa como dominios. Esto puede ser usado en asociación con sistemas de fusión (por ejemplo GST o fusiones His-tag) .
Por lo tanto la invención proporciona un método para la expresión heteróloga de una proteína de la invención, en el que (a) al menos un dominio en la proteína se borra y, opcionalmente (b) no se usa pareja de fusión.
El procedimiento típicamente implica las etapas de: obtener ácido nucleíco que codifica una proteína de la invención; manipular el mencionado ácido nucleíco para eliminar al menos un dominio del interior de la proteína. El ácido nucleíco resultante se puede insertar en un vector de expresión o puede ser ya parte de un vector de expresión. Cuando no se usan partícipes de fusión, el primer aminoácido de la proteína expresada será el de un dominio de la proteína.
Típicamente, una proteína se divide en dominio nocionales alineándola con secuencias conocidas de bases de datos y determinando luego regiones determinantes de la proteína que presentan diferentes configuraciones de alineamiento entre sí.
El método es preferiblemente usado para la expresión de la proteína 287. Esta proteína puede ser teóricamente dividida en tres dominios, referidos como A B y C (ver Figura 5) . EL dominio B se alinea fuertemente con las proteasas de la IgA, el dominio C se alinea fuertemente con las proteínas que enlazan la transferrina, y el dominio A no muestra alineamiento fuerte con las secuencias de la base de datos. Un alineamiento de formas polimórficas de la 287 se divulga en la WO00/66741.
Una vez que una proteína se ha dividido en dominios, éstos se pueden (a) expresar individualmente, (b) suprimir de la proteína, por ejemplo proteína ABCD - ABD, ACD, BCD, etc., o (c) reordenar por ejemplo, proteína ABC - ACB, CAB, etc. Estas tres estrategias se pueden combinar con parejas de fusión, si se desea.
LA ORF46 también ha sido teóricamente dividida en dos dominios - un primer dominio (aminoácidos 1-433) que está bien conservado entre las especies y los serogrupos, y un segundo dominio (aminoácidos 433-608) que no está bien conservado. El segundo dominio preferiblemente se elimina. Un alineamiento de formas polimórficas de la ORF46 se divulga en la WO00/66741.
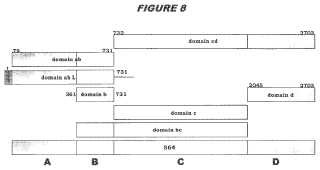
La proteína 564 también ha sido dividida en dominios (Figura 8) , como la proteína 961 (Figura 12) y la proteína 502 (aminoácidos 28-167 de la proteína MC58)... [Seguir leyendo]
Reivindicaciones:
1. Un método para la expresión heteróloga de una proteína inmunogénica que comprende a) al menos 90 aminoácidos consecutivos de la secuencia
b) una secuencia de longitud completa con al menos un 70% de identidad con la secuencia
y en donde el péptido líder de la proteína está eliminado.
2. El método de la reivindicación 1, en donde la proteína comprende una secuencia de longitud completa con al menos un 80% de identidad de secuencia con la secuencia enumerada en la reivindicación 1 a) .
3. El método de la reivindicación 1, en donde la proteína comprende una secuencia de longitud completa con al menos un 90% de identidad de secuencia con la secuencia enumerada en la reivindicación 1 a) .
4. El método de la reivindicación 1, en donde la proteína comprende una secuencia de longitud completa con al menos un 95% de identidad de secuencia con la secuencia enumerada en la reivindicación 1 a) .
5. El método de la reivindicación 1, en donde la proteína comprende una secuencia de longitud completa con al menos un 99% de identidad de secuencia con la secuencia enumerada en la reivindicación 1 a) .
6. El método de cualquiera de las reivindicaciones 1-5, en donde no se usa pareja de fusión.
7. El método de cualquiera de las reivindicaciones 1-6, en donde la mencionada proteína está expresada en la E. coli.
8. EL método de la reivindicación 1 en donde la proteína consiste de la secuencia
9. Una proteína inmunogénica que consiste de la secuencia
Patentes similares o relacionadas:
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Cadena alfa del receptor de IgE de alta afinidad de fusión Fc, del 13 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Una proteína de fusión Fc que comprende: (i) una cadena α del receptor de IgE de alta afinidad; y (ii) la región Fc de IgG1, en donde la región del fragmento […]
Procedimiento para diagnosticar cáncer y kit de diagnóstico a través de la medición de actividad de células NK, del 6 de Mayo de 2020, de NKMAX Co., Ltd: Un procedimiento para medir la actividad de los linfocitos citolíticos naturales (NK), que comprende: estimular las células NK en una muestra de sangre entera incubando […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 6 de Mayo de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: 1. Una dextransacarasa que consiste en una secuencia que tiene el 90 %, el 95 % o el 98 % de similitud de secuencia con una secuencia de aminoácidos seleccionada del fragmento […]
Receptores de antígeno quimérico dirigidos a antígeno de maduración de células B, del 6 de Mayo de 2020, de PFIZER INC.: Un receptor de antígeno quimérico específico de antígeno de maduración de células B (BCMA) (CAR) que comprende un dominio de unión a ligando extracelular, […]
Proteínas de fusión para la inhibición de angiogénesis, del 29 de Abril de 2020, de Allgenesis Biotherapeutics Inc: Una proteína de fusión que comprende: un péptido de unión a integrina que comprende unión de desintegrina a integrina αvβx […]