Procedimiento para la preparación de ésteres alquílicos del ácido 2,2-dicloro- o dibromo-fenilacético.
Procedimiento mejorado para la preparación de ésteres alquílicos del ácido 2,
2-dicloro- o -dibromo-fenilacético de la fórmula**Fórmula**
en la que X es Cl o Br, n puede ser un número entero de 1 hasta 5, R significa hidrógeno, alquilo de C1-C8, arilo, heteroarilo, alcoxi de C1-C8, ariloxi o halógeno y R1 significa alquilo de C1-C8, caracterizado por que se hace reaccionar un 2,2-dicloro- o dibromo-fenilacetonitrilo de la fórmula**Fórmula**
en la que X, n y R se definen como más arriba,
en 0,8 a 2 moles de agua por cada mol de un nitrilo de la fórmula (II), de 1 a 8 moles de un alcohol de la fórmula
R1OH (III)
en la que R1 es como se ha definido más arriba, por cada mol del nitrilo de la fórmula (II) y
en presencia de 1 a 3 moles de HCl o HBr por cada mol del nitrilo de la fórmula (II), eventualmente en presencia de un disolvente que es inerte en las condiciones de la reacción, para dar el correspondiente éster alquílico del ácido 2,2-dicloro- o dibromo-fenilacético de la fórmula (I), estando situada la temperatura de reacción en la primera fase de la conversión química en 35 hasta 55ºC y en la segunda fase en 60 hasta 100ºC, después de lo cual, tras de haberse efectuado la conversión química de la mezcla de reacción, se enfría a 20 hasta 40ºC y se diluye con agua, y se aísla el correspondiente éster alquílico del ácido 2,2-dicloro- o dibromo-fenilacético de la fórmula (I).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2003/002407.
Solicitante: DSM FINE CHEMICALS AUSTRIA NFG GMBH & CO KG.
Nacionalidad solicitante: Austria.
Dirección: ST.-PETER-STRASSE 25 4021 LINZ AUSTRIA.
Inventor/es: KRICH,SYLVIA, HOLUB,BERNHARD.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C67/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 67/00 Preparación de ésteres de ácidos carboxílicos. › a partir de nitrilos.
- C07C69/65 C07C […] › C07C 69/00 Esteres de ácidos carboxílicos; Esteres del ácido carbónico o del ácido halofórmico. › de ácidos insaturados.
PDF original: ES-2549401_T3.pdf
Fragmento de la descripción:
Procedimiento para la preparación de ésteres alquílicos del ácido 2, 2-dicloro-o dibromo-fenilacético Los ésteres alquílicos del ácido 2, 2-dicloro-o dibromo-fenilacético se emplean como compuestos intermedios, por ejemplo, en el caso de la preparación de agentes plaguicidas o como agentes aceleradores de la vulcanización para elastómeros.
La preparación de estos compuestos se efectuaba inicialmente tal como se describe por ejemplo en el documento de patente europea EP 0 075 356, mediante la reacción del pentacloruro de fósforo con un éster de ácido fenilglioxílico, que se obtenía a partir del cianuro de benzoílo. Puesto que el cianuro de benzoílo es un educto (producto de partida) muy caro, como alternativa se utilizó el cianuro de bencilo como educto para la preparación del 2, 2-dicloro-fenilacetonitrilo, por ejemplo de una manera análoga a la del documento EP 0 518 412, que luego se transforma, de acuerdo con el documento EP 0 075 356, en el deseado éster alquílico del ácido 2, 2-diclorofenilacético.
En tal caso, el 2, 2-dicloro-fenilacetonitrilo se hace reaccionar con agua y con un alcohol, en presencia de un halogenuro de hidrógeno, de manera preferida de HCl gaseoso, a una temperatura de 0 a 80ºC, de manera preferida de 15 a 50ºC.
Un problema que se plantea en el caso del modo de procedimiento descrito en ese documento EP 0 075 356 es la formación del producto secundario 2, 2-dicloro-fenilacetamida, que luego debe de ser separado a partir de la mezcla de reacción y que disminuye manifiestamente el rendimiento del compuesto final deseado. Otro problema reside, en el caso de la utilización de etanol como el alcohol y de HCl, la formación de cloruro de etilo, que es un producto secundario tóxico, fácilmente inflamable, que no debe de ser emitido. Otras reacciones secundarias son la hidrólisis del producto final para dar el correspondiente éster de ácido fenilglioxílico o respectivamente para dar el ácido fenilglioxílico. Con el fin de cumplir las especificaciones para el tratamiento ulterior, estos productos secundarios, tales como por ejemplo el ácido fenilglioxílico, deben, sin embargo, de estar presentes en el producto final en unas cantidades extremadamente pequeñas.
En el caso de la preparación de los ésteres alquílicos del ácido 2, 2-dicloro-fenilacético, bajo los parámetros y el transcurso del procedimiento que se describen en el documento EP 0 075 356, se obtiene el deseado producto final, además de ello, en unos rendimientos que solamente son hasta de 75 % y con unas altas proporciones de los más diferentes productos secundarios.
Una misión del presente invento fue por consiguiente encontrar un procedimiento mejorado para la preparación de ésteres alquílicos del ácido 2, 2-dicloro-o dibromo-fenilacético, que haga obtenibles los productos deseados en rendimientos más altos y con una pureza más alta.
Es objeto del invento, por consiguiente, encontrar un procedimiento mejorado para la preparación de ésteres alquílicos del ácido 2, 2-dicloro-o -dibromo-fenilacético de la fórmula
** (Ver fórmula) **
en la que X es Cl o Br, n puede ser un número entero de 1 hasta 5, R significa hidrógeno, alquilo de C1-C8, arilo, heteroarilo, alcoxi de C1-C8, ariloxi o halógeno y R1 significa alquilo de C1-C8, el cual ha de estar caracterizado porque se hace reaccionar el 2, 2-dicloro-o dibromo-fenilacetonitrilo de la fórmula
** (Ver fórmula) **
en la que X, n y R se definen como más arriba, en 0, 8 a 2 moles de agua por cada mol de un nitrilo de la fórmula (II) , de 1 a 8 moles de un alcohol de la fórmula R1OH (III)
en la que R1 es como se ha definido más arriba, por cada mol del nitrilo de la fórmula (II) y en presencia de 1 a 3 moles de HCl o HBr por cada mol del nitrilo de la fórmula (II) , eventualmente en presencia de un disolvente que es inerte en las condiciones de la reacción, para dar el correspondiente éster alquílico del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) , estando situada la temperatura de reacción, en la primera fase de la conversión química, en 35 a 55ºC y, en la segunda fase, en 60 a 100ºC, después de lo cual, tras haberse efectuado la conversión química de la mezcla de reacción, se enfría a 20 hasta 40ºC, se diluye con agua y se aísla el correspondiente éster alquílico del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) .
En el caso del procedimiento conforme al invento, un 2, 2-dicloro-o dibromo-fenilacetonitrilo de la fórmula (II) se hace reaccionar con agua, un alcohol R1OH y HCl o HBr, eventualmente en presencia de un disolvente que es inerte en las condiciones de la reacción, para dar el correspondiente éster alquílico del ácido 2, 2-dicloro-o dibromofenilacético de la fórmula (I) .
En la fórmula (II) X significa cloro o bromo, de manera preferida cloro. n representa un número entero de 1 a 5.
R puede significar en tal caso hidrógeno, alquilo de C1-C8, arilo, heteroarilo, alcoxi de C1-C8, ariloxi o halógeno. Por el concepto de alquilo de C1-C8 se han de entender en tal caso unos radicales alquilo lineales o ramificados con 1 hasta 8 átomos de C, tales como por ejemplo metilo, etilo, i-propilo, n-propilo, n-butilo, terc. butilo, n-propilo, hexilo u octilo. Se prefieren unos radicales alquilo de C1-C4 lineales o ramificados. Por el concepto de alcoxi de C1-C8 han de entenderse unos radicales alcoxi con 1 hasta 8 átomos de C, pudiendo la parte de alquilo ser lineal o ramificada, tal como por ejemplo metiloxi, etiloxi, i-propiloxi-, n-propiloxi, n-butiloxi, terc.butiloxi, n-propiloxi, hexiloxi u octiloxi. Se prefieren unos radicales alcoxi de C1-C4 lineales o ramificados. Por el concepto de arilo y ariloxi han de entenderse de manera preferida unos radicales aromáticos con 6 hasta 20 átomos de C, tales como fenilo, bifenilo, naftilo, indenilo, fluorenilo, fenoxi, etcétera Se prefieren como radicales aromáticos fenilo y fenoxi.
Por el concepto de heteroarilo han de entenderse unos radicales aromáticos, que contienen por lo menos un átomo de S, O o N en el anillo o en el sistema de anillos. Estos son, por ejemplo, furilo, piridilo, pirimidilo, tienilo, isotiazolilo, imidazolilo, quinolilo, benzotienilo, indolilo, pirrolilo, etcétera Por el concepto de halógeno han de entenderse flúor, cloro, bromo y yodo, siendo preferidos flúor, bromo y cloro.
En el caso de que R no sea hidrógeno, entonces n significa de manera preferida un número entero de 1 a 3, de manera especialmente preferida de 1 ó 2.
De manera preferida, R significa hidrógeno, un radical alquilo o alcoxi de C1-C4 lineal o ramificado, no sustituido, fenilo o fenoxi no sustituido, o cloro. De manera especialmente preferida, R significa hidrógeno.
Los eductos de la fórmula (II) , que se emplean para el procedimiento conforme al invento, se pueden adquirir comercialmente o se pueden preparar por ejemplo a partir del cianuro de bencilo, por ejemplo conforme al documento EP 0 518 412.
Los nitrilos de la fórmula (II) se hacen reaccionar conforme al invento con 0, 8 a 2 moles de agua por cada mol del nitrilo de la fórmula (II) , con 1 a 8 moles de un alcohol de la fórmula R1OH (III) por cada mol del nitrilo de la fórmula (II) y con 1 a 3 moles de HCl o respectivamente HBr por cada mol del nitrilo de la fórmula (II) .
Como un alcohol de la fórmula (III) son apropiados aquellos en los que R1 significa alquilo de C1-C8. Ejemplos de ellos son metanol, etanol, n-propanol, i-propanol, i-butanol, n-pentanol o n-hexanol. La elección del alcohol depende en tal caso del deseado éster en el producto final. De manera preferida, como un alcohol de la fórmula (III) se emplea metanol, etanol o n-butanol, de manera especialmente preferida etanol.
El alcohol de la fórmula (III) se emplea en este caso de una cantidad de 1 a 8 moles por cada mol del nitrilo de la fórmula (II) , de manera preferida de 3 a 5 moles por cada mol del nitrilo de la fórmula (II) . Se pueden emplear también mayores cantidades de un alcohol, pero éstas no son convenientes por motivos económicos. Si el alcohol se emplea en una cantidad de 1 a aproximadamente 3 moles por cada mol del nitrilo, entonces es ventajoso emplear un disolvente adicional, que es inerte en las condiciones de la reacción. Unos apropiados disolventes son por ejemplo unos éteres, tal como por ejemplo el metil-terc. butil-éter (MTBE) , el dietil-éter, el tetrahidrofurano (THF) , el dioxano o unos éteres superiores, tales como por ejemplo el etilenglicol-dimetil-éter, etcétera, o unos hidrocarburos eventualmente halogenados, tales como por ejemplo tolueno, hexano, heptano, diclorometano, clorobenceno, etcétera El agua es añadida a la mezcla de reacción en una cantidad de... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento mejorado para la preparación de ésteres alquílicos del ácido 2, 2-dicloro-o -dibromo-fenilacético de la fórmula
** (Ver fórmula) **
en la que X es Cl o Br, n puede ser un número entero de 1 hasta 5, R significa hidrógeno, alquilo de C1-C8, arilo, heteroarilo, alcoxi de C1-C8, ariloxi o halógeno y R1 significa alquilo de C1-C8, caracterizado por que se hace reaccionar un 2, 2-dicloro-o dibromo-fenilacetonitrilo de la fórmula
** (Ver fórmula) **
en la que X, n y R se definen como más arriba, 10 en 0, 8 a 2 moles de agua por cada mol de un nitrilo de la fórmula (II) , de 1 a 8 moles de un alcohol de la fórmula R1OH (III)
en la que R1 es como se ha definido más arriba, por cada mol del nitrilo de la fórmula (II) y en presencia de 1 a 3 moles de HCl o HBr por cada mol del nitrilo de la fórmula (II) , eventualmente en presencia de un disolvente que es inerte en las condiciones de la reacción, para dar el correspondiente éster alquílico del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) , estando situada la temperatura de reacción en la primera fase de la conversión química en 35 hasta 55ºC y en la segunda fase en 60 hasta 100ºC, después de lo cual, tras de haberse efectuado la conversión química de la mezcla de reacción, se enfría a 20 hasta 40ºC y se diluye con agua, y se aísla el correspondiente éster alquílico del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) .
2. Procedimiento de acuerdo con la reivindicación 1, caracterizado por que en la fórmula (I) R significa hidrógeno, alquilo de C1-C4, alcoxi de C1-C4, fenilo, fenoxi, flúor, bromo o yodo y n, en el caso de que R no sea hidrógeno, es un número entero de 1 a 3.
3. Procedimiento de acuerdo con la reivindicación 1, caracterizado por que como un alcohol de la fórmula (III) se emplea metanol o n-butanol.
4. Procedimiento de acuerdo con la reivindicación 1, caracterizado por que en el caso de que el alcohol de la fórmula
(III) se emplee en una cantidad de 1 a 3 moles por cada mol del nitrilo de la fórmula (II) , la reacción se lleva a cabo en presencia de un disolvente que es inerte en las condiciones de la reacción, tomado del conjunto formado por metil-terc. butil-éter, dietil-éter, tetrahidrofurano, dioxano, etilenglicol-dimetil-éter, tolueno, hexano, heptano, diclorometano o clorobenceno.
5. Procedimiento de acuerdo con la reivindicación 1, caracterizado por que como HCl o HBr se emplea el HCl o respectivamente HBr gaseoso de salida que se ha obtenido en el caso de la conversión química de un cianuro de bencilo eventualmente sustituido de la fórmula 9
** (Ver fórmula) **
en la que n y R son como se han definido en la fórmula (I) , con cloro, en presencia de unas cantidades catalíticas de ácido clorhídrico gaseoso o respectivamente con un agente de bromación, en el correspondiente nitrilo de la fórmula (II) , con lo que se consigue un acoplamiento directo de la preparación del nitrilo de la fórmula (II) con la preparación del correspondiente éster alquílico del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) .
6. Procedimiento para la preparación de ésteres alquílicos 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) , caracterizado por que en una 1ª etapa se hace reaccionar un cianuro de bencilo eventualmente sustituido de la fórmula
** (Ver fórmula) **
en la que n puede ser un número entero de 1 hasta 5 y R significa hidrógeno, alquilo de C1-C8, arilo, heteroarilo, alcoxi de C1-C8, ariloxi o halógeno y R1 significa alquilo de C1-C8, con cloro, en presencia de unas cantidades catalíticas de ácido clorhídrico gaseoso, o respectivamente con un agente de bromación, para dar el correspondiente nitrilo de la fórmula
** (Ver fórmula) **
en la que n y R son como más arriba se han definido, y X significa Cl o Br, y por que el HCl o respectivamente HBr gaseoso de salida que se forma en la segunda etapa se emplea para la conversión química del nitrilo de la fórmula (II) en el correspondiente éster alquílico del ácido 2, 2-dicloro-o dibromofenilacético de la fórmula
** (Ver fórmula) **
en la que X, n y R son como más arriba se han definido y R1 significa alquilo de C1-C8, efectuándose la conversión química en el correspondiente éster alquílico del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) en una segunda etapa en 0, 8 a 2 moles de agua por cada mol del nitrilo de la fórmula (II) , de 1 a 8 moles de un alcohol de la fórmula 5
R1OH (III)
en la que R1 es como más arriba se ha definido, por cada mol del nitrilo de la fórmula (II) y: con 1 a 3 moles de HCl o respectivamente HBr en forma del gas de salida procedente de la 1ª etapa por cada mol del nitrilo de la fórmula (II) , eventualmente en presencia de un disolvente que es inerte en las condiciones de la reacción, y la temperatura de reacción en la primera fase de la conversión química está situada en 35 a 55ºC y en la segunda fase en 60 a 100ºC, después de lo cual, tras haberse efectuado la conversión química de la mezcla de reacción se enfría a 20 hasta 40ºC y se diluye con agua, y se aísla el correspondiente éster alquílico del ácido 2, 2dicloro-o dibromo-fenilacético de la fórmula (I) .
7. Procedimiento de acuerdo con la reivindicación 1, caracterizado por que para la conversión química del nitrilo de la fórmula (II) se utiliza una mezcla de un alcohol/agua/HCl o HBr, que se obtiene por introducción de HCl gaseoso o respectivamente de HBr gaseoso en una mezcla de agua y un alcohol, o por introducción de HCl o respectivamente HBr gaseoso en una solución que está constituida a base de un alcohol y HCl o respectivamente HBr acuoso, o por introducción de HCl gaseoso o respectivamente de HBr gaseoso en un alcohol con una subsiguiente dilución con agua, pudiendo ser ajustada la relación molar deseada en la mezcla de un alcohol/agua/HCl o respectivamente HBr eventualmente mediante una dilución de la solución alcohólica, acuosa de HCl o respectivamente de HBr que está presente, con un alcohol y/o con agua.
8. Procedimiento de acuerdo con la reivindicación 7, caracterizado por que como gas de salida obtenido en forma de HCl gaseoso o respectivamente HBr gaseoso se emplea un gas de salida que se ha obtenido de acuerdo con la reivindicación 5 a partir de la conversión química de un cianuro de bencilo de la fórmula (IV) en el correspondiente nitrilo de la fórmula (II) , con lo que la preparación del nitrilo de la fórmula (II) no debe de ser acoplada directamente con la preparación del éster alquílico del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) y el HCl o respectivamente el HBr, que se obtienen como gas de salida en el caso de la preparación del nitrilo de la fórmula (II) se pueden almacenar de modo intermedio también en forma de la mezcla de un alcohol/agua/HCl o respectivamente HBr.
9. Procedimiento de acuerdo con la reivindicación 1, caracterizado por que para el aislamiento de los correspondientes ésteres alquílicos del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) se añade tanta cantidad de agua que el cloruro o respectivamente bromuro de amonio precipitado se disuelve precisamente y se inicia una separación de fases, después de lo cual, eventualmente después de una extracción de la fase acuosa, desde la fase orgánica se separan por destilación en primer lugar a la presión normal y a una temperatura hasta de como máximo 90ºC agua, un alcohol y un agente de extracción eventualmente presente y, a continuación en vacío, los productos secundarios hasta la consecución de una temperatura de ebullición constante, de manera tal que el correspondiente éster alquílico del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) permanece en el sumidero, que eventualmente para la purificación ulterior se puede destilar por la cabeza, o después de lo cual, eventualmente, después de una extracción de la fase acuosa, se separa de la fase orgánica en primer lugar el agua en el aparato separador de agua y a continuación a la presión normal se separan por destilación el alcohol y el agente de extracción eventualmente presente.
10. Procedimiento de acuerdo con la reivindicación 9, caracterizado por que el éster alquílico del ácido 2, 2-dicloro-o dibromo-fenilacético de la fórmula (I) en bruto, para el caso de que éste contenga demasiada cantidad de un ácido orgánico, se reúne con un agente de extracción tomado del conjunto formado por hexano, heptano, tolueno, éteres o ésteres y el correspondiente alcohol de la fórmula (III) , y se trata de nuevo por destilación.
Patentes similares o relacionadas:
Cetoenoles espirocíclicos sustituidos con bifenilo, del 9 de Octubre de 2018, de BAYER CROPSCIENCE AG: Compuestos de fórmula (I)**Fórmula** en la que W representa hidrógeno o metilo, X representa cloro o metilo, Y representa […]
Dispositivo electrocrómico con polímeros complementarios, del 28 de Junio de 2017, de Ashwin-Ushas Corporation, Inc: Un dispositivo electrocrómico complementario, que comprende: (a) un primer electrodo que comprende un material polimérico conductor de coloración […]
Tensioactivos fluorados, del 5 de Octubre de 2016, de MERCK PATENT GMBH: Compuestos de fórmula (I) **Fórmula** donde los grupos Zi (Z1, Z2 y Z3) ,independientemente entre sí, son grupos alquilo de cadena lineal o ramificada o grupos de estructura […]
Procedimiento para la alcoxicarbonilación de compuestos etilénicamente insaturados, del 29 de Junio de 2016, de EVONIK DEGUSSA GMBH: Un procedimiento para la alcoxicarbonilación de compuestos etilénicamente insaturados, caracterizado por que por lo menos un compuesto etilénicamente insaturado se […]
Procedimiento para preparar ácidos o ésteres de ácidos alquil-5-halopent-4-enocarboxílicos racémicos, del 5 de Abril de 2013, de DSM FINE CHEMICALS AUSTRIA NFG GMBH & CO KG: Un procedimiento para preparar ácidos alquil-5-halopent-4-enocarboxílicos racémicos y ésteres de los mismosde la fórmula (I) en que R es un radical […]
Método para producir fenilalcan-1-oles, del 19 de Septiembre de 2012, de BASF SE: Método para producir fenilalcan-1-oles de la fórmula I donde R1 se selecciona del grupo de hidrógeno, residuos alquilo ramificados, lineales o cíclicos con […]
 TRATAMIENTO DE DOLENCIAS NEURODEGENERATIVAS, del 14 de Octubre de 2010, de THE BOC GROUP PLC: Se proporciona un procedimiento para el tratamiento de un paciente necesitado de terapia para una enfermedad neurodegenerativa, que comprende […]
TRATAMIENTO DE DOLENCIAS NEURODEGENERATIVAS, del 14 de Octubre de 2010, de THE BOC GROUP PLC: Se proporciona un procedimiento para el tratamiento de un paciente necesitado de terapia para una enfermedad neurodegenerativa, que comprende […]
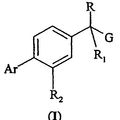 DERIVADOS DE ACIDOS 1-FENILALCANOCARBOXILICOS PARA EL TRATAMIENTO DE ENFERMEDADES NEURODEGENERATIVAS, del 1 de Marzo de 2009, de CHIESI FARMACEUTICI S.P.A.: Un compuesto de fórmula general (I): (Ver fórmula) en la que: R y R1 son el mismo y son alquilos C1-C4 lineales o ramificados; o forman […]
DERIVADOS DE ACIDOS 1-FENILALCANOCARBOXILICOS PARA EL TRATAMIENTO DE ENFERMEDADES NEURODEGENERATIVAS, del 1 de Marzo de 2009, de CHIESI FARMACEUTICI S.P.A.: Un compuesto de fórmula general (I): (Ver fórmula) en la que: R y R1 son el mismo y son alquilos C1-C4 lineales o ramificados; o forman […]