Epítopos funcionales del antígeno PsaA de Streptococcus pneumoniae y usos de los mismos.
Un péptido que comprende la secuencia de aminoácidos definida en la SEC ID Nº 1.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/027290.
Solicitante: THE GOVERNMENT OF THE UNITED STATES OF AMERICA AS REPRESENTED BY THE SECRETARY OF THE DEPARTMENT OF HEALTH AND HUMAN SERVICES.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: CENTERS FOR DISEASE CONTROL AND PREVENTION Technology Transfer Office 4770 Buford Hwy (K79) Atlanta, Georgia 30341 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ADES,EDWIN,W, CARLONE,GEORGE,M, SAMPSON,JACQUELYN,S, STEINER,SANDRA, CABA,JOSEPH J, RAJAM,GOWRISANKAR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/09 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Streptococcus.
- C07K14/315 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Streptococcus (G), p. ej. Enterococci.
- C07K16/12 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales bacterianos.
PDF original: ES-2431315_T3.pdf
Fragmento de la descripción:
Epítopos funcionales del antígeno PsaA de Streptococcus pneumoniae y usos de los mismos.
Antecedentes [0001] Streptococcus pneumoniae es una causa principal de morbilidad y mortalidad global, provocando 1, 5 millones de muertes cada año en todo el mundo, por ejemplo, de neumonía, bacteremia, meningitis, y otitis media principalmente en niños de <5 años de edad.
Están disponibles vacunas satisfactorias de polisacárido en los Estados Unidos. Sin embargo, países con recursos limitados no pueden producir estas vacunas. Las vacunas actuales (polisacárido 23-valente (adultos) ; y polisacárido 7-valente (niños) ) protegen contra los serotipos más prevalentes. Existen 90 serotipos conocidos de Streptococcus pneumoniae. Sin embargo, existe la necesidad de una vacuna que proteja contra todos los serotipos conocidos. La adhesina A de superficie de neumococos (PsaA) es una proteína común de estreptococos, y es una vacuna candidata que podría producirse para todos los países.
Descripción resumida [0003] Se proporciona un péptido P4, que contiene un epítopo de la proteína PsaA de Streptococcus pneumoniae, y métodos y composiciones relacionados.
Breve descripción de las figuras
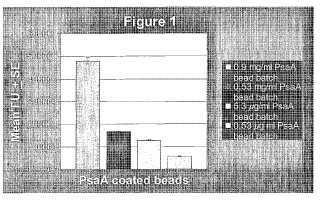
La Figura 1 muestra la adherencia media de 0, 9 mg/ml, 0, 53 mg/ml, 5, 3 μg/ml, y 0, 53 μg/ml de perlas recubiertas con rPsaA a células Detroit 562 (media de UF ± ET) cuando se añadían 1.640 ± 210 perlas por pocillo.
La Figura 2 muestra la adherencia del lote de 0, 53 mg/ml de perlas PsaA, perlas recubiertas con P4, y perlas de control recubiertas con glicina cuando se añadían 1640 ± 210 perlas por pocillo.
La Figura 3 muestra la adherencia de fluoroesferas recubiertas con rPsaA a células nasofaríngeas Detroit 562. Panel A. Fluoroesferas recubiertas con rPsaA (Molecular Probes, 1 μm de diámetro) adherentes después de 5
lavados por pocillo. Panel B. Inhibición de la adherencia de fluoesferas recubiertas con rPsaA mediante la adición de suero humano (suero 7074, dilución 1:10) que contenía anticuerpos anti-PsaA (18, 3 μg/ml, no diluido) . Aumento de campo 400x. Las imágenes se capturaron usando un microscopio fluorescente invertido Leitz y una cámara digital. El diámetro de la fluoesfera es de 1 μm.
La Figura 4 muestra la identificación de la secuencia de aminoácidos del péptido 4 (P4) mediante la comparación de las secuencias de los péptidos P1, P2, y P3 con la región PsaA en cuestión.
La Figura 5 muestra la adherencia media de fluoroesferas recubiertas con P1, P2, P3, P4, y rPsaA a células Detroit 562 (media de UF ± ET) cuando se añadían 3.100 ± 500 fluoroesferas por pocillo. Las fluoroesferas de 45 control se recubrieron con glicina para bloquear cualquier grupo carboxilo reactivo.
La Figura 6 muestra la adherencia a células nasofaríngeas Detroit 562 de fluoroesferas recubiertas con diversas concentraciones de rPsaA (900, 530, 5, 3 y 0, 53 μg/ml) . La señal de adherencia se da como la media de las UF ± ET cuando se añadían 1.640 ± 210 fluoroesferas por pocillo. La adherencia de las fluoesferas rPsaA recubiertas 50 con 1 mg/ml de rPsaA se muestra en la Fig. 2A.
La Figura 7 muestra la inhibición competitiva de la adherencia de fluoesferas recubiertas con rPsaA mediante la adición de péptido (10 μg/pocillo, 3 a 5 x 10-2 mM) P1, P2, P3, P4, o 3 μg/pocillo (9 x 10-4 mM) de proteína rPsaA. Concentraciones adicionales de rPsaA [intervalo = 0, 125 a 10, 0 μg/pocillo (0, 4 a 29, 7 x 10-4 mM) ] no produjeron 55 ninguna reducción adicional de la adherencia de las fluoesferas recubiertas con rPsaA. Aunque no se muestra, se observo una reducción del 95, 9% de la adherencia de las fluoesferas recubiertas con rPsaA cuando se usaban 20 μg/pocillo (6, 2 x 10-2 mM) de péptido homólogo P4 en la reacción de inhibición. La media (barras) y la SD (bigotes) representan el porcentaje promedio de la reducción obtenida en 3 ensayos diferentes usando múltiples concentraciones de fluoesferas PsaA (225 a 7.200 fluoesferas por pocillo) con señales que varían entre 60 5.500 y 100.000 UF para inhibiciones heterólogas del péptido y entre 5.500 y 23.000 UF para inhibición homólogas de PsaA.
La Figura 8 muestra el efecto de la adsorción parcial de anticuerpos contra PsaA en suero 7051 en la inhibición de la adherencia de fluoroesferas recubiertas con rPsaA. 65
Descripción detallada [0005] Como se usa en la memoria y las reivindicaciones adjuntas, las formas singulares "un", "una" y "el", "la" incluyen referentes plurales salvo que el contexto indique claramente lo contrario. Así, por ejemplo, una referencia a 5 "un vehículo farmacéutico" incluye mezclas de dos o más de dichos vehículos, y similares.
Péptidos/polipéptidos/proteínas [0006] Se proporciona un péptido P4, que contiene un epítopo de la proteína PsaA de Streptococcus pneumoniae. Se proporciona un péptido que comprende la secuencia de aminoácidos definida en la SEC ID Nº 1 (LFVESSVKRRPMKTVSQDTNIPIYAQIF) , un ejemplo del péptido P4.
También se proporciona un péptido que comprende la secuencia de aminoácidos definida como LFVDSSVDDRPMKTVSQDTNIPIYAQIF (SEC ID Nº 2) . Este péptido es un ejemplo más de un péptido P4, y difiere de la SEC ID Nº 1 en que el D en el resto 4 es E en P4, y los dos aminoácidos subrayados (DD en las posiciones 8 y 9) son "KR" en la secuencia P4. Se describe que un péptido P4 puede tener una, dos o las tres sustituciones de aminoácido mostradas en la SEC ID Nº 2.
La expresión "péptido" o "parte peptídica" se usa ampliamente en la presente memoria para indicar dos o más aminoácidos unidos por un enlace peptídico. La expresión "fragmento" o "fragmento proteolítico" se usa en la presente memoria para hacer referencia a un producto que puede producirse mediante una reacción proteolítica sobre un polipéptido, es decir, un péptido producido tras la escisión de un enlace peptídico en los polipéptidos. Aunque la expresión "fragmento proteolítico" se usa generalmente en la presente memoria para hacer referencia a un péptido que puede producirse mediante una reacción proteolítica, debe reconocerse que el fragmento no tiene que producirse necesariamente mediante una reacción proteolítica, sino que también puede producirse usando métodos de síntesis química o métodos de tecnología de ADN recombinante, para producir un péptido sintético que es equivalente a un fragmento proteolítico. Debe reconocerse que el término "péptido" no se usa en la presente memoria para sugerir un tamaño particular o cantidad de aminoácidos que comprende la molécula, y que un péptido de la invención puede contener hasta varios restos aminoacídicos o más.
Por "polipéptido aislado" o "polipéptido purificado" se entiende un polipéptido (o un fragmento del mismo) que está sustancialmente libre de los materiales con que el polipéptido está normalmente asociado en la naturaleza. Los polipéptidos de la invención, o fragmentos de los mismos pueden obtenerse, por ejemplo, mediante extracción de una fuente natural (por ejemplo, una célula bacteriana) , mediante expresión de un ácido nucleico recombinante que codifique el polipéptido (por ejemplo, en una célula o en un sistema de traducción sin células) , o mediante síntesis química del polipéptido. Además, los fragmentos polipeptídicos pueden obtenerse por cualquiera de estos métodos, o escindiendo la proteína PsaA de longitud completa seguido de la purificación del fragmento.
Un fragmento de una proteína o polipéptido de referencia incluye solamente aminoácidos contiguos de la proteína/polipéptido de referencia, y es al menos un aminoácido más corto que la secuencia de referencia.
También se proporcionan variantes de la SEC ID Nº 1. Por ejemplo, el péptido de la SEC ID Nº 2 es una variante del péptido de la SEC ID Nº 1. También se describen variantes de la SEC ID Nº 2.
El péptido puede comprender aminoácidos además de los expuestos en la SEC ID Nº 1 y la SEC ID Nº 2. Por ejemplo, los aminoácidos adicionales pueden corresponder a uno o más aminoácidos N-terminales y/o Cterminales contiguos de PsaA. En un ejemplo el péptido consiste en la SEC ID Nº 1, más combinaciones de 0 a 6 aminoácidos en el extremo N-terminal y de 0 a 6 aminoácidos en el extremo C-terminal, en el cual los aminoácidos son aminoácidos contiguos que flanquean la SEC ID Nº 1 en una PsaA nativa (también mencionada como "no mutante" o "de origen natural") (por ejemplo, la PsaA descrita en GenBank, NCBI, base de datos Blast disponible en www.ncbi.nlm.nih.gov/blas/Blast.cqi, con el número de acceso gi|7920462|gb|AAF70667.1) . En la mayoría de los casos hay de 0 a 3 aminoácidos adicionales en cada extremo, en los cuales los... [Seguir leyendo]
Reivindicaciones:
1. Un péptido que comprende la secuencia de aminoácidos definida en la SEC ID Nº 1.
2. El péptido de la reivindicación 1 para su uso en el tratamiento y/o prevención de infecciones neumocócicas inhibiendo la unión de la proteína adhesina A de superficie neumocócica (PsaA) y/o Streptococcus pneumoniae a células que expresan un receptor de PsaA.
3. El péptido de la reivindicación 1 para su uso en el tratamiento y/o prevención de infecciones neumocócicas inhibiendo la unión de un Streptococcus pneumoniae transparente a una célula y/o potenciando la unión o internalización del fenotipo opaco.
4. El péptido de la reivindicación 1 para su uso en el tratamiento y/o prevención de infecciones neumocócicas
potenciando la internalización de Streptococcus pneumoniae por células de la nasofaringe. 15
5. El péptido de la reivindicación 1 para su uso en el aumento del desarrollo de células neurales y la curación de heridas aumentando la expresión de FGFbásico por una célula.
6. El péptido de la reivindicación 1 para su uso en la reversión o retardo de metástasis tumoral disminuyendo la expresión por parte de una célula de una o más citoquinas seleccionadas entre el grupo que consiste en IL-8, IL-16 y EGF.
7. Un método de cribado in vitro para identificar un anticuerpo que bloquea la unión de una proteína adhesina A de
superficie neumocócica (PsaA) a una célula, que comprende: 25
a. poner en contacto la célula con el péptido de la reivindicación 1 en presencia o ausencia del anticuerpo inhibidor putativo; y
b. determinar la cantidad de unión de péptido a la célula en presencia y ausencia del anticuerpo inhibidor putativo, mediante lo cual una cantidad reducida de unión del péptido en presencia del anticuerpo en comparación con la cantidad de unión en ausencia del anticuerpo identifica el anticuerpo como un anticuerpo que bloquea la unión de la proteína adhesina A de superficie neumocócica (PsaA) a células epiteliales.
8. El método de cribado in vitro de la reivindicación 7, en el cual la PsaA es una célula bacteriana.
9. El método de cribado in vitro de la reivindicación 7, en el cual la PsaA está purificada.
10. Un método de cribado in vitro para identificar un anticuerpo que bloquea la unión de Streptococcus pneumoniae a una célula, que comprende:
a. poner en contacto la célula con el péptido de la reivindicación 1 en presencia o ausencia del anticuerpo inhibidor putativo; y
b. determinar la cantidad de unión de péptido a la célula en presencia y ausencia del anticuerpo inhibidor putativo, mediante lo cual una cantidad reducida de unión del péptido en presencia del anticuerpo en comparación con la cantidad de unión en ausencia del anticuerpo identifica el anticuerpo como un anticuerpo que
bloquea la unión de Streptococcus pneumoniae a células epiteliales.
11. Una vacuna que comprende el péptido de la reivindicación 1 y un portador farmacéutico.
12. El péptido de la reivindicación 1 para su uso en la inhibición de la unión de la proteína adhesina A de superficie neumocócica (PsaA) a células que expresan un receptor de PsaA.
13. El uso del péptido de la reivindicación 1 para preparar un medicamento destinado al tratamiento y/o prevención de infecciones neumocócicas inhibiendo la unión de la proteína adhesina A de superficie neumocócica (PsaA) a células que expresan un receptor de PsaA.
14. El uso del péptido de la reivindicación 1 para preparar un medicamento destinado al tratamiento y/o prevención de infecciones neumocócicas inhibiendo la unión de un Streptococcus pneumoniae transparente a una célula y/o potenciando la unión o internalización del fenotipo opaco.
15. El uso del péptido de la reivindicación 1 para preparar un medicamento destinado al tratamiento y/o prevención de infecciones neumocócicas potenciando la internalización de Streptococcus pneumoniae en células de la nasofaringe.
16. El uso del péptido de la reivindicación 1 para preparar un medicamento para aumentar el desarrollo de células 65 neurales y la curación de heridas aumentando la expresión de FGFbásico por una célula.
17. El uso del péptido de la reivindicación 1 para preparar un medicamento para revertir o retardar la metástasis tumoral disminuyendo la expresión por parte de una célula de una o más citoquinas seleccionadas entre el grupo que consiste en IL-8, IL-16 y EGF.
REFERENCIAS CITADAS EN LA DESCRIPCIÓN
Esta lista de referencias citadas por el solicitante es únicamente para la comodidad del lector. No forma parte del documento de la patente europea. A pesar del cuidado tenido en la recopilación de las referencias, no se pueden 5 excluir errores u omisiones y la EPO niega toda responsabilidad en este sentido.
Documentos de patentes citados en la descripción
Literatura diferente de patentes citadas en la descripción 65 5
Patentes similares o relacionadas:
Una novedosa proteína de Haemophilus influenzae expuesta en la superficie (proteína E; pE), del 24 de Junio de 2020, de FORSGREN, ARNE: Una composición de la vacuna para uso en el tratamiento o prevención de otitis media, sinusitis, infecciones del tracto respiratorio inferior o enfermedad pulmonar […]
Un nuevo antígeno de vacuna no de VIH de la microbiota vaginal capaz de inducir una respuesta de anticuerpos protectores neutralizadores de la mucosa contra la infección por VIH, del 13 de Mayo de 2020, de B Cell Design: Un antígeno de permeasa de Mycoplasma genitalium o un polinucleótido que codifica dicho antígeno en forma expresable, para su uso en la prevención y/o el tratamiento […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Producto de salud para perros que contiene anticuerpos contra el parvovirus canino tipo 2, del 8 de Abril de 2020, de MARS, INCORPORATED: Una composición que contiene anticuerpos procedentes de un perro vacunado contra el parvovirus canino tipo 2 en combinación con uno de los siguientes anticuerpos […]
Anticuerpos antiteicoicos de pared y conjugados, del 11 de Marzo de 2020, de GENENTECH, INC.: Un compuesto conjugado anticuerpo-antibiótico que comprende un anticuerpo monoclonal anti-ácidos teicoicos de pared (WTA), en donde el anticuerpo monoclonal anti-ácidos […]
Un anticuerpo que posee una afinidad por el tejido secretor epitelial y nervioso, así como el tejido tumoral derivado de estos tejidos, así como el uso de los mismos, del 4 de Marzo de 2020, de INSTYTUT IMMUNOLOGII I TERAPII DOSWIADCZALNEJ-PAN: Uso de un anticuerpo dirigido contra el antígeno bacteriano que comprende un motivo estructural definido por la fórmula: **(Ver fórmula)** […]
Fragmentos mutantes de OspA y métodos y usos relacionados con estos, del 4 de Marzo de 2020, de Valneva Austria GmbH: Un polipéptido que comprende el polipéptido con la secuencia de aminoácidos de la SEQ ID NO: 190; o cualquier variante funcional de dicha secuencia de aminoácidos […]
Anticuerpos dirigidos contra determinantes de la superficie de S. aureus, del 8 de Enero de 2020, de Medlmmune, LLC: Una composición que comprende (i) un anticuerpo monoclonal humano aislado o un fragmento de unión a antígeno del mismo que se unen específicamente a una alfa toxina (AT) de S. […]