Ensayos de espectrometría de masas para la actividad acetiltransferasa/desacetilasa.
Procedimiento para identificar un compuesto que activa una sirtuina,
que comprende:
poner en contacto un conjunto de sustratos peptídicos con una sirtuina en presencia de un compuesto problema,en el que la concentración del sustrato peptídico en el conjunto de sustratos peptídicos está por debajo de la Kmde la sirtuina para el sustrato peptídico, y en el que los miembros de dicho conjunto de sustratos peptídicoscomprenden al menos un resto de lisina acetilado, y
determinar el nivel de acetilación del conjunto de sustratos peptídicos mediante espectrometría de masas, en elque una reducción del nivel de acetilación del conjunto de sustratos peptídicos en presencia del compuestoproblema, en comparación con una reacción de control en la que el compuesto problema no está incluido, esindicativa de un compuesto que activa una sirtuina
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/046021.
Solicitante: SIRTRIS PHARMACEUTICALS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 200 TECHNOLOGY SQUARE, SUITE 300 CAMBRIDGE, MA 02139 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MILNE,Jill, CARNEY,David, SMITH,JESSE, LYNCH,AMY, IFFLAND,ANDRE, BOSS,OLIVIER.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/25 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen enzimas que no pueden ser clasificarsse en los grupos C12Q 1/26 - C12Q 1/70.
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2389111_T3.pdf
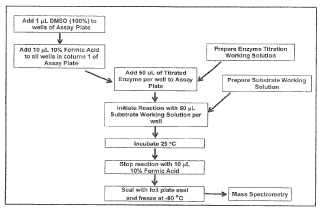
Fragmento de la descripción:
Ensayos de espectrometría de masas para la actividad acetiltransferasa/desacetilasa
ANTECEDENTES
La acetilación y la desacetilación de proteínas histónicas, factores de transcripción y proteínas relacionadas desempeñan una función importante en el control de los procesos celulares. En particular, el estado de acetilación de las histonas controla la fortaleza de la interacción entre las proteínas histónicas y el ADN y, por lo tanto, lo accesible que está el ADN a los factores de transcripción. Las enzimas que añaden grupos acetilo a las histonas o a otras proteínas se denominan histona acetiltransferasas (HAT) . Las enzimas que retiran los grupos acetilo se dividen en dos familias: las histona desacetilasas (HDAC) y la familia Sir2 de desacetilasas. En la actualidad hay once miembros conocidos de la familia de las HDAC de los mamíferos (Gray y Ekstrom, Exper. Cell Res. 2001, 262, 7583; Zhou, et al. Proc. Natl. Acad. Sci. USA 2001, 98, 10572-10577; Kao et al. J. Biol. Chem. 2002, 277, 187-193; Gao et al. J. Biol. Chem. 2002, 277, 25748-25755) y siete miembros de la familia Sir2 (Gray y Ekstrom, Exper. Cell. Res. 2001, 262, 75-83) .
Las histona acetiltransferasas catalizan la transferencia de un grupo acetilo desde el acetil-CoA al grupo £-amino de un resto de lisina de la proteína diana. Se han caracterizado muchas enzimas HAT a partir de organismos eucariotas (Sterner y Berger, Microbiol. Mol. Biol. Rev. 2000, 64, 435-459) . Las enzimas HDAC utilizan un ion de cinc en el centro activo de la proteína para catalizar la retirada del grupo acetilo de la acetil-lisina en forma de acetato. Los miembros de la familia Sir2 de enzimas utilizan NAD como cofactor para la hidrólisis de la acetil-lisina.
El estado de acetilación de las proteínas histónicas desempeña una función importante en la expresión génica y en el control del ciclo celular, y parece intervenir en determinadas formas de cáncer. En particular, se ha demostrado que el reclutamiento anormal de las histona desacetilasas por proteínas correpresoras promueve el desarrollo de la leucemia promielocítica. En las líneas de células tumorales, varios estudios han demostrado que el tratamiento con inhibidores de las HDAC puede conducir a la inhibición del crecimiento, la parada del crecimiento, la diferenciación terminal y/o la apoptosis. Los estudios in vivo han demostrado que la inhibición del crecimiento de tumores y que una reducción de las metástasis tumorales de resultas del tratamiento con inhibidores de las HDAC (Kramer et al., Trends. Endocrinol. Metab. 2001, 12, 294-300) .
El estudio eficaz de la enzimología y de la modulación de las enzimas HAT, HDAC y Sir2 depende de la disponibilidad de ensayos robustos que se puedan realizar con alto rendimiento. Se han desarrollado varias metodologías de ensayo para estas enzimas, con diferentes grados de utilidad para el escrutinio de inhibidores y activadores.
En los ensayos de las histona acetiltransferasas se suele utilizar la radioactividad. En estos formatos, el acetil-CoA radiomarcado en el grupo acetilo se hace reaccionar con un péptido que corresponde a una secuencia de aminoácidos de histona. La transferencia del acetato radiomarcado al péptido se cuantifica mediante la unión del péptido a resina de afinidad (Ait-Si-Ali et al., Nucleic Acids Res. 1998, 26, 3869-3870) , a papel de fosfocelulosa (Tanner et al., J. Biol. Chem., 1999, 274, 18157-18160) , o a microplacas de centelleo (Wynne Aheme et al., Methods, 2002, 26, 245-53) , y la medición de la radioactividad asociada. En un formato de ensayo acoplado no radioactivo, el CoA libre que se forma en la reacción acetiltransferásica sirve de sustrato para la a-cetoglutarato deshidrogenasa o la piruvato deshidrogenasa. La formación de NADH sirve para medir la velocidad de la actividad acetiltransferasa (Kim et al., Anal. Biochem. 2000, 280, 308-314) .
La metodología más habitual de ensayo de la desacetilasa implica la marcación de péptidos de histona en grupos lisina con acetato radiomarcado. La enzima desacetilasa retira el grupo acetilo como acetato, el cual se aísla posteriormente por extracción y se cuantifica basándose en su radioactividad (Inoue y Fujimoto, Biochim. Biophys. Acta. 1970, 220, 307-316) . En una variante de este método, un ensayo de proximidad de centello, los péptidos modificados con grupos acetilo radiomarcados se unen a una perla que contiene líquido de centelleo que emite luz cuando se expone a la radiación. En este formato de ensayo, la escisión de los grupos acetilo ocasiona una disminución de la emisión de luz desde el líquido de centelleo (Nare et al., Anal. Biochem. 1999, 267, 390-396) . Un ensayo que no emplea radioactividad utiliza péptidos que contienen un grupo acetil-lisina y una etiqueta fluorescente. La reactividad se mide mediante cromatografía líquida de alta resolución, donde las diferencias del tiempo de retención de los péptidos acetilados y sin acetilar se utiliza para aislar y cuantificar los productos de reacción (Hoffmann et al., Nucleic Acids. Res., 1999, 27, 2057-8; Hoffinann et al., Bioconjug. Chem. 2001, 12, 51-5; Hoffmann et al., Arch Pharm (Weinheim) 2001, 334, 248-52) . Un ensayo comercial utiliza un protocolo de detección en dos etapas. En la primera etapa, un péptido que contiene una acetil-lisina se hace reaccionar con una desacetilasa durante un periodo de tiempo determinado. Después de esto, se hace detener la reacción y la lisina expuesta se hace reaccionar con un agente de revelado que produce un fluoróforo, y la cantidad de lisina desacetilada se cuantifica mediante la fluorescencia del producto (Biomol, Plymouth Meeting, Pa., EE.UU.) . Más recientemente se describió un ensayo de dos etapas acoplado a proteasa, en el cual se diseñó un péptido para que contuviera un par de extintor-donante de transferencia de energía de resonancia de fluorescencia (FRET, por su nombre en inglés) y una acetil-lisina. Después de dejar que tenga lugar la reacción de la desacetilasa, se detiene la reacción y se cuantifica la cantidad de péptido desacetilado mediante la reacción del péptido deslacetilado con una enzima proteásica que se escinde específicamente después de restos de lisina (Frey et al., Presentado en la 224.ª Reunión nacional de la American Chemical Society, Boston, Mass., agosto de 2002; artículo MEDI-121, Marcotte et al., Anal., Biochem., 332: 90 (2004) ) .
Blander et al. (Journal of Biological Chemistr y , 18 de marzo, 2005, vol. 280, n.º 11, páginas 9780-9785) describen el uso de la espectrometría de masas en un método para analizar productos de desacetilación de SIRT1 utilizando sustratos que comprenden al menos un resto lisina acetilado (Fmoc-MASTGG-AcK-DSTEMAEEE) . El método comprende las etapas adicionales de modificar la amina de los sustratos de los péptidos y capturar los sustratos peptídicos desacetilados y biotinilados. La acción de SIRT1 da lugar a la desacetilación de los sustratos, lo que significa que cuando la enzima es activa, se vuelve visible un pico de 1895, 56 en los espectros de masas [m/z] (figura 2) . En otras palabras, se puede monitorizar la actividad de SIRT1. Al mismo tiempo se puede monitorizar la pérdida de un grupo acetilo por la desaparición del pico de 1959, 89 (figura 2) . Así pues, se puede medir una disminución de la acetilación, lo que indica que la proteína es un sustrato para SIRT1 que transmite la actividad de SIRT1.
Las características de los formatos de ensayo anteriores limitan su utilidad. Los ensayos en los que se emplea radioactividad tienden a ser costosos y requieren unas precauciones especiales para su manipulación. De igual forma, a menudo son difíciles de realizar en alto rendimiento. Por consiguiente, se necesitan mejores ensayos para medir la actividad de las acetiltransferasas o de las desacetilasas.
COMPENDIO
Se dan a conocer en la presente memoria métodos para identificar compuestos que modulan la actividad de una desacetilasa.
Un método para identificar un compuesto que activa una sirtuina, que comprende:
poner en contacto un conjunto de sustratos de péptidos con una sirtuina en presencia de un compuesto problema, en el que la concentración del sustrato peptídico en el conjunto de sustratos peptídicos está por debajo de la Km de la sirtuina por el sustrato peptídico, y en el que los miembros de dicho conjunto de sustratos peptídicos comprende al menos un resto de lisina acetilado, y
determinar el nivel de acetilación del conjunto de sustratos peptídicos mediante espectrometría de masas, en donde una disminución del nivel de acetilación del conjunto... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para identificar un compuesto que activa una sirtuina, que comprende:
poner en contacto un conjunto de sustratos peptídicos con una sirtuina en presencia de un compuesto problema, en el que la concentración del sustrato peptídico en el conjunto de sustratos peptídicos está por debajo de la Km de la sirtuina para el sustrato peptídico, y en el que los miembros de dicho conjunto de sustratos peptídicos comprenden al menos un resto de lisina acetilado, y
determinar el nivel de acetilación del conjunto de sustratos peptídicos mediante espectrometría de masas, en el que una reducción del nivel de acetilación del conjunto de sustratos peptídicos en presencia del compuesto problema, en comparación con una reacción de control en la que el compuesto problema no está incluido, es indicativa de un compuesto que activa una sirtuina.
2. Procedimiento de acuerdo con la reivindicación 1, en el que el compuesto es una molécula pequeña.
3. Procedimiento para determinar la actividad desacetilasa de una sirtuina, que comprende:
(a) poner en contacto un conjunto de sustratos peptídicos con una sirtuina, en el que la concentración del sustrato peptídico en el conjunto de sustratos peptídicos está por debajo de la Km de la sirtuina para el sustrato peptídico, y en el que los miembros de dicho conjunto de sustratos peptídicos comprenden al menos un resto de lisina acetilado; y
(b) determinar el nivel de acetilación del conjunto de sustratos peptídicos mediante espectrometría de masas, en el que una reducción del nivel de acetilación del conjunto de sustratos peptídicos es indicativa de actividad desacetilasa de la sirtuina.
4. Procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que la concentración del sustrato peptídico en el conjunto de sustratos peptídicos está al menos 2 veces por debajo de la Km de la desacetilasa para el sustrato peptídico.
5. Procedimiento de acuerdo con la reivindicación 4, en el que la concentración del sustrato peptídico en el conjunto de sustratos peptídicos está al menos 10 veces por debajo de la Km de la desacetila para el sustrato peptídico.
6. Procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 3, que además comprende la determinación de la Km de la desacetilasa para el conjunto de sustratos peptídicos.
7. Procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 6, que se realiza en un formato de alto rendimiento.
8. Procedimiento de acuerdo con la reivindicación 1 o 3, en el que la secuencia del sustrato peptídico procede de p53.
9. Procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que el conjunto de sustratos peptídicos comprende una única especie de péptido.
10. Procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que el conjunto de sustratos peptídicos comprende una mezcla de dos o más péptidos.
11. Procedimiento de acuerdo con la reivindicación 1 o 3, en el que la sirtuina es una proteína SIRT1.
12. Procedimiento de acuerdo con la reivindicación 1, en el que se identifica un compuesto que activa una sirtuina en mayor grado que el resveratrol.
13. Procedimiento de acuerdo con la reivindicación 12, en el que se identifica un compuesto que tiene actividad activadora de la sirtuina al menos 5 veces mayor que la actividad activadora de la sirtuina del resveratrol.
14. Procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que la espectrometría de masas es espectrometría de masas por ionización por electronebulización (ESI) o espectrometría de masas por desorción e ionización por láser asistida por una matriz (MALDI) .
15. Procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 o 2, en el que la reacción de control incluye un compuesto que tiene un efecto conocido sobre la actividad desacetilasa.
Patentes similares o relacionadas:
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]
Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal, del 29 de Julio de 2020, de Astute Medical, Inc: Un método para evaluar el estado renal en un sujeto, que comprende: realizar una pluralidad de ensayos configurados para detectar una […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]