ENDOPRÓTESIS BIODEGRADABLES Y PROCEDIMIENTOS DE FABRICACIÓN DE LAS MISMAS.
Una endoprótesis biodegradable, que comprende: un material relativamente electronegativo y un material relativamente electropositivo entre los que se forma una célula galvánica,
y un recubrimiento que controla la corriente eléctrica que cubre al menos una porción de la endoprótesis que es eficaz para modular la corriente o la densidad de corriente de la célula galvánica a medida que la endoprótesis se degrada caracterizado porque el recubrimiento que controla la corriente eléctrica tiene un espesor, una velocidad de degradación y/o una porosidad variables y controla la exposición de al menos uno del material electronegativo y el material electropositivo a los fluidos corporales
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/088888.
Solicitante: BOSTON SCIENTIFIC LIMITED.
Nacionalidad solicitante: Barbados.
Dirección: P.O. BOX 1317 SEASTON HOUSE HASTINGS CHRIST CHURCH BARBADOS.
Inventor/es: WARNER, ROBERT W., WEBER,JAN, ATANASOSKA,Liliana.
Fecha de Publicación: .
Fecha Solicitud PCT: 27 de Diciembre de 2007.
Clasificación Internacional de Patentes:
- A61L31/02B
- A61L31/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 31/00 Materiales para otros artículos quirúrgicos. › Materiales caracterizados por su función o por sus propiedades físicas.
- A61L31/14K
Clasificación PCT:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2356274_T3.pdf
Fragmento de la descripción:
Endoprótesis biodegradables y procedimientos de fabricación de las mismas.
Campo técnico
La invención se refiere a endoprótesis biodegradables, y a procedimientos de fabricación de las mismas.
Antecedentes
El cuerpo contiene diversos conductos tales como arterias, otros vasos sanguíneos, y otras luces corporales. A menudo, estos conductos se ocluyen o se debilitan. Por ejemplo, los conductos pueden ser ocluidos por un tumor, constreñidos por una placa, o debilitados por un aneurisma. Cuando ocurre esto, los conductos se pueden volver a abrir o reforzar con una endoprótesis médica. Normalmente una endoprótesis es una estructura tubular que se coloca en una luz del cuerpo. Ejemplos de endoprótesis incluyen prótesis endovasculares, prótesis endovasculares recubiertas, y prótesis endovasculares de injerto.
Las endoprótesis se pueden colocar dentro del cuerpo con un catéter que sujete la endoprótesis en una forma compactada o reducida mientras la endoprótesis se transporta al sitio deseado. Después de llegar al sitio, la endoprótesis se expande, por ejemplo, para que pueda entrar en contacto con las paredes de la luz.
El mecanismo de expansión puede incluir forzar que la endoprótesis se expanda radialmente. Por ejemplo, el mecanismo de expansión puede incluir un catéter que transporta un globo, que transporta una endoprótesis globo expansible mediante globo. El globo se puede inflar para deformarse y esto asegura la endoprótesis expandida en una posición determinada en contacto con la pared luminal. A continuación el globo se puede desinflar, y el catéter se retira de la cavidad.
A veces es deseable que una endoprótesis implantada se degrade con el tiempo dentro del conducto. Por ejemplo, una endoprótesis completamente degradable no permanece en el cuerpo como objeto permanente, sino que, a su vez, puede ayudar a que el conducto recupere su estado natural. Las endoprótesis degradables pueden estar formadas de, por ejemplo, un material polimérico, como ácido poliláctico, o de un material metálico, como magnesio, hierro o una de sus aleaciones.
Por el documento US 2006/271168 se conoce una prótesis endovascular que comprende dos metales y un recubrimiento polimérico. Por el documento WO 2006/108065 se conoce un dispositivo médico implantable fabricado de materiales que presentan diferentes propiedades electroquímicas.
Resumen
La invención se refiere a endoprótesis biodegradables según una cualquiera de las reivindicaciones. Las endoprótesis pueden estar configuradas para degradarse de manera controlada y predeterminada en el cuerpo.
La endoprótesis biodegradable comprende un material relativamente electronegativo y un material relativamente electropositivo entre los que se forma una célula galvánica, y un recubrimiento para el control de la corriente eléctrica que recubre al menos una porción de la endoprótesis que es eficaz para modular la corriente o la densidad de corriente de la célula galvánica a medida que la endoprótesis se degrada.
El recubrimiento que controla la corriente eléctrica controla la exposición de al menos uno del material electronegativo y del material electropositivo a los fluidos corporales. El recubrimiento que controla la corriente eléctrica tiene un espesor, una velocidad de degradación, y/o una porosidad variables. El espesor del recubrimiento que controla la corriente eléctrica puede variar a lo largo del eje de la prótesis endovascular, por ejemplo lineal o no linealmente, por ejemplo, parabólicamente. La densidad de corriente se incrementa en función del tiempo. El recubrimiento que controla la corriente eléctrica es un polímero, un material cerámico o un metal. La endoprótesis tiene un cuerpo que comprende un material sustancialmente electronegativo. El material electropositivo se proporciona como recubrimiento del cuerpo. La endoprótesis tiene un cuerpo que incluye un material electropositivo y electronegativo, y la concentración de cada material electropositivo y electronegativo varía a lo largo de la longitud del cuerpo. La endoprótesis comprende una pluralidad de secciones que proporcionan una corriente o una densidad de corriente diferentes, cuyas secciones se extienden a lo largo de la longitud de la endoprótesis. Las secciones pueden estar sustancialmente expuestas de manera secuencial al fluido corporal a lo largo del tiempo.
Las realizaciones pueden tener una o más de las siguientes ventajas.
Una endoprótesis se degrada por corrosión galvánica, produciendo una corriente controlada para un efecto terapéutico. Puede no ser necesaria la extracción de la endoprótesis de la cavidad después de su implantación. La endoprótesis puede tener una baja trombogenicidad y una resistencia inicial elevada. La endoprótesis puede presentar una elasticidad (resorte) reducida después de su expansión. Las luces en las que se ha implantado la endoprótesis pueden presentar una reestenosis reducida. La endoprótesis puede ser degradable. La velocidad de degradación de las diferentes porciones de la endoprótesis se puede controlar, permitiendo que la endoprótesis se degrade de una manera predeterminada y reduciendo, por ejemplo, la probabilidad de una fragmentación o una embolización descontrolada. Por ejemplo, la forma de degradación predeterminada puede ser desde un primer extremo de la endoprótesis a un segundo extremo de la endoprótesis. La velocidad de degradación controlada y la manera de degradación predeterminada pueden prolongar el tiempo necesario para que la endoprótesis se degrade hasta un grado de degradación particular, pueden prolongar el tiempo que la endoprótesis puede mantener la permeabilidad del conducto en el que está implantada la endoprótesis, pueden permitir un mejor control sobre el tamaño de las partículas liberadas durante la degradación, y/o pueden permitir una mejor formación de endotelio alrededor de la endoprótesis a las células del conducto de implanta- ción.
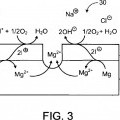
Una endoprótesis degradable o biodegradable, por ejemplo, una prótesis endovascular, se refiere a una endoprótesis, o una fracción de la misma, que presenta una reducción de masa o de densidad sustancial o una transformación química sustancial después de que se introduzca en un paciente, por ejemplo, un paciente humano. La reducción de masa se puede producir, por ejemplo, por disolución del material que forma la endoprótesis, por fragmentación de la endoprótesis, y/o por reacción galvánica. La transformación química puede incluir oxidación/reducción, hidrólisis, reacciones de sustitución y/o adición, u otras reacciones químicas del material del que está fabricado la endoprótesis, o una porción de la misma. La degradación puede ser el resultado de una interacción química y/o biológica de la endoprótesis con el entorno del cuerpo, por ejemplo, el propio cuerpo o los fluidos corporales, en donde está implantada la endoprótesis y/o la degradación se puede activar aplicando a la endoprótesis un mecanismo de acción, tal como un reactivo químico o energía, por ejemplo, para incrementar la velocidad de una reacción. Por ejemplo, una endoprótesis, o una porción de la misma, puede estar formada de un metal relativamente electronegativo (por ejemplo, magnesio, hierro) y un metal relativamente electropositivo (por ejemplo, hierro, platino), tras cuya implantación en una luz del cuerpo puede experimentar degradación galvánica. Por ejemplo, una endoprótesis, o una porción de la misma, puede estar formada de un metal activo, por ejemplo, magnesio o calcio o una de sus aleaciones, y que se puede degradar por reacción con agua, produciendo el óxido metálico correspondiente e hidrógeno gaseoso (reacción redox). Por ejemplo, una endoprótesis, o una porción de la misma, puede estar formada de un polímero degradable o biodegradable, una aleación, y/o una mezcla de polímeros degradables o biodegradables que se pueden degradar por hidrólisis con agua. La degradación se produce hasta un grado deseado en un periodo de tiempo que puede proporcionar un beneficio terapéutico. Por ejemplo, la degradación galvánica de la endoprótesis puede liberar un ión terapéutico como Mg2+, que puede modular el crecimiento celular para una mejor formación del endotelio alrededor de la endoprótesis. En algunas realizaciones, la degradación galvánica proporciona una corriente terapéutica, que se puede usar para tratar lesiones tumorales, estimular la formación de endotelio, y/o modular la proliferación celular.... [Seguir leyendo]
Reivindicaciones:
1. Una endoprótesis biodegradable, que comprende:
un material relativamente electronegativo y un material relativamente electropositivo entre los que se forma una célula galvánica, y
un recubrimiento que controla la corriente eléctrica que cubre al menos una porción de la endoprótesis que es eficaz para modular la corriente o la densidad de corriente de la célula galvánica a medida que la endoprótesis se degrada
caracterizado porque el recubrimiento que controla la corriente eléctrica tiene un espesor, una velocidad de degradación y/o una porosidad variables y controla la exposición de al menos uno del material electronegativo y el material electropositivo a los fluidos corporales.
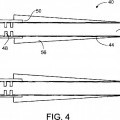
2. La endoprótesis de la reivindicación 1, en la que el espesor del recubrimiento que controla la corriente eléctrica varía a lo largo del eje de la endoprótesis.
3. La endoprótesis de la reivindicación 2, en la que el espesor del recubrimiento que controla la corriente eléctrica varía linealmente.
4. La endoprótesis de la reivindicación 2, en la que el espesor del recubrimiento que controla la corriente eléctrica varía no linealmente, y de manera opcional parabólicamente.
5. La endoprótesis de la reivindicación 1, en la que el recubrimiento que controla la corriente eléctrica es un polímero, un material cerámico o un metal.
6. La endoprótesis de la reivindicación 1, en la que la endoprótesis tiene un cuerpo que comprende un material sustancialmente electronegativo.
7. La endoprótesis de la reivindicación 6, en la que el material electropositivo se proporciona como un recubrimiento sobre el cuerpo.
8. La endoprótesis de la reivindicación 2, en la que la capa que controla la corriente eléctrica 56 es de un material que se degrada y tiene un espesor que se reduce a lo largo de la endoprótesis en función de la distancia desde el metal electropositivo.
9. La endoprótesis de la reivindicación 7, en la que la capa que controla la corriente eléctrica 56 cubre una unión 50 entre el cuerpo electronegativo y el recubrimiento electropositivo para reducir la degradación galvánica acelerada en la unión, siendo dicho recubrimiento electropositivo un recubrimiento de un metal electropositivo.
10. La endoprótesis de la reivindicación 1, en la que la endoprótesis tiene un cuerpo que incluye dicho material electropositivo y dicho material electronegativo, y la concentración de cada uno de dicho material electropositivo y dicho material electronegativo varía a lo largo de la longitud del cuerpo.
11. La endoprótesis de la reivindicación 10, en la que la endoprótesis tiene una concentración variable de metal electronegativo y metal electropositivo a lo largo de su longitud, donde opcionalmente el cuerpo está formado de una aleación o un compuesto en el que el metal electronegativo reduce gradualmente su concentración desde un extremo 64 hacia un segundo extremo 66 de la endoprótesis, mientras que el metal electropositivo puede incrementar gradualmente su concentración desde el extremo 64 al extremo 66.
12. La endoprótesis de la reivindicación 1, en la que la endoprótesis comprende una pluralidad de secciones que proporcionan una corriente o una densidad de corriente diferentes.
13. La endoprótesis de la reivindicación 12, en la que las secciones están a lo largo de la longitud de la endoprótesis.
14. La endoprótesis de la reivindicación 13, en la que las secciones se exponen sustancialmente de manera secuencial a los fluidos corporales con el paso del tiempo.
15. La endoprótesis de la reivindicación 1, en la que:
el material relativamente electronegativo incluye al menos un metal relativamente electronegativo en forma de elemento metálico sustancialmente puro, una aleación, o un compuesto, donde opcionalmente los metales electronegativos incluyen elementos metálicos tales como magnesio, hierro, cinc, y sus aleaciones;
y donde
el material relativamente electropositivo incluye al menos un metal electropositivo que incluye opcionalmente platino, oro, iridio, aluminio, acero, cinc, y/o sus aleaciones.
Patentes similares o relacionadas:
Endoprótesis híbrida helicoidal, del 22 de Julio de 2020, de MEDINOL LTD.: Componente de endoprótesis principal para formar una endoprótesis, que comprende: una sola tira que tiene una pluralidad de arrollamientos […]
Material celulósico combinado y método para producirlo y usarlo, del 15 de Julio de 2020, de ETHICON, INC.: Un material compuesto que comprende una mezcla de: (i) un primer componente en gel, de manera que el primer componente en gel contiene carboximetilcelulosa (CMC) […]
Aleaciones de magnesio de elevada resistencia y bioabsorbibles, del 24 de Junio de 2020, de THIXOMAT, INC.: Un material de magnesio microaleado para la absorción en el cuerpo de un humano o animal, donde el material de magnesio microaleado consiste en: 0,85 […]
Stent uretral, métodos y usos del mismo, del 20 de Mayo de 2020, de Association for the Advancement of Tissue Engineering and Cell Based Technologies & Therapies (A4TEC) - Associação: Stent que comprende un sustrato polimérico en la que el sustrato polimérico comprende un 10-50% (p/p) de alginato y un 45-85% (p/p) de gelatina; […]
Implante óseo, del 1 de Abril de 2020, de Attenborough Dental Laboratories Limited: Un implante para su uso en el cuerpo, caracterizándose el implante por que la conformación de al menos una parte de la superficie del implante […]
Biomaterial conductor para mejorar la conducción in vitro e in vivo, del 1 de Abril de 2020, de UNIVERSITY HEALTH NETWORK: Un material biocompatible que comprende un polímero conductor y un componente biocompatible, en donde el polímero conductor es un polímero basado en polipirrol; el componente […]
Material biocompatible que presenta un tejido de nano- o microfibras no tejidas producido por procedimiento de electrohilado, del 25 de Marzo de 2020, de SUNSTAR SUISSE SA: Material biocompatible que comprende un tejido no tejido de nano- o microfibra biocompatible producido mediante electrohilado para su uso en el tratamiento de hueso […]
Métodos y medios para ingeniería de tejidos blandos, del 19 de Febrero de 2020, de Everfill Oy: Un extracto de tejido adiposo, que comprende VEGF, FGF-2 e IGF-1, y que ha sido preparado a partir de tejido adiposo obtenido por liposucción, tejido adiposo […]