ELIMINACION DE LAS EMISIONES DE CO2 A LA ATMOSFERA, PROCEDENTES DE LACOMBUSTION DE LAS ENERGIAS FOSILES PARA COMBATIR EL CAMBIO CLIMATICO.
Deposito agua marina (2), deposito amoniaco -NH{sub,3}- (3) y deposito absorción (4).
Deposito de absorción (4) absorbe amoniaco NH{sub,3} (3) y agua marina (2), que insertamos en reactor (6). Humos enfriados deposito (5) se introducen reactor (6) produce reacción instantánea en contacto con solución agua marina y amoniaco y precipita bicarbonato sódico NaHCO{sub,3}, polvo.Disolución cloruro amónico NH{sub,4}Cl pasa instalación osmosis inversa (7) para concentración, produce agua desalada que va al deposito (11) y concentrado pasa por cámara nebulización (8) y evapora agua se recoge en condensador (10) va al deposito (11).NH{sub,4}Cl cristalizado por nebulización va a reactor, y se descompone por calor (9) en acido clorhídrico, gas y amoníaco gas.Acido clorhídrico más denso que el aire se recoge parte inferior reactor descomposición térmica (9). Amoniaco, menos denso se recoge parte superior reactor descomposición térmica (9) canalizándolo a deposito amoniaco (3).Agua desalada deposito (11) evacuada al mar
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200800089.
Solicitante: PORCAR ORTI,JAVIER.
Nacionalidad solicitante: España.
Provincia: VALENCIA.
Inventor/es: PORCAR ORTI,JAVIER.
Fecha de Solicitud: 10 de Enero de 2008.
Fecha de Publicación: .
Fecha de Concesión: 18 de Abril de 2011.
Clasificación Internacional de Patentes:
- B01D53/62 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01D SEPARACION (separación de sólidos por vía húmeda B03B, B03D, mesas o cribas neumáticas B03B, por vía seca B07; separación magnética o electrostática de materiales sólidos a partir de materiales sólidos o de fluidos, separación mediante campos eléctricos de alta tensión B03C; aparatos centrifugadores B04B; aparato de vórtice B04C; prensas en sí para exprimir los líquidos de las sustancias que los contienen B30B 9/02). › B01D 53/00 Separación de gases o de vapores; Recuperación de vapores de disolventes volátiles en los gases; Depuración química o biólogica de gases residuales, p. ej. gases de escape de los motores de combustión, humos, vapores, gases de combustión o aerosoles (recuperación de disolventes volátiles por condensación B01D 5/00; sublimación B01D 7/00; colectores refrigerados, deflectores refrigerados B01D 8/00; separación de gases difícilmente condensables o del aire por licuefacción F25J 3/00). › Oxidos de carbono.
- C01D7/18 QUIMICA; METALURGIA. › C01 QUIMICA INORGANICA. › C01D COMPUESTOS DE LOS METALES ALCALINOS, es decir, DE LITIO, SODIO, POTASIO, RUBIDIO, CESIO O FRANCIO (hidruros metálicos C01B 6/00; sales de oxácidos de halógenos C01B 11/00; peróxidos, sales de los perácidos C01B 15/00; sulfuros o polisulfuros C01B 17/22; tiosulfatos, ditionitos, politionatos C01B 17/64; compuestos que contienen selenio o teluro C01B 19/00; compuestos binarios del nitrógeno con metales C01B 21/06; azidas C01B 21/08; amidas metálicas C01B 21/092; nitritos C01B 21/50; fosfuros C01B 25/08; sales de los oxácidos del fósforo C01B 25/16; carburos C01B 32/90; compuestos que contienen silicio C01B 33/00; compuestos que contienen boro C01B 35/00; cianuros C01C 3/08; sales del ácido ciánico C01C 3/14; sales de cianamida C01C 3/16; tiocianatos C01C 3/20; procesos de fermentación o procesos que utilizan enzimas para la preparación de elementos o de compuestos inorgánicos excepto anhídrido carbónico C12P 3/00; obtención a partir de mezclas, p. ej. a partir de minerales, de compuestos metálicos que son los compuestos intermedios de un proceso metalúrgico para la obtención de un metal libre C22B; producción de elementos no metálicos o de compuestos inorgánicos por electrólisis o electroforesis C25B). › C01D 7/00 Carbonatos de sodio, potasio o metales alcalinos en general. › Preparación por el proceso de amoniaco-sosa.
Clasificación PCT:
Fragmento de la descripción:
Eliminación de las emisiones de CO2 a la atmósfera, procedentes de la combustión de las energías fósiles para combatir el cambio climático.
Antecedentes de la invención
La gran preocupación que implican las emisiones de CO2 a la atmósfera y la entrada en vigor de protocolos, como el de Kyoto, así como medidas gubernamentales en la materia encaminadas a penalizar a aquellas empresas que más CO2 emitan a la atmósfera, justifica de por sí la iniciativa de cualquier invención que sea capaz de fijar el CO2 producido industrialmente.
En este sentido, España ha tratado de cumplir los acuerdos del protocolo de Kyoto, buscando un equilibrio con miras a no disminuir el incremento de los indicadores económicos. Sin embargo dados los elevados índices de emisiones de CO2 que presenta nuestro país en los últimos años, la situación tendrá que cambiar, por lo que se tendrá que buscar alternativas a la producción industrial actual y buscar métodos para conseguir fijar el dióxido de carbono producido.
Es dentro de esta realidad, donde se encuadra la presente invención, que mediante un proceso de reacciones químicas, consigue la fijación de las emisiones de CO2 que se emiten a la atmósfera, producidos principalmente por centrales termoeléctricas y en general las emisiones de CO2 producidas por cualquier proceso industrial, de manera que los actuales sistemas de producción energética y otras actividades industriales no se vean afectados.
Objeto de la invención
El objetivo de la invención es eliminar el CO2 procedente de la emisión de humos de cualquier proceso de combustión de energías fósiles, partiendo de un proceso de reacción química realizado con el cloruro sódico -NaCl- contenido en el agua del mar y amoniaco NH3. El proceso para la eliminación del CO2, que como hemos indicado es el objeto de esta invención, se realiza mediante la utilización del cloruro sódico -NaCl- contenido en el agua del mar y amoniaco -NH3-, y se obtienen al final del mismo como subproductos, bicarbonato sódico -NaHCO3- y ácido clorhídrico -HCl-, reutilizándose el amoniaco -NH3- presente en la reacción. Así pues, la importancia medioambiental, económica y social de la invención está fuera de toda duda. Se contribuye a eliminar las emisiones de CO2 a la atmósfera atenuando los efectos del cambio climático.
Descripción de la invención
A continuación realizamos una descripción sucinta del proceso para la fijación de las emisiones de CO2. Partimos de una salida de humos de cualquier proceso tradicional de combustión, los cuales los hacemos pasar a través de un filtro de bicarbonato sódico -NaHCO3- y de un proceso de enfriamiento.
Dispondremos de un depósito de agua marina, de un deposito de amoniaco -NH3- y de un depósito de absorción.
Mediante el depósito de absorción procedemos a absorber el amoniaco NH3 y el agua de mar, creando una corriente acuosa la cual insertamos en un reactor por la parte superior de la torre. Por otro lado los humos que en su mayor parte están compuestos por CO2, ya que previamente los hemos filtrado y enfriado, los insertamos en el reactor por la parte inferior, para que vayan ascendiendo por la torre del reactor y se produzca la reacción, la cual es instantánea, en su contacto con la solución acuosa de agua de mar mezclada con amoniaco -NH3-.
Con dicha reacción conseguimos que precipite el bicarbonato de sodio -NaHCO3-, el cual lo obtendremos en forma de polvo en la parte inferior del reactor. A continuación y de forma simultanea, hacemos pasar la disolución acuosa de cloruro de amonio -NH4Cl-, por un filtro de banda, para que no arrastre restos de bicarbonato sódico -NaHCO3-.
La disolución de cloruro de amonio -NH4Cl- la hacemos pasar por una instalación de osmosis inversa para concentrar el cloruro de amonio -NH4Cl- y que sea más fácil obtener después el cloruro de amonio -NH4Cl- cristalizado. El proceso de la osmosis nos producirá agua desalada, la cual la enviaremos a un deposito de agua y posteriormente lo verteremos al mar.
La disolución acuosa de cloruro de amonio -NH4Cl- concentrado la hacemos pasar por una cámara de nebulización, para evaporar el agua por evaporación. El vapor de agua condensado, lo recogemos y llevamos al mismo deposito del agua procedente de la osmosis inversa y que posteriormente es vertida al mar.
El cloruro de amonio -NH4Cl- sólido obtenido por nebulización, lo llevamos a un reactor de descomposición térmica. En él, el cloruro de amonio -NH4Cl- que tenemos en forma cristalizada de un polvo fino blanco, se descompone por calor en ácido clorhídrico -HCl- gas y amoniaco -NH3- gas. El ácido clorhídrico -HCl- al ser más denso que el aire, lo recogeremos por la parte inferior del reactor de descomposición térmica, el cual mediante presión puede ser envasado en contenedores de acero inoxidable. El amoniaco -NH3- como es menos denso que el aire lo recogemos en la parte superior del reactor de descomposición térmica y lo canalizamos hasta el depósito de amoniaco -NH3- situado al inicio del proceso, para poder volver a ser utilizado.
Breve enunciado de la figura
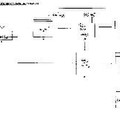
La Figura núm. 1 y única, trata de representar gráficamente el proceso utilizado para la eliminación de los humos con alto contenido en CO2, mediante la fijación de los mismos evitando así su emisión a la atmósfera. Donde (1) representa una salida de humos convencional y cuyas emisiones de CO2 van a ser tratadas con el procedimiento que presenta esta invención. El (2) es un depósito de agua de mar. El (3) es un depósito de amoniaco -NH3-. El (4) representa el depósito de absorción. El (5) es el depósito de humos portadores de CO2, enfriados a su paso por las distintas fases del proceso. El (6) es el reactor donde se produce la reacción al ser mezclados, el agua de mar procedente del depósito (2), el amoniaco -NH3-, procedente del depósito (3) y los humos con CO2 enfriados, procedentes del depósito (5). El reactor dispone en su parte inferior de una salida para la evacuación del bicarbonato sódico -NaHCO3- producido en la reacción del proceso, y el cual podrá ser tratado para otros usos industriales. El (7) es la figura que representa la instalación de osmosis inversa para concentrar la disolución acuosa de cloruro de amonio -NH4Cl- resultante después de realizar el proceso dentro del reactor (6). El (8) representa la instalación de cristalización por nebulización lateral, donde se solidifica el cloruro de amonio -NH4Cl-. El (9) es el reactor de descomposición térmica. En él, el cloruro de amonio -NH4Cl- es tratado y descompuesto en dos productos, ambos en forma gaseosa debido a la temperatura empleada. Uno es el amoniaco -NH3-, el cual vuelve al circuito hasta el almacenaje en su depósito (3) y el otro producto es el ácido clorhídrico -HCl- el cual podrá ser objeto de envasado para su comercialización. El (10) es un condensador que recoge el vapor tras su paso por las fases de cristalización por nebulización (8) y por el reactor de descomposición térmica (9). Y por último (11) representa el depósito de agua desalada procedente del proceso de osmosis inversa (7) y del agua producida en la condensación del condensador (10) y cuyo destino final es su vertido al mar.
Descripción de la forma de realización de la invención
A continuación describimos el proceso y la forma de realización de la invención.
El agua marina contenida en el depósito (2) es junto con el amoniaco -NH3- contenido en el depósito (3), absorbidos por el depósito de absorción (4) y conducidos ambos elementos hasta el reactor (6) donde son introducidos por la parte superior de la torre. Simultáneamente burbujeamos CO2 enfriado procedente del depósito (5) hasta el reactor (6) y lo introducimos por la parte inferior de la torre. Por carbonatación se nos transformarán los sulfatos en carbonatos precipitando estos y una vez han precipitado todos los carbonatos procedentes de los sulfatos, al contacto con el amoniaco -NH3-, el proceso procede ha precipitar el bicarbonato sódico -NaHCO3-. Esta reacción...
Reivindicaciones:
1. Sistema para la eliminación las emisiones de CO2 a la atmósfera, procedentes de la combustión de las energías fósiles para combatir el cambio climático, consistente en diluir en un deposito de absorción, amoniaco (NH3) con agua del mar e introducir en dicho deposito de absorción, dióxido de carbono (CO2) procedente de una salida de humos.
Dado que los iones disueltos en el agua del mar son mayoritariamente NaCl (sal común) la reacción es:
-CO2+NH3+H2O+NaCl ---- NaHCO3+NH4Cl.
El bicarbonato sódico (NaHCO3) precipita, quedando en la disolución cloruro amónico (NH4Cl).
2. Sistema para la eliminación las emisiones de CO2 a la atmósfera, procedentes de la combustión de las energías fósiles para combatir el cambio climático, según reivindicación primera, que consiste en concentrar el cloruro amónico (NH4Cl) mediante osmosis inversa, previo a la nebulización. Mediante esta se produce la cristalización del cloruro amónico.
3. Sistema para la eliminación las emisiones de CO2 a la atmósfera, procedentes de la combustión de las energías fósiles para combatir el cambio climático según reivindicaciones primera y segunda, consistente en la descomposición térmica del cloruro amónico (NH4Cl) en amoniaco en fase gaseosa y ácido clorhídrico en forma de gas. El amoniaco gas se recoge para reutilizarse en el proceso inicial. El ácido clorhídrico en gas se obtiene como subproducto del proceso.
4. Sistema para la eliminación las emisiones de CO2 a la atmósfera, procedentes de la combustión de las energías fósiles para combatir el cambio climático, según reivindicaciones primera, segunda y tercera, consistente en eliminar el dióxido de carbono (CO2) gas, fijándolo como bicarbonato sódico.
El sodio se ha obtenido del agua del mar.
Patentes similares o relacionadas:
Proceso de fabricación de carbonato sódico integrado con captación de dióxido de carbono mediante proceso de amoníaco, del 18 de Marzo de 2020, de CIECH R&D Sp. z o.o: Proceso para la producción de carbonato e hidrogenocarbonato de sodio integrado con el proceso para la captación y concentración de dióxido […]
Procedimiento para fabricar una disolución acuosa de cloruro de sodio, del 8 de Mayo de 2019, de SOLVAY SA: Un procedimiento para fabricar una disolución acuosa de cloruro de sodio, que comprende las etapas de a) dispersar en un líquido acuoso un primer […]
Procedimiento para producir amoníaco, del 13 de Abril de 2016, de SOLVAY SA: Procedimiento para producir amoníaco, que comprende las etapas de alimentar una disolución acuosa que contiene cloruro de amonio a al menos una cámara alcalina de un […]
 Utilización de desechos de desalinización, del 15 de Diciembre de 2015, de University Of South Australia: Procedimiento para producir carbonato de sodio a partir de desechos de salmuera, incluyendo dicho procedimiento hacer reaccionar los desechos de salmuera con dióxido de carbono […]
Utilización de desechos de desalinización, del 15 de Diciembre de 2015, de University Of South Australia: Procedimiento para producir carbonato de sodio a partir de desechos de salmuera, incluyendo dicho procedimiento hacer reaccionar los desechos de salmuera con dióxido de carbono […]
 DESALINIZACIÓN DEL AGUA DEL MAR POR PRECIPITACIÓN SECUENCIAL DE LAS SALES MARINAS, SIN CONSUMO ENERGÉTICO Y REUTILIZANDO REACTIVOS, del 2 de Julio de 2012, de FUNDACIÓN INVESTIGACIÓN E INNOVACIÓN PARA EL DESARROLLO SOCIAL: Desalinización del agua del mar por precipitación secuencial de las sales marinas, sin consumo energético y reutilizando reactivos.
En la fig.1 vemos como se introduce CO2 […]
DESALINIZACIÓN DEL AGUA DEL MAR POR PRECIPITACIÓN SECUENCIAL DE LAS SALES MARINAS, SIN CONSUMO ENERGÉTICO Y REUTILIZANDO REACTIVOS, del 2 de Julio de 2012, de FUNDACIÓN INVESTIGACIÓN E INNOVACIÓN PARA EL DESARROLLO SOCIAL: Desalinización del agua del mar por precipitación secuencial de las sales marinas, sin consumo energético y reutilizando reactivos.
En la fig.1 vemos como se introduce CO2 […]
MÉTODO PARA PRODUCIR UN HIDRÓXIDO DE METAL ALCALINO, del 7 de Noviembre de 2011, de ASAHI GLASS COMPANY, LIMITED: Método para producir hidróxido de sodio que comprende: a) obtener una mezcla que incluye cloruro de sodio y otra sal inorgánica soluble en agua, que incluye yoduro de […]
COMPOSICION QUE CONSTA AL MENOS DE BICARBONATO DE SODIO, SU PROCEDIMIENTO DE OBTENCION Y SUS USOS., del 16 de Agosto de 2006, de NOVACARB: LA PRESENTE INVENCION ESTA RELACIONADA CON UNA NUEVA COMPOSICION QUE CONTIENE POR LO MENOS BICARBONATO DE SODIO, CON SU PROCEDIMIENTO DE OBTENCION Y CON SUS APLICACIONES, […]
Método y sistema para la separación y purificación de metano a partir de un biogás, del 15 de Julio de 2020, de Siegel, Stanley, M: Un método para la separación y purificación de metano de un biogás, que comprende los pasos de: recolectar una corriente de biogás sin procesar, incluyendo la corriente […]