DERIVADOS FLUORADOS DE CATARANTINA, SU PREPARACIÓN Y SU UTILIZACIÓN COMO PRECURSORES DE ALCALOIDES DIMÉRICOS DE LA VINCA.
Derivados fluorados de catarantina que responden a la fórmula general I:
en la que:- la línea discontinua expresa la posibilidad de la presencia de un doble enlace cuando la sustitución -X está ausente, o también de un enlace sencillo cuando -X designa una sustitución para un grupo: • H, • OR, • NR'R'', • SR, o • un átomo de halógeno; designando R, R' y R'', independientemente entre sí, un átomo de hidrógeno o un grupo alquilo lineal o ramificado de C1 a C6, - R1, R2 y R3 representan, independientemente entre sí, un átomo de hidrógeno, flúor o un grupo metilado, con la condición de que por lo menos uno de los radicales R1 y R2 represente un átomo de flúor, y - n = 1 ó 2
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/059991.
Solicitante: PIERRE FABRE MEDICAMENT
COMMISSARIAT À L'ÉNERGIE ATOMIQUE ET AUX ÉNERGIES ALTERNATIVES.
Nacionalidad solicitante: Francia.
Dirección: 45 PLACE ABEL GANCE 92100 BOULOGNE-BILLANCOURT FRANCIA.
Inventor/es: MOISAN, LIONEL, GIOVANELLI,EMERSON, HELLIER,PAUL, DORIS,ERIC, ROUSSEAU,BERNARD, COMESSE,SEBASTIEN.
Fecha de Publicación: .
Fecha Solicitud PCT: 20 de Septiembre de 2007.
Fecha Concesión Europea: 25 de Agosto de 2010.
Clasificación Internacional de Patentes:
- C07D471/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 471/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del sistema condensado, teniendo al menos un ciclo de seis miembros con un átomo de nitrógeno, no previstos en los grupos C07D 451/00 - C07D 463/00. › en los que el sistema condensado contiene cuatro o más heterociclos.
Clasificación PCT:
- C07D471/22 C07D 471/00 […] › en los que el sistema condensado contiene cuatro o más heterociclos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Derivados fluorados de catarantina, su preparación y su utilización como precursores de alcaloides diméricos de la vinca.
La presente invención se refiere a derivados fluorados de catarantina, a su preparación y a su utilización como un precursor de alcaloides diméricos fluorados de la Vinca, y a vinflunina en particular.
Vinflunina 1 es un antineoplásico de amplio espectro desarrollado por los laboratorios Pierre Fabre. Esta molécula es un análogo fluorado de vinorelbina 5 (Navelbine®), que es el fármaco de referencia para el tratamiento de cáncer de mama y de pulmón. La estructura de vinflunina es muy similar a la de vinorelbina, de la que difiere sólo por la presencia de un grupo gem-difluorado en C20', y por la ausencia del doble enlace C3'-C4'. Vinflunina 1 (Javlor®) es el compuesto fluorado más activo descubierto a lo largo de años recientes. Actualmente está en fase III de ensayos clínicos en el tratamiento de cáncer de mama, de vejiga y de pulmón, y hoy en día se anuncia como la molécula más prometedora que se ha originado a partir de la familia de alcaloides de la Vinca.
La Vinflunina se puede preparar a partir del precursor 3',4'-anhidrovinblastina 4, que se obtiene mediante el acoplamiento de dos subunidades de catarantina 2 y vindolina 3, que se extraen directamente de las hojas de la vincapervinca de Madagascar (Diagrama 1). Como alternativa, la vinflunina se puede preparar mediante fluoración directa de vinorelbina.
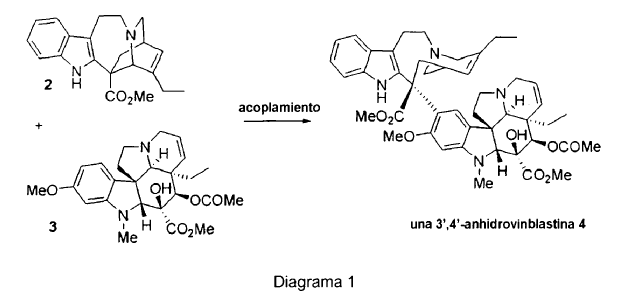
La 3',4'-anhidrovinblastina 4 se puede transformar entonces en vinorelbina 5 mediante contracción del anillo, o en vinflunina 1 mediante introducción de dos átomos de flúor en la cadena lateral del fragmento "norte", seguido de la contracción del anillo (Diagrama 2). Esta operación de fluoración tiene lugar en un medio superácido (HF-SbF5), en presencia de un disolvente clorado. Estas condiciones de reacción son particularmente drásticas, dando como resultado la degradación parcial del alcaloide dimérico 4, y de este modo una caída en el rendimiento químico global de la transformación. La gem-difluoración en C20' transcurre con reducción concomitante del doble enlace de C3'-C4'. El estereocentro formado en 4' tiene una configuración absoluta (R). La vinflunina también se puede preparar mediante fluoración de vinorelbina 5 (Navelbine®). Su síntesis se lleva a cabo mediante contracción del anillo de 3',4'-anhidrovinblastina 4.
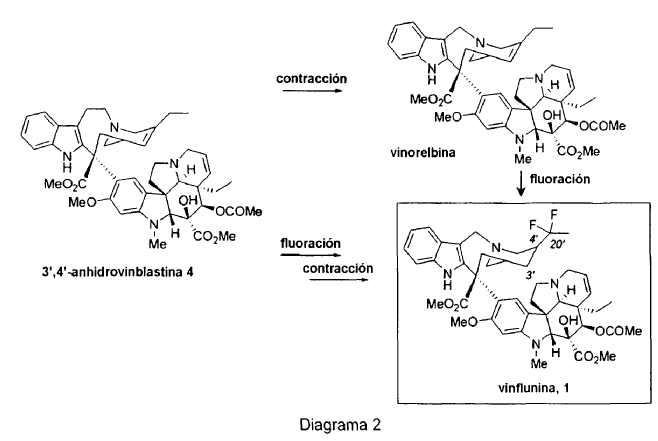
La 3',4'-anhidrovinblastina 4 es un producto con alto valor añadido. La etapa de fluoración provoca así el sacrificio de una considerable cantidad de este intermedio precioso. Esta situación es arriesgada, dando a veces como resultado un fuerte incremento en la demanda de hojas de vincapervinca. Se están estudiando varias estrategias para continuar el desarrollo de vinflunina 1.
Basándose en la observación de que la fluoración de 3',4'-anhidrovinblastina en un medio superácido modifica sólo su fragmento "norte" que se origina a partir de catarantina, dentro del alcance de la presente invención se ha abogado por una solución que consiste en introducir directamente átomos de flúor en el esqueleto de catarantina 2. Este enfoque tiene un número de ventajas: introduce flúor aguas arriba en la síntesis en un producto con un menor valor añadido que 3',4'-anhidrovinblastina 4. La síntesis de vinflunina podría ser entonces accesible vía un acoplamiento biomimético con vindolina 3. De hecho, 20',20'-difluorocatarantina 6 se puede acoplar entonces a vindolina 3 para obtener 3',4'-anhidro-20',20'-difluorovinblastina 7. Esta última se convierte finalmente en vinflunina 1, en un procedimiento familiar para el especialista, mediante reacción de contracción del anillo, seguido de la reducción del doble enlace C3'-C4' no saturado (Diagrama 3).
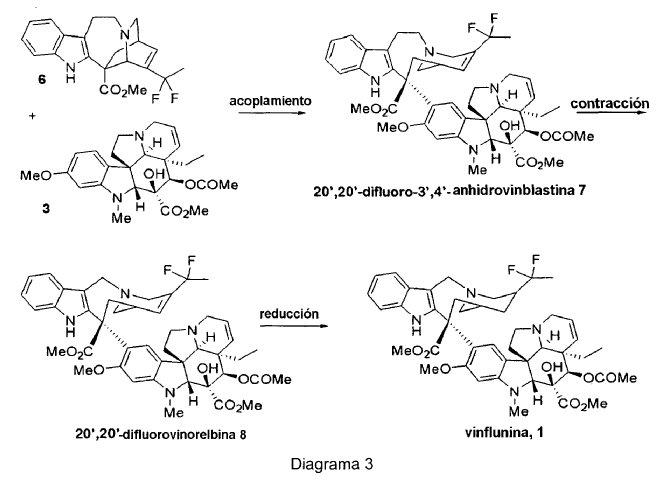
Este enfoque también permite el acceso a otros derivados fluorados originales (3',4'-anhidro-20',20'-difluorovinblastina 7, 20',20'-difluorovinorelbina 8), que no son accesibles en condiciones superácidas convencionales. Estas moléculas son todas las más interesantes, puesto que el estudio de la relación actividad/estructura ha mostrado que la región 4' y 20' de los alcaloides de la Vinca está asociada fuertemente con su actividad antitumoral. También, el acoplamiento de intermedios sintéticos (y derivados) de catarantina fluorada produce igualmente otros derivados fluorados originales de alcaloides diméricos de la Vinca.
Por lo tanto, la presente invención se refiere a derivados fluorados de catarantina que responden a la fórmula general I:
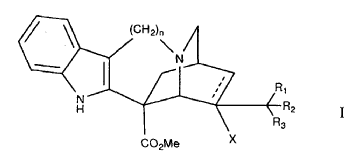
en la que:
- la línea discontinua expresa la posibilidad de la presencia de un doble enlace cuando la sustitución -X está ausente, o también de un enlace sencillo cuando -X designa una sustitución para un grupo:
- R1, R2 y R3 representan, independientemente entre sí, un átomo de hidrógeno, flúor o un grupo metilado, con la condición de que por lo menos uno de los radicales R1 y R2 represente un átomo de flúor, y
- n = 1 ó 2.
Asimismo, la presente invención se refiere a la utilización de estos derivados fluorados como intermedios sintéticos útiles para la preparación de alcaloides diméricos fluorados de la Vinca, en particular como parejas reactivas en reacciones de acoplamiento con vindolina o con un derivado de indolina. En particular, la vinflunina se obtendrá acoplando vindolina con 20,20-20,20-difluorocatarantina, dando como resultado 20',20'-difluoro-3',4'-anhidrovinblastina, la cual, a su vez, se someterá a una reacción de contracción del anillo, seguido de una reacción de reducción del doble enlace endocíclico en la posición C3'-C4'.
La introducción de los átomos de flúor en catarantina 2 se podría idear vía oxidación de la cadena lateral de catarantina y fluoración.

La preparación de los derivados fluorados de catarantina de la invención implica así una etapa de oxidación de la cadena lateral de catarantina, que se lleva a cabo en condiciones que conducen a un derivado oxidado de catarantina que responde a la fórmula general II:
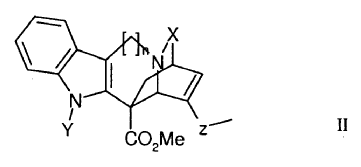
en la que:
- n = 1 ó 2,
- X designa un grupo C=O o C=S,
- Y designa un grupo CO2R, SO2R o COR, designando R un grupo arilo o un grupo alquilo lineal o ramificado de C1 a C4, y
- Z designa un grupo CH-OH o C=O.
Por lo tanto, la presente invención también se refiere a derivados oxidados de catarantina que responden a la fórmula general II:
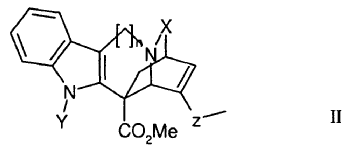
en la que:
- n = 1 ó 2,
- X designa un grupo C=O o C=S,
- Y designa un grupo CO2R, SO2R o COR, designando R un grupo arilo o un grupo alquilo lineal o ramificado de C1 a C4, y
- Z designa un grupo CH-OH o C=O.
Un derivado oxidado preferido de catarantina según la fórmula II es un derivado en el que:
- n = 2,
- X designa un grupo C=O,
- Y designa un grupo CO2R, designando R un grupo alquilo lineal o ramificado de...
Reivindicaciones:
1. Derivados fluorados de catarantina que responden a la fórmula general I:
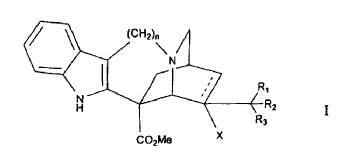
en la que:
- la línea discontinua expresa la posibilidad de la presencia de un doble enlace cuando la sustitución -X está ausente, o también de un enlace sencillo cuando -X designa una sustitución para un grupo:
- R1, R2 y R3 representan, independientemente entre sí, un átomo de hidrógeno, flúor o un grupo metilado, con la condición de que por lo menos uno de los radicales R1 y R2 represente un átomo de flúor, y
- n = 1 ó 2.
2. Derivados fluorados de catarantina según la reivindicación 1, caracterizados porque se seleccionan de entre:
- 20,20-Difluorocatarantina que corresponde a un compuesto de formula (I) en el que está presente el doble enlace en las líneas discontinuas, R1 representa un grupo metilado, R2, R3 representan, cada uno, un átomo de flúor, y n = 2,
- 20-Fluorocatarantina que corresponde a un compuesto de formula (I) en el que está presente el doble enlace en las líneas discontinuas, R1, R2 y R3 representan respectivamente un hidrógeno, un flúor y un grupo metilado, y n = 2, y
- 20,20-Difluoro-4-hidroxicatarantina que corresponde a un compuesto de formula (I) en el que está ausente el enlace en las líneas discontinuas, -X representa el grupo -OH, R1 es el grupo metilado, R2, R3 representan, cada uno, un átomo de flúor, y n = 2.
3. Utilización de un derivado fluorado de catarantina según cualquiera de las reivindicaciones 1 y 2 como un intermedio sintético útil en la preparación de alcaloides diméricos fluorados de la Vinca, y en particular vinflunina, que implica opcionalmente una reacción de acoplamiento con vindolina, o también con un derivado de vindolina.
4. Utilización según la reivindicación 3, caracterizada porque vinflunina se prepara acoplando vindolina con 20,20-difluorocatarantina, dando como resultado 20',20'-difluoro-3',4'-anhidrovinblastina, sometiéndose opcionalmente dicha 20',20'-difluoro-3',4'-anhidrovinblastina a una reacción de contracción del anillo, seguido de una reacción de reducción del doble enlace endocíclico en la posición C3'-C4'.
5. Procedimiento para la preparación de un derivado fluorado de catarantina según cualquiera de las reivindicaciones 1 y 2, caracterizado porque implica la oxidación de la cadena lateral de catarantina antes de la reacción de fluoración, tal como una oxidación alílica de la cadena lateral de catarantina en alcohol o en cetona, que es precedida por una protección de los dos átomos de nitrógeno de catarantina.
6. Procedimiento según la reivindicación 5, caracterizado porque dicha oxidación está precedida por una etapa de activación de la cadena lateral mediante isomerización del doble enlace endocíclico a la posición exocíclica mediante hidrogenación catalítica.
7. Procedimiento según la reivindicación 6, caracterizado porque dicho doble enlace exocíclico se somete a una reacción de dihidroxilación, después de la protección de los dos átomos de nitrógeno, dando como resultado la formación de un diol.
8. Procedimiento según la reivindicación 7, caracterizado porque el diol obtenido se activa en forma de un sulfato cíclico, se transforma en alcohol alílico, después se oxida a la enona correspondiente, que se somete a una reacción de difluoración, a continuación desprotección del indol y reducción del grupo amídico para dar como resultado 20,20-difluorocatarantina.
9. Procedimiento según la reivindicación 5, caracterizado porque la etapa de oxidación se lleva a cabo en condiciones que conducen a la formación de un derivado oxidado de catarantina que responde a la fórmula general II:

en la que:
- n = 1 ó 2,
- X designa un grupo C=O, o C=S,
- Y designa un grupo CO2R, SO2R o COR, designando R un grupo arilo o un grupo alquilo lineal o ramificado de C1 a C4, y
- Z designa un grupo CH-OH o C=O.
10. Derivado oxidado de catarantina que responde a la fórmula general II:
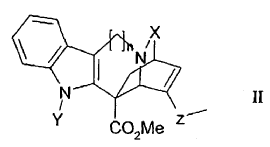
en la que:
- n = 1 ó 2,
- X designa un grupo C=O, o C=S,
- Y designa un grupo CO2R, SO2R o COR, designando R un grupo arilo o un grupo alquilo lineal o ramificado de C1 a C4, y
- Z designa un grupo CH-OH o C=O.
11. Derivado oxidado de catarantina según la formula II tal como se reivindica en la reivindicación 10, en el que
- n = 2,
- X designa un grupo C=O,
- Y designa un grupo CO2R, designando R un grupo alquilo lineal o ramificado de C1 a C4,
- Z designa un grupo CH-OH o C=O.
12. Utilización de un derivado oxidado de catarantina según cualquiera de las reivindicaciones 10 y 11 como un intermedio sintético útil en la preparación de alcaloides diméricos fluorados de la Vinca, y en particular vinflunina.
13. Utilización según la reivindicación 12, caracterizada porque la preparación del alcaloide dimérico implica una reacción de fluoración del derivado oxidado de catarantina, seguido de la desprotección de los dos átomos de nitrógeno, dando como resultado un derivado fluorado de catarantina según cualquiera de las reivindicaciones 1 a 4.
14. Utilización según la reivindicación 13, caracterizada porque la preparación del alcaloide dimérico implica además una reacción de acoplamiento entre dicho derivado fluorado de catarantina, que resulta de reacciones de fluoración y desprotección, y vindolina o un derivado de vindolina.
15. Utilización según cualquiera de las reivindicaciones 12 a 14, caracterizada porque vinflunina se prepara acoplando vindolina con 20,20-difluorocatarantina, obtenida mediante fluoración y desprotección de los dos átomos de nitrógeno del derivado oxidado de catarantina según la reivindicación 16 para la cual Z = C=O, dando como resultado 20',20'-difluoro-3',4'-anhidrovinblastina, sometiéndose opcionalmente dicha 20',20'-difluoro-3',4'-anhidrovinblastina a una reacción de contracción del anillo, seguido de una reacción de reducción del doble enlace endocíclico en la posición C3'-C4'.
16. Isocatarantina que responde a la siguiente formula (10):
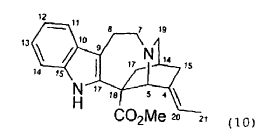
17. Utilización de un isocatarantina como un intermedio sintético útil en la preparación de alcaloides diméricos fluorados de la Vinca, y en particular vinflunina, que implica opcionalmente una reacción de acoplamiento con vindolina, o también con un derivado de vindolina.
18. Utilización según cualquiera de las reivindicaciones 16 y 17, caracterizada porque vinflunina se prepara acoplando vindolina con isocatarantina, dando como resultado 4',20'-anhidrovinblastina, sometiéndose opcionalmente dicha 4',20'-anhidrovinblastina a una reacción de contracción del anillo, seguido de una reacción de gem-difluoración, pudiéndose invertir el orden de estas dos etapas.
Patentes similares o relacionadas:
Compuestos intermedios para la preparación de compuestos de pirazolo[1,5-a]pirimidina substituidos como inhibidores de quinasas Trk, del 8 de Enero de 2020, de ARRAY BIOPHARMA, INC.: Un compuesto de Fórmula II **(Ver fórmula)** en la que: Y (es (i) fenilo opcionalmente substituido con uno o más substituyentes […]
Síntesis de alcaloides policíclicos y su uso como agonistas de TGR5, del 11 de Diciembre de 2019, de RIGEL PHARMACEUTICALS, INC.: Un compuesto que tiene una fórmula **(Ver fórmula)** en la que una línea discontinua ("---") se usa para ilustrar que un enlace […]
Compuestos de carbamoil-piridona policíclicos y su uso farmacéutico, del 7 de Agosto de 2019, de GILEAD SCIENCES, INC.: Un compuesto que tiene una de las siguientes estructuras:**Fórmula** o una sal farmacéuticamente aceptable del mismo.
Compuestos macrocíclicos como inhibidores de quinasas Trk, del 27 de Junio de 2019, de ARRAY BIOPHARMA, INC.: Un compuesto seleccionado entre el grupo que consiste en: (6R)-9-fluoro-15-hidroxi-13-oxa-2,11,17,21,22,25-5 hexaazapentaciclo[17.5.2.02,6.07,12.022,26]hexacosa- […]
(5,6-Dihidro)pirimido[4,5-e]indolizinas, del 10 de Junio de 2019, de Netherlands Translational Research Center B.V: Un compuesto de Fórmula I:**Fórmula** O una sal farmacéuticamente aceptable del mismo en el que, R1 se selecciona del grupo que consiste en:**Fórmula** […]
Compuestos tricíclicos sustituidos como inhibidores de FGFR, del 19 de Marzo de 2019, de Incyte Holdings Corporation: Un compuesto de fórmula II:**Fórmula** o una sal farmacéuticamente aceptable del mismo, en la que: W es CR17R18; X es CR15 o N; R1 es […]
Compuestos de piridazinona y usos de los mismos, del 20 de Febrero de 2019, de Janssen BioPharma, Inc: Un compuesto de fórmula (I), o una de sus sales farmacéuticamente aceptables: en la que:**Fórmula** G1 se selecciona del grupo que consiste en y R5 ; […]
Compuestos de pirazolo[1,5-a]pirimidina sustituidos como inhibidores de la Trk cinasa, del 8 de Noviembre de 2017, de ARRAY BIOPHARMA, INC.: Un compuesto que tiene la fórmula general I**Fórmula** o una sal del mismo, en donde: R1 es H o (alquilo C1-6); R2 es H, alquilo (C1-6), -fluoroalquilo […]