DERIVADOS DEL ACIDO TIENO(3,2-C)PIRIDIN-7-CARBOXILICO.
Compuestos de fórmula I:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/057748.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124,4070 BASEL.
Inventor/es: CHU, XIN-JIE, CHEN, YI, BARTKOVITZ,DAVID,JOSEPH, LUK,KIN-CHUN THOMAS.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K31/4365 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo el sistema heterociclico el azufre como heteroátomo del ciclo, p. ej. ticlopidina.
- C07D495/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 495/00 Compuestos heterocíclicos que contienen en el sistema condensado al menos un heterociclo que tiene átomos de azufre como únicos heteroátomos del ciclo. › Sistemas orto-condensados.
Clasificación PCT:
- A61K31/4365 A61K 31/00 […] › teniendo el sistema heterociclico el azufre como heteroátomo del ciclo, p. ej. ticlopidina.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07D495/04 C07D 495/00 […] › Sistemas orto-condensados.
Fragmento de la descripción:
Derivados del ácido tieno[3,2-c]piridín-7-carboxílico.
La presente invención se refiere a compuestos de fórmula:
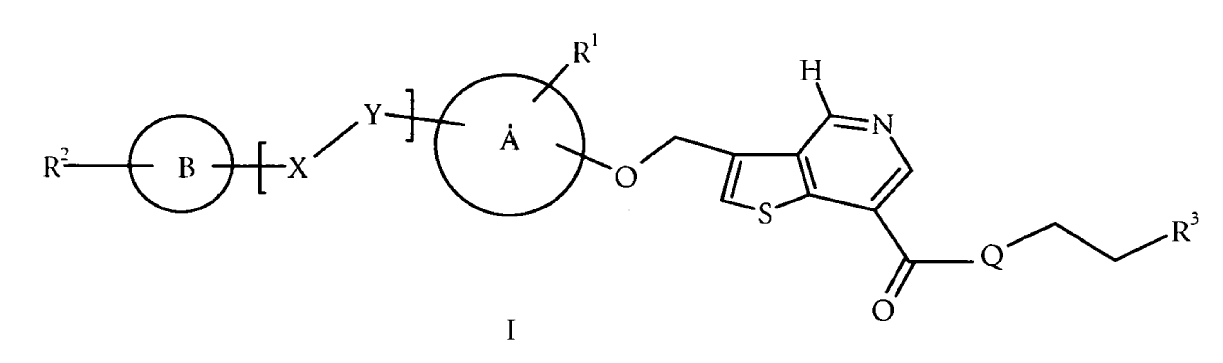
en la que R1, R2, R3, X, Y, Q, A y B son tal como se describe a continuación en la presente memoria.
Se cree que dichos compuestos inhiben las tirosina quinasas relacionadas con PDGFR o Raf, y como tales, que los compuestos presentan actividad antiangiogénica o celular antihiperproliferativa, por ejemplo anticáncer.
Muchos estados de enfermedad se caracterizan por la proliferación y diferenciación incontroladas de las células. Estos estados de enfermedad comprenden una diversidad de tipos celulares y enfermedades, tales como cáncer, ateroesclerosis y restenosis. En muchos de dichos estados de enfermedad, las quinasas, que son importantes enzimas celulares que realizan funciones esenciales mediante la regulación de la división y proliferación celulares, aparentemente desempeñan un papel decisivo.
Los mecanismos moleculares y rutas de señalización que regulan la proliferación y supervivencia celulares están recibiendo considerable atención como dianas potenciales para las estrategias anticáncer. Recientemente se ha producido un notable incremento de los esfuerzos dirigidos al reconocimiento de la ruta MAPK, que integra una amplia diversidad de señales proliferativas iniciadas por receptores tirosina quinasa (RTKs) y receptores acoplados a proteína G.
La cascada de señales de MAPK incluye la proteína G Ras cadena arriba de un módulo nuclear que consiste de 3 quinasas:fosforilatos de Raf y de esta manera activa MEK1/2, que a su vez conduce finalmente a la activación de ERK1/2. La Raf quinasa ha sido considerada desde hace mucho una diana atractiva para el descubrimiento de fármacos debido a su importancia como punto potencial de comprobación para la transducción de señales relacionada con el cáncer (Strumberg y Seeber, Onkologie 28:101-107, 2005; Beeram et al., J. Clin. Oncol. 23:6771-6790, 2005). La importancia de la cascada de señalización de MAPK para la proliferación y supervivencia de las células tumorales recientemente se ha incrementado con el descubrimiento de mutaciones activadoras de B-Raf en tumores humanos. Las mutaciones activadoras de Raf han sido identificadas en melanoma, tiroides, colon y en otros cánceres (Strumberg y Seeber, Onkologie 28:101-107, 2005; Bollag et al., Current Opinion in Investigational Drugs 4:1436-1441, 2003).
Por lo tanto, además de un papel en el control de tumores con mutaciones Ras y receptores de factor de crecimiento activados, los inhibidores de Raf quinasa podrían presentar potencial terapéutico en tumores que portan un oncogén B-Raf (Sharma et al., Cancer Res. 65:2412-2421, 2005).
La familia serina/treonina de la Raf de mamífero consiste de tres proteínas de 68 a 74 kd denominadas A-Raf, B-Raf y C-Raf (Raf-1) que comparten regiones reguladoras aminoterminales altamente conservadas y dominios catalíticos en el extremo carboxilo-terminal. Las proteínas Raf normalmente son citosólicas pero son reclutadas en la membrana plasmática por la proteína G de pequeño tamaño Ras, y ésta es una etapa esencial para su activación por parte de factores de crecimiento, citoquinas y hormonas. En la membrana, la activación de Raf se produce a través de un proceso altamente complejo que implica cambios conformacionales, la unión a otras proteínas, la unión a lípidos y la fosforilación y desfosforilación de algunos residuos.
Se ha descubierto la interferencia de una diversidad de agentes con la Raf quinasa, incluyendo los oligonucleótidos antisentido y las moléculas pequeñas. Estos inhibidores impiden la expresión de la proteína Raf, bloquean la interacción Ras/Raf u obstruyen su actividad de quinasa. La regulación negativa de la actividad de B-Raf por parte de ARNsi o a través del inhibidor de quinasa BAY-43-9006 conduce a la inhibición del crecimiento de las células de melanoma, y la reducción mediada por ARNsi de B-Raf conduce a la reducción del potencial tumorigénico de las células 1205-Lu. Los inhibidores de Raf sometidos actualmente a evaluación clínica muestran indicios prometedores de eficacia anticáncer, con un perfil de seguridad muy tolerable. El clínicamente más avanzado es el inhibidor de Raf llamado BAY 43-9006, que recientemente ha sido autorizado por la FDA para el tratamiento del carcinoma metastásico de células renales, con ensayos clínicos de fase III adicionales para el tratamiento de otros cánceres.
Además, se ha encontrado que los receptores de tirosina quinasa representan enzimas grandes que atraviesan toda la membrana celular y que presentan un dominio extracelular de unión para factores de crecimiento tales como el factor de crecimiento epidérmico, un dominio transmembranal, y una parte intracelular que funciona como quinasa, fosforilando residuos tirosina específicos en las proteínas y que por lo tanto influye sobre la proliferación celular. Las tirosina quinasas anteriormente indicadas pueden clasificarse en receptores de factores de crecimiento (por ejemplo EGFR, PDGFR, FGFR y erbB2) o quinasas no receptoras (por ejemplo c-src y bcr-abI). Es conocido que estas quinasas con frecuencia se expresan aberrantemente en cánceres humanos comunes, tales como el cáncer de mama y el cáncer gastrointestinal, por ejemplo cáncer de colon, de recto o de estómago, la leucemia, y en el cáncer ovárico, bronquial o pancreático (Roberts et al., Cancer Research 65(3):957-966, 2005; y Ho et al., J. Med. Chem. 48:8163-8173, 2005).
A pesar de los avances realizados, continúa la búsqueda de compuestos de bajo peso molecular con diana en quinasas asociadas a Raf o a PDGFR y que, por lo tanto, resulten útiles para el tratamiento de una amplia diversidad de tumores y de otros trastornos proliferativos, incluyendo restenosis, angiogénesis, retinopatía diabética, soriasis, adhesiones quirúrgicas, degeneración macular y aterosclerosis. De esta manera, existe una fuerte necesidad de proporcionar composiciones, fármacos y/o medicamentos con actividad antiproliferativa. Dichas composiciones, fármacos y/o medicamentos pueden presentar no sólo una fuerte actividad, sino que también ejercen efectos secundarios reducidos en comparación con otros agentes antiproliferativos. Además, el espectro de tumores sensibles al tratamiento con dichas composiciones, fármacos y/o medicamentos puede ser amplio. Los ingredientes de este tipo pueden resultar adecuados en la indicación mencionada en forma de agente único, y/o en terapia de combinación, sea asociadamente con otros agentes terapéuticos, con radiación, con procedimientos operatorios/quirúrgicos, tratamiento térmico o cualquier otro tratamiento conocido para las indicaciones mencionadas.
Tal como ya se ha indicado anteriormente en la presente memoria, los presentes compuestos son nuevos compuestos de fórmula:
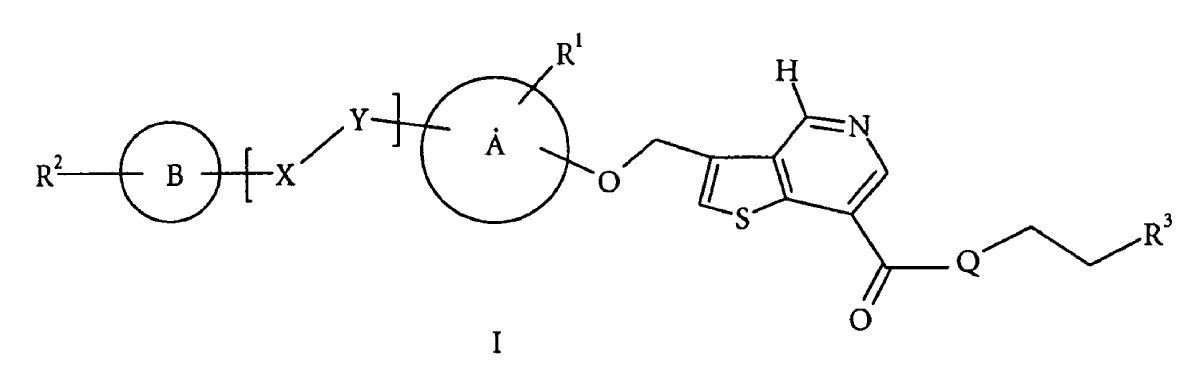
R1 se selecciona de entre el grupo que consiste de hidrógeno, alquilo C1-C6, alquenilo C2-C6, alquinilo C2-C6, alcoxi C1-C6, ciano, NR4R5, trifluorometilo y NO2,
R2 se selecciona de entre el grupo que consiste de hidrógeno, alquilo C1-C6, alquilo C1-C6 sustituido, arilo o alquilo C1-C6 heteroarilo-sustituido, alquenilo C2-C6, alquinilo C2-C6, alcoxi C1-C6, arilo, arilo sustituido, heteroarilo, heteroarilo sustituido, ciano, halógeno, NR4R5, metilsulfonilo, sulfonamida, trifluorometilo, sulfonilurea, amida, éster, carbamoilo, carbamato y urea,
R3 se selecciona de entre el grupo que consiste de hidrógeno, hidroxi, alquilo C1-C6, alquilo C1-C6 sustituido, alcoxi C1-C6 y NR4R5,
R4 y R5 se seleccionan de entre hidrógeno, alquilo C1-C6 o alquilo C1-C6 sustituido con hidroxilo o alcoxi C1-C6,
R6 es alquilo C1-C6 sustituido con hidroxilo,
Q es O o NH,
el anillo A y el anillo B son arilo, heteroarilo o heteroarilo sustituido,
Reivindicaciones:
1. Compuestos de fórmula I:
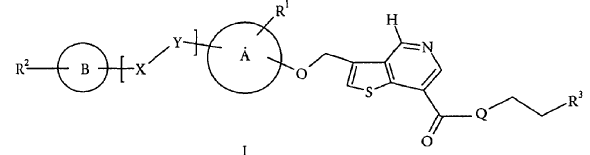
en la que:
R1 se selecciona de entre el grupo que consiste de hidrógeno, alquilo C1-C6, alquenilo C2-C6, alquinilo C2-C6, alcoxi C1-C6, ciano, NR4R5, trifluorometilo y NO2,
R2 se selecciona de entre el grupo que consiste de hidrógeno, alquilo C1-C6, alquilo C1-C6 sustituido, arilo o alquilo C1-C6 heteroarilo-sustituido, alquenilo C2-C6, alquinilo C2-C6, alcoxi C1-C6, arilo, arilo sustituido, heteroarilo, heteroarilo sustituido, ciano, halógeno, NR4R5, metilsulfonilo, sulfonamida, trifluorometilo, sulfonilurea, amida, éster, carbamoilo, carbamato y urea,
R3 se selecciona de entre el grupo que consiste de hidrógeno, hidroxi, alquilo C1-C6, alquilo C1-C6 sustituido, alcoxi C1-C6 y NR4R5,
R4 y R5 se selecciona de entre hidrógeno, alquilo C1-C6, alquilo C1-C6 sustituido con hidroxilo o alcoxi C1-C6,
R6 es alquilo C1-C6 sustituido con hidroxilo,
Q es O o NH,
los anillos A y B son arilo, heteroarilo o heteroarilo sustituido,
el línker X-Y se selecciona de entre el grupo que consiste de -OCH2-, -CH2O-, -NHCO-, -CONH-, -O-, -OCH2CH2-, -CH2OCH2-, -CH2CH2O-, -CF=CH-, -CH=CF-, -NH-, -NHCH2-, -CH2NH-, -SCH2-, -CH2S-, -SOCH2-, -CH2SO-, -SO2CH2-, -CH2SO2-, -S-, -CH=CH- y alquilo C1-C6 o X-Y puede ser un enlace sencillo,
con la condición de que, en el caso de que X-Y sea un enlace sencillo, el anillo B es un heteroarilo sustituido o no sustituido seleccionado de entre el grupo que consiste de:
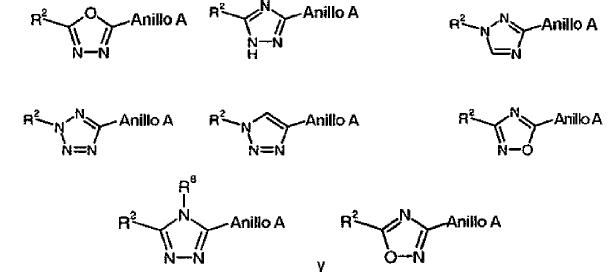
y sales farmacéuticamente aceptables de los mismos.
2. Compuestos de fórmula I según la reivindicación 1, en los que:
R1 se selecciona de entre el grupo que consiste de: alquilo C1-C6, alquenilo C2-C6, alquinilo C2-C6, alcoxi C1-C6, ciano, NR4R5, trifluorometilo y NO2,
R2 se selecciona de entre el grupo que consiste de hidrógeno, alquilo C1-C6, alquilo C1-C6 sustituido, arilo o alquilo C1-C6 heteroarilo-sustituido, alquenilo C2-C6, alquinilo C2-C6, alcoxi C1-C6, arilo, arilo sustituido, heteroarilo, heteroarilo sustituido, ciano, halógeno, NR4R5, metilsulfonilo, sulfonamida, trifluorometilo, sulfonilurea, amida, éster, carbamoilo, carbamato y urea,
R3 se selecciona de entre el grupo que consiste de hidrógeno, hidroxi, alquilo C1-C6, alquilo C1-C6 sustituido, alcoxi C1-C6 y NR4R5,
R4 y R5 se seleccionan de entre hidrógeno, alquilo C1-C6 o alquilo C1-C6 sustituido con hidroxilo o alcoxi C1-C6,
Q es O o NH,
los anillos A y B son arilo, heteroarilo o heteroarilo sustituido,
el línker X-Y se selecciona de entre el grupo que consiste de -OCH2-, -CH2O-, -NHCO-, -CONH-, -O-, -OCH2CH2-, -CH2OCH2-, -CH2CH2O-, -CF=CH-, -CH=CF-, -NH-, -NHCH2-, -CH2NH-, -SCH2-, -CH2S-, -SOCH2-, -CH2SO-, -SO2CH2-, -CH2SO2-, -S-, -CH=CH- y alquilo C1-C6 o X-Y puede ser un enlace sencillo,
con la condición de que, en el caso de que X-Y sea un enlace sencillo, el anillo B sea un heteroarilo sustituido o no sustituido seleccionado de entre el grupo que consiste de:
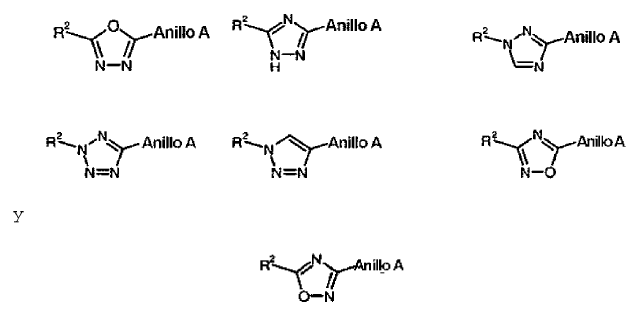
y sales farmacéuticamente aceptables de los mismos.
3. Compuestos según la reivindicación 1 ó 2, en los que el anillo A es fenilo o piridinilo.
4. Compuestos según cualquiera de las reivindicaciones 1a 3, en los que el anillo A es fenilo 2,5-disustituido.
5. Compuestos según cualquiera de las reivindicaciones 1 a 3, en los que el anillo A es piridinilo 3-hidroxi-2,5-disustituido.
6. Compuestos según cualquiera de las reivindicaciones 1 a 5, en los que R1 se selecciona de entre el grupo que consiste de -CH3, -Cl y -F.
7. Compuestos según cualquiera de las reivindicaciones 1 a 6, en los que R2 se selecciona de entre el grupo que consiste de -Cl, -F, -CF3, -CONH2, alcoxi C1-C6, NR4R5 y alquilo C1-C6.
8. Compuestos según cualquiera de las reivindicaciones 1 a 7, en los que X-Y es un enlace sencillo.
9. Compuestos según cualquiera de las reivindicaciones 1 a 8, en los que R3 se selecciona de entre el grupo que consiste de hidrógeno, hidroxi y alquilo C1-C6.
10. Compuestos según la reivindicación 1 ó 2 seleccionados de entre el grupo que consiste de:
etiléster de ácido 3-[3-(4-cloro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[3-(4-cloro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 3-(3-benzoilamino-fenoximetil)-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-(3-benzoilamino-fenoximetil)-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 3-[3-(4-fluoro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[3-(4-fluoro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-{3-[4-(2-hidroxi-etilamino)-benzoilamino]-fenoximetil}-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 3-[3-(3-cloro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 3-[3-(2-cloro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico, y
etiléster de ácido 3-[3-(2-fluoro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico.
11. Compuestos según la reivindicación 1 ó 2, seleccionados de entre el grupo que consiste de:
etiléster de ácido 3-[3-(3-metoxi-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 3-[3-(2-metoxi-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[3-(3-cloro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[3-(2-cloro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[3-(2-fluoro-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[3-(3-metoxi-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[3-(4-metoxi-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[3-(2-hidroxi-benzoilamino)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 3-[5-(3-cloro-benzoilamino)-2-metil-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico.
12. Compuestos según la reivindicación 1 ó 2 seleccionados de entre el grupo que consiste de:
(2-hidroxi-etil)-amida de ácido 3-[5-(3-cloro-benzoilamino)-2-metil-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[5-(3-cloro-benzoilamino)-2-metil-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico, sal de ácido toluen-4-sulfónico,
etiléster de ácido 3-[5-(3-fluoro-benzoilamino)-2-metil-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 3-[5-(4-fluoro-benzoilamino)-2-metil-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 3-[5-(3-metoxi-benzoilamino)-2-metil-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[5-(4-fluoro-benzoilamino)-2-metil-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
(2-hidroxi-etil)-amida de ácido 3-[5-(3-metoxi-benzoilamino)-2-metil-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 4-cloro-3-[2-metil-5-(5-metil-[1,3,4]oxadiazol-2-il)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
etiléster de ácido 3-[2-metil-5-(5-metil-[1,3,4]oxadiazol-2-il)-fenoximetil]-tieno[3,2-c]piridín-7-carboxílico,
y
(2-hidroxi-etil)-amida de ácido 3-{5-[4-(2-hidroxi-etil)-5-metil-4H-[1,2,4]triazol-3-il]-2-metilfenoximetil}-tieno[3,2-c]piridín-7-carboxílico.
13. Composición farmacéutica que comprende un compuesto de fórmula I según cualquiera de las reivindicaciones 1 a 10, conjuntamente con un excipiente farmacéuticamente aceptable.
14. Utilización de un compuesto de fórmula I según cualquiera de las reivindicaciones 1 a 10 para la preparación de un medicamento que resulta útil para el tratamiento o control de tumores sólidos, comprendiendo tumores de mama, de colon, de pulmón y de próstata.
Patentes similares o relacionadas:
Compuestos de pirimidina como inhibidores de quinasas, del 1 de Julio de 2020, de Icahn School of Medicine at Mount Sinai: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal del mismo, donde: R1 es CN, S(O)jAr1 o S(O)k(alquilen C1-6)Ar1; j es 0, 1 o 2; k es 0, 1 o 2; […]
Moduladores heteroaromáticos del receptor NMDA y usos de los mismos, del 24 de Junio de 2020, de Cadent Therapeutics, Inc: Un compuesto representado por la Fórmula I **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en el que: los anillos A y B son un sistema heteroaromático […]
Derivados de lactama, urea cíclica y carbamato y de triazolona como inhibidores potentes y selectivos de ROCK, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Fórmula (I): **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable del mismo, en donde: […]
Compuestos de piridina heterocíclicos de cinco miembros y método de preparación y uso de los mismos, del 3 de Junio de 2020, de SHANGHAI INSTITUTE OF MATERIA MEDICA, CHINESE ACADEMY OF SCIENCES: Un compuesto de piridina fusionado con heterociclo de 5 miembros que tiene una estructura de Fórmula (II), sales farmacéuticamente aceptables o solvatos […]
Derivados de 2-(pirimidin-5-il)-tiopirimidina como moduladores de Hsp70 y Hsc70 para el tratamiento de trastornos proliferativos, del 13 de Mayo de 2020, de Memorial Sloan Kettering Cancer Center: Un compuesto de la fórmula 2a **(Ver fórmula)** o un estereoisómero, tautómero o sal farmacéuticamente aceptable del mismo, en donde: […]
Inhibidores de EZH2 (potenciador del homólogo Zeste 2), del 13 de Mayo de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto según la Fórmula (I) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la que: representa un enlace sencillo […]
Compuestos herbicidas, del 13 de Mayo de 2020, de SYNGENTA PARTICIPATIONS AG: Un compuesto de Fórmula (I) **(Ver fórmula)** o una sal o N-óxido del mismo; en donde A1 es CR1 o N; R1 es hidrógeno, alquilo C1- C4, haloalquilo C1-C4, alcoxi […]
Compuestos de tienopirrol y usos de los mismos como inhibidores de luciferasas procedentes de Oplophorus, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un compuesto de fórmula (I), o una sal del mismo: **(Ver fórmula)** en la que: la línea discontinua representa la presencia o ausencia de un enlace; X es […]