COPOLIMEROS ACRILICOS HIDROFILOS DERIVADOS DE EUGENOL, PREPARACION, CARACTERIZACION Y SU USO COMO LENTES OFTALMICAS.
Copolímeros acrílicos hidrófilos derivados de eugenol, preparación,
caracterización y su uso como lentes oftálmicas.La presente invención describe la síntesis de copolímeros hidrófilos a partir de monómeros acrílicos derivados de Eugenol y monómeros acrílicos hidrófilos, así como su aplicación en el desarrollo de lentes oftálmicas, y particularmente de lentes intraoculares (LIO), acrílicas y flexibles, que se pueden insertar a través de pequeñas incisiones. Estos sistemas presentan un elevado índice de refracción, por tanto las lentes intraoculares moldeadas a partir de ellos se pueden hacer más delgadas o reducir su diámetro con relación a las lentes intraoculares flexibles conocidas, permitiendo disminuir la incisión necesaria para la implantación de la misma. Además, estos sistemas presentan propiedades antisépticas provenientes de la molécula de Eugenol anclada químicamente a las cadenas macromoleculares
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200801479.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: SAN ROMAN DEL BARRIO,JULIO, VAZQUEZ LASA,BLANCA, ROJO DEL OLMO,LUIS, PARRA RUIZ,FCO. JESUS.
Fecha de Solicitud: 21 de Mayo de 2008.
Fecha de Publicación: .
Fecha de Concesión: 14 de Abril de 2011.
Clasificación Internacional de Patentes:
- A61F2/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › A61F 2/00 Filtros implantables en los vasos sanguíneos; Prótesis, es decir, elementos de sustitución o de reemplazo para partes del cuerpo; Dispositivos para unirlas al cuerpo; Dispositivos para proporcionar permeabilidad o para evitar que colapsen las estructuras tubulares del cuerpo, p. ej. stents (como artículos cosméticos, ver las subclases apropiadas, p. ej. pelucas o postizos, A41G 3/00, A41G 5/00, uñas artificiales A45D 31/00; prótesis dentales A61C 13/00; materiales para prótesis A61L 27/00; riñones artificiales A61M 1/14; corazones artificiales A61M 60/00). › Lentes intraoculares.
- A61L31/04 A61 […] › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 31/00 Materiales para otros artículos quirúrgicos. › Materiales macromoleculares.
- C07C43/215 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 43/00 Eteres; Compuestos que tienen grupos, grupos o grupos. › con una insaturación distinta a la de los ciclos aromáticos de seis miembros.
- C08F220/06 C […] › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08F COMPUESTOS MACROMOLECULARES OBTENIDOS POR REACCIONES QUE IMPLICAN UNICAMENTE ENLACES INSATURADOS CARBONO - CARBONO (producción de mezclas de hidrocarburos líquidos a partir de hidrocarburos de número reducido de átomos de carbono, p. ej. por oligomerización, C10G 50/00; Procesos de fermentación o procesos que utilizan enzimas para la síntesis de un compuesto químico dado o de una composición dada, o para la separación de isómeros ópticos a partir de una mezcla racémica C12P; polimerización por injerto de monómeros, que contienen uniones insaturadas carbono-carbono, sobre fibras, hilos, hilados, tejidos o artículos fibrosos hechos de estas materias D06M 14/00). › C08F 220/00 Copolímeros de compuestos que tienen uno o más radicales alifáticos insaturados, teniendo solamente cada uno un enlace doble carbono-carbono, y estando solamente terminado por un radical carboxi o una sal, anhídrido, éster, amida, imida o nitrilo del mismo. › Acido acrílico; Acido metacrílico; Sus sales metálicas o de amonio.
Clasificación PCT:
- A61F2/16 A61F 2/00 […] › Lentes intraoculares.
- A61L31/04 A61L 31/00 […] › Materiales macromoleculares.
- C07C43/215 C07C 43/00 […] › con una insaturación distinta a la de los ciclos aromáticos de seis miembros.
- C08F220/06 C08F 220/00 […] › Acido acrílico; Acido metacrílico; Sus sales metálicas o de amonio.
PDF original: ES-2340241_A1.pdf
Fragmento de la descripción:
Copolímeros acrílicos hidrófilos derivados de eugenol, preparación, caracterización y su uso como lentes oftálmicas.
Sector de la técnica
Esta invención se enmarca dentro de la preparación de formulaciones adecuadas para su uso en lentes oftálmicas, particularmente para la fabricación de lentes intraoculares (LIO) que se utilizan en cirugía mínimamente invasiva para el tratamiento de cataratas.
Estado de la técnica
La cirugía de cataratas consiste en la eliminación del cristalino cuando éste se vuelve parcialmente opaco o pierde flexibilidad con la edad y es una de las operaciones más comunes en los países desarrollados en personas mayores de 65 años, operación que habitualmente se combina con la implantación de lentes intraoculares (LIO). La implantación de la lente permite restablecer las capacidades refractivas del ojo.
Las primeras lentes intraoculares se implantaron en un ojo humano en el año 1949 en Estados Unidos por el oftalmólogo británico Harold Ridley y eran lentes rígidas de poli(metacrilato de metilo) (PMMA). Desde finales de los años 70, cuando la implantación de estas lentes se perfeccionó debido a una mejora en la tecnología, se puede decir que aproximadamente se han implantado unos 10 millones de LIO de PMMA en todo el mundo.
Desde los comienzos de la implantación de lentes intraoculares (LIO) se ha producido un desarrollo paralelo entre los diferentes materiales empleados y la técnica y tecnología quirúrgicas. Así, el desarrollo de materiales blandos y flexibles ha hecho posible la utilización de técnicas de cirugía ocular de mínima invasión, lo que ha hecho posible retirar y sustituir las lentes naturales dañadas a través de incisiones tan pequeñas como 2-3 mm en comparación con los primeros métodos empleados en los que se necesitaba realizar incisiones de 9-10 mm. Debido a que la cirugía con pequeñas incisiones (cirugía de mínima invasión) es menos traumática para los pacientes y disminuye las complicaciones y el tiempo de curación, esta técnica se ha convertido en la favorita para los cirujanos oftalmólogos.
En cuanto a los materiales empleados en la fabricación de lentes deformables se han desarrollado dos tipos principales: lentes a base de elastómeros de silicona y lentes a base de polímeros acrílicos flexibles. En este último tipo, las lentes tienen como componente mayoritario el poli(metacrilato de 2-hidroxietilo) (PHEMA) que aporta hidrofilia y características de hidrogel, y un comonómero que contiene una cadena lateral larga que le confiere flexibilidad. La composición del hidrogel debe de ser tal que cumpla una serie de requisitos como son, un adecuado contenido en agua, que sea transparente e incoloro, que tenga un alto índice de refracción y que éste se mantenga en el tiempo, propiedades que dependen únicamente del material del que están hechas las lentes. Puesto que la mayoría de los hidrogeles son copolímeros, la selección de los comonómeros es esencial para tener unas prestaciones adecuadas. Por ejemplo, la utilización de comonómeros hidrófobos reduce la cantidad de agua que puede absorber el hidrogel lo que puede causar separación de microfases una vez implantada la lente y volverse parcialmente translúcida. En cambio la utilización de comonómeros hidrófilos tiene ventajas sobre los anteriores en cuanto al contenido en agua que puede absorber la lente y la transparencia de la misma.
Para que un polímero pueda ser implantado como lente intraocular debe tener al menos un contenido en agua del 20-25%, cantidad mínima de agua con la cual no se producirá la adhesión de células epiteliales en la superficie de la lente, aunque materiales con un menor contenido en agua son aptos para ser utilizados como lentes intraoculares fáquicas, aquellas que se colocan entre la córnea y por encima del iris, ya que en este caso la lente no estará expuesta a células epiteliales.
Un aspecto importante a tener en cuenta es el índice de refracción de la lente. Se ha encontrado que para corregir defectos oculares de más de 25 dioptrías con lentes de 6 mm los hidrogeles poliméricos deben tener índices de refracción de al menos 1,53 en estado seco. El índice de refracción en el interior del ojo es de 1,33 y cualquier incremento en su valor en el rango de centésimas, se puede traducir en una apreciable disminución en el grosor de la nueva lente, por lo que la incisión necesaria para implantarla disminuye, esto es, cada centésima de aumento en el índice de refracción disminuye un 5% el grosor del centro de la lente. Debido a que el índice de refracción del ojo es 1,33, la adición de agua a un polímero o copolímero acrílico disminuye el índice de refracción del mismo en comparación con su estado deshidratado. Por esta razón el índice de refracción de un polímero es inversamente proporcional al contenido en agua del mismo, hecho que hace que para maximizar el contenido en agua y el índice de refracción de los hidrogeles se combinen comonómeros hidrófilos con comonómeros de alto índice de refracción, sean hidrófilos o no. Monómeros que contienen grupos aromáticos, átomos de azufre y halógenos dan lugar a polímeros con un alto índice de refracción.
Ejemplos de comonómeros hidrófobos de alto índice de refracción que se han utilizado en la preparación de lentes intraoculares son metacrilatos con grupos aromáticos (Patente estadounidense nº 5693095) que dan lugar a copolímeros con un índice de refracción de 1,53 en estado hidratado o metacrilatos con grupos etenilaromáticos (Patente estadounidense nº 2007010883) que dan lugar a copolímeros con un índice de refracción de 1,52 a 1,55 una vez hidratado. También se han empleado comonómeros hidrófobos aromáticos derivados de anilina, bencilamina, fenol, fenilmetanol, feniletanol, naftol, bencilmercaptano y feniletilmercaptano (Patente estadounidense nº 2002037984) que dan lugar a copolímeros con un índice de refracción de 1,46 a 1,52 en estado seco, así como comonómeros hidrófobos derivados del fenol y del tiofenol (Patente WO 2007062864) y los derivados del fenoxietanol y del tiofenoxietanol (Patente WO 2007094664).
Ejemplos de comonómeros hidrófilos de alto índice de refracción que se han utilizado en la preparación de lentes intraoculares blandas son los derivados del feniletanol funcionalizado en la posición para del anillo aromático (Patente WO 2006130402), los derivados de N-bencil-N-metilacrilamida (Patente estadounidense nº 5717049) que dan lugar a copolímeros que tienen un índice de refracción de 1,42 a 1,49 en estado hidratado. En la patente estadounidense nº 5480950 se describe la utilización de comonómeros hidrófilos de N-vinilpirrolidona y 2, 3, o 4-vinilpiridina junto con ésteres diacrílicos, que dan lugar a copolímeros que tienen un índice de refracción de 1.42 a 1.49 en estado hidratado, y en la patente estadounidense nº 5439950 la utilización de comonómeros vinílicos hidrófilos de heterociclos tales como 4,6-divinilpirimidina, 2,5-divinilpirazina, 1,4 y 1,5-divinilimidazol que dan copolímeros que tienen un índice de refracción de 1.40 a 1.60 en estado hidratado.
Descripción de la invención
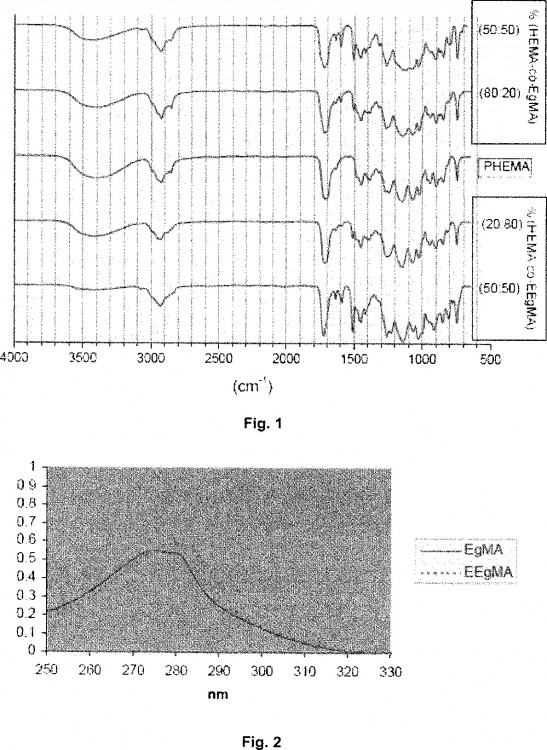
Un aspecto de la presente invención lo constituye un copolímero acrílico hidrófilo derivado de Eugenol, que comprende un monómero o mezclas de monómeros acrílicos derivados de Eugenol, como son el metacrilato de Eugenilo (EgMA) y el metacrilato de etoxieugenilo (EEgMA) y un monómero o mezclas de monómeros hidrófilos acrílicos.
Un aspecto preferente de la presente invención lo constituye el copolímero de la invención sintetizado en presencia de un agente de entrecruzamiento, como son los dimetacrilatos o diacrilatos de etilenglicol de diferente longitud de cadena.
Otro aspecto preferente de la invención lo constituye un copolímero de la invención que incluye una cierta cantidad de un agente de absorción UV, como benzofenonas sustituidas y benzotriazoles.
Otro aspecto de la invención lo constituye el procedimiento de obtención del copolímero de la invención.
Otro aspecto de la presente invención es el uso del copolímero de la invención para la elaboración de lentes oftálmicas intraoculares.
La presente invención está relacionada con la síntesis de copolímeros hidrófilos a partir de monómeros acrílicos derivados de Eugenol (Patente española nº P200600347: Rojo L, Vázquez B, San Román J, Deb S. 2006. "Monómeros... [Seguir leyendo]
Reivindicaciones:
1. Copolímero acrílico hidrófilo derivado de Eugenol caracterizado porque comprende uno o varios monómeros acrílicos derivados de Eugenol y uno o varios monómeros acrílicos hidrófilos.
2. Copolímero acrílico hidrófilo derivado de Eugenol según reivindicación 1 caracterizado porque los monómeros acrílicos derivados de Eugenol son metacrilato de etoxieugenilo (EEgMA) y metacrilato de eugenilo (EgMA).
3. Copolímero acrílico hidrófilo derivado de Eugenol según reivindicación 1 caracterizado porque los monómeros acrílicos hidrófilos pueden ser: acrilatos y metacrilatos de hidroxialquilo y acrilatos o metacrilatos de polietilenglicol y mezclas de los mismos.
4. Copolímero acrílico hidrófilo derivado de Eugenol según reivindicación 3 caracterizado porque el monómero acrílico hidrófilo es el metacrilato de 2- hidroxietilo (HEMA).
5. Copolímero acrílico hidrófilo derivado de Eugenol según reivindicaciones 2 y 4 caracterizado por ser: copolímero de metacrilato de eugenilo-metacrilato de 2-hidroxietilo (EgMA/HEMA).
6. Copolímero acrílico hidrófilo derivado de Eugenol según reivindicaciones 2 y 4 caracterizado por ser: copolímero de metacrilato de etoxieugenilo-metacrilato de 2-hidroxietilo (EEgMA/HEMA).
7. Copolímero acrílico hidrófilo derivado de Eugenol según reivindicación 1 caracterizado porque el copolímero también puede incluir un agente de entrecruzamiento.
8. Copolímero acrílico hidrófilo derivado de Eugenol según reivindicación 7 caracterizado porque el agente de entrecruzamiento puede ser dimetacrilato o acrilato de polietilenglicol de diferente longitud de cadena.
9. Copolímero acrílico hidrófilo derivado de Eugenol según reivindicación 1 caracterizado porque el copolímero también incluye un agente de absorción de UV que puede ser de las familias de benzofenonas o benzotriazoles.
10. Copolímero acrílico hidrófilo derivado de Eugenol según reivindicaciones 9 caracterizado porque el agente de absorción UV es un compuesto polimerizable, como el 2-[3-(2H-benzotriazol-2-il)-4-hidroxifenil]etil metacrilato.
11. Procedimiento de obtención del copolímero acrílico hidrófilo según reivindicaciones anteriores que comprende las siguientes etapas:
y está caracterizado porque los monómeros utilizados en i) son monómeros acrílicos derivados de Eugenol y monómeros acrílicos hidrófilos.
12. Procedimiento de obtención del copolímero acrílico hidrófilo según reivindicación 11 caracterizado porque los componentes que se mezclan en i) son monómeros derivados de Eugenol en una cantidad comprendida entre un 10-40%-p, en peso, monómeros hidrófilos acrílicos en una cantidad comprendida entre un 60-90%-p, agentes de entrecruzamiento en una cantidad comprendida entre 0-15%-p y agentes de absorción UV en una cantidad comprendida entre 0,1-5%-p.
13. Procedimiento de obtención del copolímero acrílico hidrófilo según reivindicación 11 caracterizado porque el iniciador de polimerización radical es el azobis-isobutironitrilo, AIBN, en una proporción entre 0,5 y 2%-p.
14. Procedimiento de obtención del copolímero acrílico hidrófilo según reivindicación 11 caracterizado porque en ii) la mezcla de reacción se desoxigena con corriente de nitrógeno.
15. Procedimiento de obtención del copolímero acrílico hidrófilo según reivindicación 11 caracterizado porque en iii) el tratamiento térmico es de 60- 80ºC. durante 48-72 horas.
16. Procedimiento de obtención del copolímero acrílico hidrófilo según reivindicación 11 caracterizado porque en iv) el lavado se realiza con hexano.
17. Procedimiento de obtención del copolímero acrílico hidrófilo según reivindicación 11 caracterizado porque una alternativa a iv) sería realizar un post-curado sometiendo al material a una temperatura entre 60-80ºC durante un tiempo entre 48-96 horas.
18. Uso del copolímero acrílico hidrófilo derivado de Eugenol según reivindicaciones anteriores, en la fabricación de lentes oftálmicas.
19. Uso del copolímero acrílico hidrófilo derivado de Eugenol según la reivindicación 15, en el que las lentes oftálmicas fabricadas son intraoculares y se implantan en el tratamiento de cataratas con cirugía mínimamente invasiva.
Patentes similares o relacionadas:
Lente intraocular con sectores ópticos activos adicionales superpuestos parcialmente en lados opuestos, del 22 de Julio de 2020, de Oculentis Holding B.V: Lente intraocular que comprende un elemento óptico , donde el elemento óptico tiene un primer y un segundo lados y que comprende: […]
Dispositivo intraocular con electrónica auxiliar acoplada de forma inalámbrica, del 8 de Julio de 2020, de Verily Life Sciences LLC: Un sistema oftálmico , que comprende: una lente intraocular para ayudar a un ojo en materia de acomodación, incluyendo la lente intraocular una primera […]
Sistema de lentes intraoculares para implantación en una cápsula de cristalino de un ojo de un ser humano o animal, del 24 de Junio de 2020, de Sharpsight B.V: Un sistema de lentes intraoculares (1, 1') para implantación en una cápsula del cristalino de un ojo de cuerpo humano o animal, teniendo […]
Lente artificial multifocal variable, del 17 de Junio de 2020, de Vision Pro (Wuxi) Ltd: Lente intraocular multifocal acomodativa, que comprende un cuerpo óptico , dos hápticos y dos elementos de conexión de silicona , estando situados los elementos […]
Control de inyectores de lentes intraoculares automatizados, del 15 de Abril de 2020, de ALCON, INC: Sistema para la implantación de una lente intraocular en una cápsula de lente de un ojo para el de una afección ocular, comprendiendo el sistema: […]
Copolímero acrílico, hidrófobo, reticulado, a base de alcohol cinámico, para lentes intraoculares, del 8 de Abril de 2020, de Acrylian: Material polimérico acrílico, hidrófobo, es decir, que no absorbe más del 5 % de agua a 35 °C, adecuado para hacer lentes intraoculares flexibles, […]
Lente trifocal difractiva, del 8 de Abril de 2020, de THE ARIZONA BOARD OF REGENTS, ON BEHALF OF THE UNIVERSITY OF ARIZONA: Una lente multifocal difractiva que comprende un elemento óptico que tiene una primera superficie óptica difractiva que tiene un perfil […]
Lente intraocular hidrófoba, del 8 de Abril de 2020, de BENZ RESEARCH AND DEVELOPMENT CORPORATION: Una composición que comprende al menos un copolímero que comprende: (a) una primera subunidad monomérica que comprende un acrilato de 2-hidroxi-3-fenoxipropilo polimerizado, […]