COMPUESTOS INTERMEDIARIOS UTILES EN LA PREPARACION DE TRANS-5-CLORO-2-METIL-2,3,3A,12B-TETRAHIDRO-1H-DIBENZO(2,3:6,7)OXEPINO(4,5-C)PIRROL.
Un derivado de trans-aminoácido de fórmula I o fórmula II, **(Ver fórmula)** o el enantiómero de cada derivado de trans-aminoácido que tiene la configuración absoluta opuesta,
o una mezcla racémica de cada derivado de trans-aminoácido, o una sal de los mismos
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06112333.
Solicitante: ORGANON IRELAND LTD.
PFIZER INC.
Nacionalidad solicitante: Irlanda.
Dirección: DRYNAM ROAD, SWORDS CO.,DUBLIN.
Inventor/es: REEDER,MICHAEL,R, KEMPERMAN,GERARDUS,JOHANNES, VAN DER LINDEN,JACOBUS JOHANNES MARIA.
Fecha de Publicación: .
Fecha Solicitud PCT: 6 de Abril de 2006.
Fecha Concesión Europea: 4 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- C07D313/14 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 313/00 Compuestos heterocíclicos que contienen ciclos de más de seis miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › [b, f]-condensados.
- C07D491/04 C07D […] › C07D 491/00 Compuestos heterocíclicos que contienen en el sistema cíclico condensado, a la vez uno o más ciclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo, y uno o más ciclos que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, no previstos en los grupos C07D 451/00 - C07D 459/00, C07D 463/00, C07D 477/00 ó C07D 489/00. › Sistemas orto-condensados.
Clasificación PCT:
- C07D313/14 C07D 313/00 […] › [b, f]-condensados.
- C07D491/04 C07D 491/00 […] › Sistemas orto-condensados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Compuestos intermediarios útiles en la preparación de trans-5-cloro-2-metil-2,3,3a,12b-tetrahidro-1H-dibenzo[2,3:6,7]oxepino[4,5-c]pirrol.
Esta invención se relaciona con nuevos derivados de aminoácidos, con procedimientos para su preparación y con el uso de los derivados de aminoácidos en la preparación de trans-5-cloro-2-metil-2,3,3a,12b-tetrahidro-1H-dibenz-[2,3:6,7]oxepino[4,5-c]pirrol.
El trans-5-cloro-2-metil-2,3,3a,12b-tetrahidro-1H-dibenz[2,3:6,7]oxepino[4,5-c]pirrol, que es comúnmente conocido como asenapina, es un compuesto que tiene actividad depresora del SNC y que tiene actividades antihistamínicas y antiserotonínicas (véase la Patente EE.UU. Nº 4.145.434 de van den Burg). Se ha revisado el perfil farmacológico de la asenapina, su cinética y metabolismo y los primeros estudios de seguridad y eficacia en voluntarios humanos y en pacientes esquizofrénicos (véase De Boer y col., Drugs of the Future, 18(12), 1117-1123, 1993). Se ha establecido que la sal maleato de la asenapina, conocida como Org 5222, es un antagonista de la serotonina, de la noradrenalina y de la dopamina de alta potencia y amplio espectro. La asenapina exhibe una actividad antipsicótica potencial y puede ser útil en el tratamiento de la depresión (véase la solicitud de patente internacional WO 99/32108). Se ha descrito una preparación farmacéutica adecuada para administración sublingual o bucal de maleato de asenapina (véase la solicitud de patente internacional WO 95/23600). El maleato de asenapina es ahora objeto de estudios clínicos, que hacen necesarias síntesis a gran escala de la substancia farmacológica.
Se describe una metodología general para la preparación de asenapina en la Patente EE.UU. Nº 4.145.434. Se han descrito las propiedades fisicoquímicas de la substancia farmacológica, Org 5222, (Funke y col., Arzneim.-Forsch/Drug.Res., 40, 536-539, 1990). También se han descrito métodos sintéticos adicionales para la preparación de Org 5222 y derivados de radiomarcados de la misma (Vader y col., J. Labelled Comp. Radiopharm., 34, 845-869, 1994).
Las últimas etapas de un procedimiento conocido para la preparación de asenapina (A) están representadas en el Esquema I. En este procedimiento, se reduce el doble enlace de la enamida, 11-cloro-2,3-dihidro-2-metil-1H-dibenz[2,3;6,7]oxepino[4,5-c]pirrol-1-ona (III), por tratamiento con magnesio en metanol/tolueno para producir una mezcla de un isómero trans deseado, trans-11-cloro-2,3,3a,12b-tetrahidro-2-metil-1H-dibenz[2,3:6,7]-oxepino[4,5-c]pirrol-1-ona (IV), y un isómero cis no deseado, cis-11-cloro-2,3,3a,12b-tetrahidro-2-metil-1H-dibenz[2,3:6,7]-oxepino[4,5-c]pirrol-1-ona (V), en una proporción de 1:4.
Esquema I
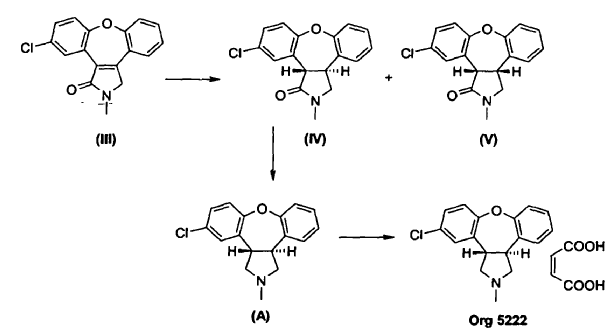
Como se muestra en el Esquema II, se puede mejorar la desfavorable razón de productos por posterior isomerización parcial del isómero cis no deseado (V) al isómero trans (IV) usando 1,5-diazabiciclo[4.3.0]non-5-eno (DBN), que da lugar a una razón de equilibrio termodinámico de isómero trans (IV) a isómero cis (V) de 1:2. La separación del isómero trans (IV) y del isómero cis (V) es realizada por cromatografía en gel de sílice. Se puede isomerizar el isómero cis (V) de nuevo usando DBN, para dar como resultado una mezcla 1:2 de compuesto (IV) y compuesto (V), de la que se separa de nuevo el isómero trans (IV) por cromatografía. Después de repetir este ciclo a escala de kg, la recristalización de las tres fracciones combinadas del isómero trans (IV) produce trans-11-cloro-2,3,3a,12b-tetrahidro-2-metil-1H-dibenz-[2,3:6,7]oxepino[4,5-c]pirrol-1-ona (IV) con un rendimiento global de aproximadamente un 38% partiendo de la enamida (III).
Esquema II
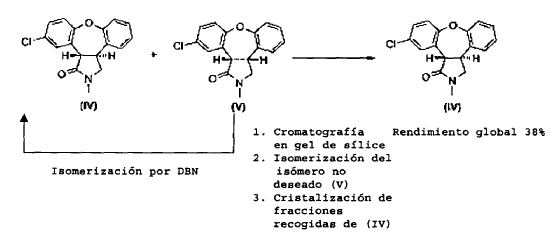
El inconveniente del procedimiento antes descrito es que es extremadamente elaborado y prolongado, mientras que el rendimiento final del compuesto trans (IV) es sólo moderado. Por lo tanto, se necesita un procedimiento mejorado para la preparación del isómero trans (IV).
En toda esta descripción, los compuestos representados por fórmulas estructurales que tienen un par de enlaces en cuña continua y discontinua, como se muestra, v.g., en el compuesto (IV) del Esquema I, o un par de enlaces en cuña continua, como se muestra, v.g., en el compuesto (V) del Esquema I, se refieren a diastereoisómeros "trans" o "cis", respectivamente. Cada uno de los compuestos puede existir como un solo enantiómero con la configuración estereoquímica absoluta indicada por los enlaces en cuña, o con la configuración absoluta opuesta, o como una mezcla de enantiómeros (v.g., racemato) con la configuración estereoquímica relativa indicada por los enlaces en cuña.
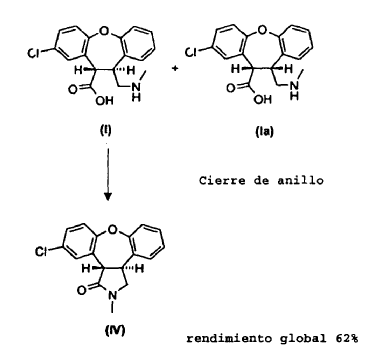
La presente invención proporciona un procedimiento (Esquema III) en el cual se trata la mezcla de lactamas, trans-11-cloro-2,3,3a,12b-tetrahidro-2-metil-1H-dibenz[2,3:6,7]oxepino[4,5-c]pirrol-1-ona (IV) y cis-11-cloro-2,3,3a,12b-tetrahidro-2-metil-1H-dibenz-[2,3:6,7]oxepino[4,5-c]pirrol-1-ona (V), en una solución alcohólica que contiene un exceso de base alcalina fuerte, produciendo así una mezcla de ácido trans-8-cloro-10,11-dihidro-11-[(metilamino)metil]dibenz[b,f]oxepin-10-carboxílico (I) y ácido cis-8-cloro-10,11-dihidro-11-[(metilamino)metil]dibenz[b,f]oxepin-10-carboxílico (Ia). La reacción de apertura de anillo es estereoselectiva, dando lugar a una razón 10:1 del isómero trans (I) con respecto al isómero cis (Ia). Se aísla y cicla a continuación el derivado de trans-aminoácido (I) para obtener trans-11-cloro-2,3,3a,12b-tetrahidro-2-metil-1H-dibenz-[2,3:6,7]oxepino[4,5-c]pirrol-1-ona (IV) con conservación de la estereoquímica trans. Partiendo del derivado de enamida (III), el rendimiento del isómero trans (IV) es de aproximadamente el 62%.
Esquema III
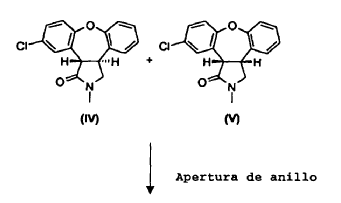
El material de partida para la reacción de apertura de anillo puede ser una mezcla del isómero trans (IV) y el isómero cis (V). Alternativamente, el material de partida puede ser el isómero cis (V) puro. Se puede obtener la mezcla de isómeros (IV), (V) a partir del compuesto (III) según el Esquema I anterior, o se puede obtener en una serie de etapas de síntesis tal como se describe en el Ejemplo 8.
Se puede llevar a cabo la hidrólisis de las lactamas (IV), (V) en una solución alcohólica a temperatura de reflujo y en presencia de un exceso estequiométrico de una base alcalina fuerte. Como bases preferidas, se incluyen hidróxidos de metales alcalinos, tales como hidróxido de potasio o hidróxido de sodio, que se usan en un exceso de 2 a 20 veces o de 10 a 20 veces molar en base a la cantidad de los isómeros (IV), (V). Como alcoholes útiles, se incluyen alcanoles C1 a C6, incluyendo metanol, etanol, n-propanol, 2-propanol, n-butanol y sus mezclas. El uso de alcoholes de punto de ebullición superior, tales como n-propanol y n-butanol, parece proporcionar tiempos de reacción más cortos para la reacción de apertura de anillo.
Tras completarse la reacción de apertura de anillo, se añaden agua y etanol y se puede realizar a continuación una elaboración de extracción para eliminar los productos colaterales. Se extraen los derivados de aminoácidos (I) y (Ia) en la fase de agua/alcohol y se acidifican a un pH de 1 usando ácido clorhídrico. La posterior evaporación de los solventes alcohólicos cristaliza selectivamente el derivado de aminoácido, el ácido trans-8-cloro-10,11-dihidro-11-[(metilamino)metil]dibenz-[b,f]oxepin-10-carboxílico (I), como la sal clorhidrato.
Se puede obtener el ácido trans-8-cloro-10,11-dihidro-11-[(metilamino)metil]dibenz[b,f]oxepin-10-carboxílico (I) como el zwitterión cristalino, es decir, la base libre, cuando se reduce el pH a 6 en lugar de a 1. Adicionalmente, se puede preparar el zwitterión del ácido trans-8-cloro-10,11-dihidro-11-[(metilamino)metil]-dibenz[b,f]oxepin-10-carboxílico (I)...
Reivindicaciones:
1. Un derivado de trans-aminoácido de fórmula I o fórmula II,
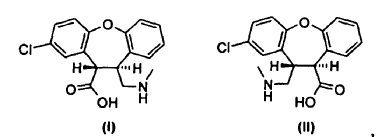
o el enantiómero de cada derivado de trans-aminoácido que tiene la configuración absoluta opuesta, o una mezcla racémica de cada derivado de trans-aminoácido, o una sal de los mismos.
2. Un derivado de trans-aminoácido según la reivindicación 1 seleccionado entre ácido trans-8-cloro-10,11-dihidro-11-[(metilamino)metil]dibenz[b,f]oxepin-10-carboxílico, ácido trans-2-cloro-10,11-dihidro-11-[(metilamino)metil]dibenz[b,f]oxepino-10-carboxílico o una sal de los mismos.
3. Un procedimiento para preparar un derivado de trans-aminoácido de fórmula 1,
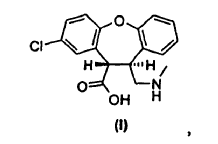
cuyo procedimiento consiste en hacer reaccionar una mezcla de lactamas de fórmula IV y fórmula V,
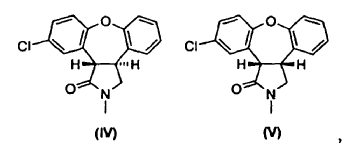
con una base en presencia de un alcohol.
4. Un procedimiento para preparar un derivado de trans-aminoácido de fórmula II,
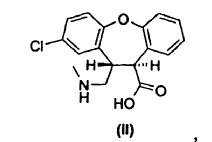
cuyo procedimiento consiste en hacer reaccionar una mezcla de lactamas de fórmula VII y fórmula VIII,
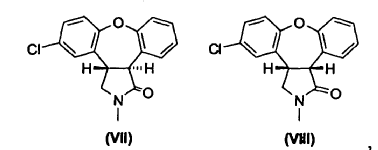
con una base en presencia de un alcohol.
5. El procedimiento de la reivindicación 3 o de la reivindicación 4, donde la base es una base alcalina, que está presente en un exceso estequiométrico, y el alcohol es un alcanol C1 a C6.
6. El procedimiento de la reivindicación 3 o de la reivindicación 4, donde la base es hidróxido de potasio y el alcohol es etanol.
7. Un procedimiento para preparar asenapina de fórmula A,
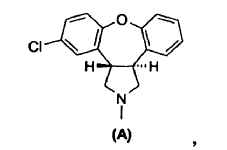
o una sal de la misma, cuyo procedimiento consiste en:
(a) ciclar un derivado de trans-aminoácido de fórmula I o fórmula II,
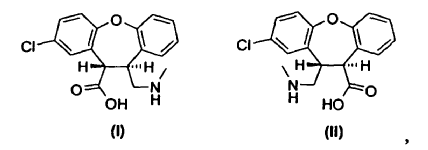
o una sal del mismo, para obtener una lactama de fórmula IV o fórmula VII,
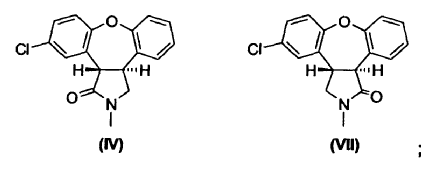
(b) reducir el resto carbonilo de una lactama de fórmula IV o fórmula VII para obtener la asenapina de fórmula A; y
(c) eventualmente convertir la asenapina de fórmula A en una sal de la misma.
8. El procedimiento de la reivindicación 7, donde la ciclación incluye el calentamiento del derivado de trans-aminoácido de fórmula I o fórmula II en un solvente.
9. El procedimiento de la reivindicación 7, donde la ciclación incluye el calentamiento del derivado de trans-aminoácido de fórmula I o fórmula II en un solvente y en presencia de acetato de sodio.
10. El procedimiento de la reivindicación 7, donde la ciclación incluye la activación del resto ácido carboxílico del derivado de trans-aminoácido de fórmula I o fórmula II y el tratamiento del ácido carboxílico activado con una base.
11. Un procedimiento para preparar asenapina de fórmula A,
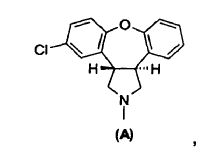
o una sal de la misma, cuyo procedimiento consiste en:
(a) tratar un derivado de trans-aminoácido de fórmula I o fórmula II,
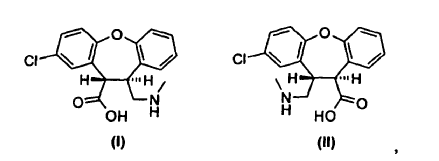
o una sal del mismo con un agente reductor para obtener asenapina de fórmula A y
(b) eventualmente convertir la asenapina en una sal de la misma.
12. El procedimiento de la reivindicación 11, donde el agente reductor es borano o hidruro de litio y aluminio, eventualmente en combinación con un ácido de Lewis.
Patentes similares o relacionadas:
Imidazopirazinas tricíclicas fusionadas como moduladores de la actividad de TNF, del 27 de Mayo de 2020, de UCB Biopharma SPRL: Un compuesto de fórmula (I) o un N-óxido del mismo, o una sal o un solvato farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde n representa un número […]
Nuevos compuestos antibacterianos, del 1 de Abril de 2020, de AZIENDE CHIMICHE RIUNITE ANGELINI FRANCESCO A.C.R.A.F. S.P.A.: Compuesto de fórmula: : A-L1-Y-L2-R-B en el que: A es un grupo cíclico que presenta la fórmula (II) siguiente: **(Ver fórmula)** […]
Derivados de quinazolinona como inhibidores de fosfatidilinositol 3-quinasa, del 9 de Octubre de 2019, de GILEAD SCIENCES, INC.: Un compuesto que tiene la estructura de Fórmula (I):**Fórmula** en donde: X, Y y Z se seleccionan independientemente de C(R') y N, en donde al menos uno […]
Derivados tetracíclicos activos como plaguicidas con sustituyentes que contienen azufre, del 18 de Septiembre de 2019, de SYNGENTA PARTICIPATIONS AG: Un compuesto de fórmula I,**Fórmula** en donde A1 representa S, O o NCH3; A2, A3, A4 y A5, independientemente entre sí, representan CR3 o N; […]
6H-isocromeno[3,4-c]piridinas y benzo[c][1,7]naftiridin-6-(5H)-onas como inhibidores de la cinasa asociada a adaptador 1 (AAK1), del 22 de Mayo de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I)**Fórmula** o una sal farmacéuticamente aceptable del mismo, en donde: X se selecciona entre O y NR5; R1 y R2 se seleccionan independientemente […]
Proceso para la producción de compuestos de triprenilfenol, del 8 de Mayo de 2019, de TMS Co., Ltd: Un método de producción de un compuesto de triprenilfenol de Stachybotrys microspora, comprendiendo el método: en primer lugar, cultivar un hongo filamentoso usando un medio […]
Derivados de heterociclil-butanamida, del 22 de Febrero de 2019, de MERCK PATENT GMBH: Los compuestos de la fórmula I**Fórmula** en la que W representa**Fórmula** en la que * indica el punto de unión al resto propileno, X […]
Formas cristalinas de 2-((4S)-6-(4-clorofenil)-1-metil-4H-benzo[c]isoxazolo[4,5-e]azepin-4-il)acetamida, del 13 de Febrero de 2019, de Constellation Pharmaceuticals, Inc: Forma A monohidrato cristalina de 2-((4S)-6-(4-clorofenil)-1-metil-4H-benzo[c]isoxazolo[4,5-e]azepin- 4-il)acetamida, en la que la forma cristalina está caracterizada […]