COMPUESTO DE REGENERACIÓN CELULAR.
Esta invención se refiere a un compuesto de regeneración celular que permite la administración intravenosa,
intramuscular y local de células madre con fines terapéuticos en padecimientos crónicos degenerativos en los que se incluye la Insuficiencia Renal Crónica, la Diabetes Mellitus y sus complicaciones, enfermedades neurodegenerativas, vitíligo, insuficiencia cardiaca, cardiopatía isquémica y el antienvejecimiento. La fórmula del compuesto "CRC" permite inyectar paraenteralmente, localmente y tópicamente células madre pluripotenciales criopreservadas o liofilizadas en frascos o cajas de líneas celulares en cultivo, después de ser descongeladas gradualmente de -20º C a 8º C, son prehidratadas con la primera solución base del compuesto de regeneración celular (frasco "A"). El "Compuesto de Regeneración Celular" ("CRC") se prepara secuencialmente a través de cinco soluciones "A", "B", "C" y "D", el objeto de esta invención es describir la forma de preparación de las cuatro soluciones base, que integran el "Compuesto de Regeneración Celular" ("CRC") el cual es una invención no existente en el mercado como tal, la cual facilita la aplicación de células madre en forma de inyecciones paraenterales o tópicamente, evitándose estudios de gen tipificación de HLA, e intervenciones quirúrgicas y de radiología intervencionista que se emplean en el implante o trasplante de células madre. El "CRC" (frascos "A", "B", "C" y "D") sirve de vehículo para liberar cantidades suficientes y seguras de células madre en protocolos de terapia celular, medicina regenerativa y antienvejecimiento, el compuesto ha sido empleado y ha mostrado ser útil para tratar múltiples padecimientos crónico degenerativos, que no cuentan con tratamientos convencionales que puedan revertir la progresión y requieren de regeneración celular como son: la insuficiencia renal crónica, la Diabetes Mellitus, la insuficiencia cardiaca, infartos cerebrales y del miocardio, artrosis, la Enfermedad de Parkinson, el Vitíligo, etc.
Para lo cual se requiere aplicar un mínimo de 5 a 10 inyecciones intravenosas con 6 ml del "CRC" por lo menos cada siete días.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/MX2009/000121.
Solicitante: SOCIEDAD INTERNACIONAL PARA LA TERAPIA CELULAR CON CELULAS MADRE, MEDICINA REGENERATIVA Y EL ANTIENVEJECIMIENTO, S.C.
Nacionalidad solicitante: México.
Dirección: Prol.Nicolas Bravo No.47, Col. Lomas del Huizachal 53840 Naucalpán de Juárez MEJICO.
Inventor/es: SOSA LUNA,Carlos Armando, SÁNCHEZ GONZÁLEZ,Dolores Javier, GONZÁLEZ LÓPEZ,Gerardo Martín.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- A61P43/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para usos específicos, no previstos en los grupos A61P 1/00 - A61P 41/00.
- C12N5/071 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos de vertebrados, p.ej. células o tejidos humanos.
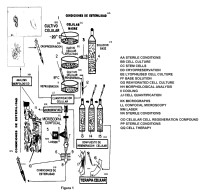
Fragmento de la descripción:
Compuesto de regeneración celular.
ANTECEDENTES DE LA INVENCIÓN
Las células madre conocidas en inglés como stem cells, también se les conoce como “células troncales”, “células tronco”, “células precursoras”, “células progenitoras” y “células estaminales”. La célula madre es la precursora de aproximadamente 250 estirpes de células diferenciadas y sus estadios de diferenciación parcial que van perdiendo la capacidad pluripotencial de la célula madre original y se van comprometiendo con un determinado linaje celular para formar células especializadas específicas, como son las neuronas, las células beta pancreáticas, los cardiomiocitos, entre otras muchas más.
Las células madre se caracterizan por que pueden dividirse simultáneamente para mantener una autorenovación celular; es decir una producción sostenida de células madre semejantes a ella. Así como la transdiferenciación y tropismo que permite generar células hijas comprometidas hacia una estirpe celular específica, además de que tienen la capacidad de migrar al sitio de lesión o daño en el que ocurre la diferenciación celular, después de que ocurra la implantación, observándose la regeneración celular en los tejidos sanos y enfermos (Sánchez-González DJ, Trejo-Bahena NI. Biología Celular y Molecular. Editorial Alfil; México Distrito Federal, 2006) . Estas características hacen ver a la inyección de células madre como una terapia potencial, útil para llevar a cabo la regeneración celular en enfermos. (González-López GM, Sánchez-González DJ y Sosa-Luna CA. Terapia Celular con Células Madre y Medicina Regenerativa. México 2008; Editorial Alfil) .
Thomson y colaboradores (U.S. Pat. No. 5, 843, 780; Proc. Natl. Acad. Sci. USA 92:7844, 1995) fueron los primeros en aislar y propagar células madre de primates. En forma subsiguiente derivaron la primera línea celular de células madre humana a partir de los blastocistos. Gearhart y colaboradores derivaron células madre germinales a partir de tejidos fetales de origen gonadal (Shamblott et.al. Proc. Natl. Acad. Sci. USA 95:13726, 1998; and U.S. Pat. No. 6, 090, 622) .
Tanto las células madre derivadas de blastocistos como las que se obtienen de tejidos gonadales, tienen características que las definen como células madre pluripotenciales, es decir; pueden ser cultivadas durante largos periodos de tiempo sin que éstas entren en diferenciación, manteniendo una morfología con cariotipo normal y son capaces de diferenciarse un importante número de células especializadas.
El problema más importante para utilizar células madre pluripotentes en protocolos de terapia celular es que estas células madre son cultivadas tradicionalmente sobre una cama de células (feeder cells) que previenen la diferenciación (U.S. Pat. No. 5, 843, 780; U.S. Pat. No. 6, 090, 622) . De acuerdo a los experimentos de Thomson y colaboradores (Science 282:114, 1998) , cuando las células madre son cultivadas sin su cama de células (feeder cells) , las células madre mueren y comienzan a diferenciarse en forma desordenada. En la patente Internacional publicada por Geron Corp. (WO 99/20741) , titulada: “Métodos y materiales para el crecimiento de células madre derivadas de células primordiales de primate”; se refiere a un medio de cultivo celular para hacer crecer células madre de primates y que permanezcan en un estado de indiferenciación bajo condiciones de presión osmótica baja y bajo nivel de endotoxinas. Este medio de cultivo celular puede combinar suero para soportar las células madre y la cama de células, el medio de cultivo celular además incluye aminoácidos no esenciales, antioxidantes, factores de crecimiento nucleótidos y sales de piruvato. Otra patente Internacional publicada por Geron Corp. (WO 01/51616) titulada: “Técnicas de crecimiento y diferenciación de células madre humanas pluripotentes”. Y el articulo de Xu y colaboradores (Nature Biotechnology 19:971, 2001) titulado: “Crecimiento de células madre indiferenciadas, sin cama de células (feeder cells”) . El artículo de Lebkowski y colaboradores (Cancer J. 7 Suppl. 2:S83, 2001) titulado: “Células madre embrionarias humanas: cultivo, diferenciación, y modificación genética para aplicaciones de medicina regenerativa”. Estas publicaciones reportan ejemplos de estado del arte de la técnica y siempre se trata de medios y métodos de cultivo celular para propagar células madre y mantenerlas en un estado de indiferenciación. Sin embargo, no existe ningún “Compuesto de Regeneración Celular” que permita inyectar células madre en forma de terapia celular a seres humanos. Ni existe algún producto farmacéutico similar que pueda actuar como “Compuesto de Regeneración Celular”, que haya tenido éxito en revertir la progresión de enfermedades crónicas degenerativas, como la Insuficiencia Renal Crónica inducida por la Diabetes Mellitus u otras patologías (Chirino YI, Sánchez-González DJ et. al. Protective effects of apocynin against cisplatin-induced oxidative stress and nephrotoxicity. Toxicology 2008; 245: 18–23 y Razo-Rodríguez AC, Chirino YI, Sánchez-González DJ et. al. Garlic powder ameliorates cisplatin-induced nephrotoxicity and oxidative stress. J Med Food 2008; 11 (3) :582-586.)
Si bien las células madre se han aplicado en algunos protocolos clínicos de investigación en Medicina en fase I a III (Traynor A. et. al. “Treatment of severe systemic lupus er y thematosus with high-dose chemotherapy and haematopoietic stem-cell transplantation: a phase I” publicados en Agosto del 2000 en la revista The Lancet. Vol.
356. Andrew P. et. al., “The Adult Blood and Marrow Stem Cell Transplant Service” Hackensack. Bone Marrow Transplantation, Abril del 2000, Sykes M. et. al. “Treatment of severe autoimmune disease by stem-cell transplantation” Nature No. 2; Vol. 435 (7042) , pp. 620-7. June 2005, Shamblott MJ et. al. ”Cell therapies for type 1 diabetes mellitus”. Expert Opin Biol Ther 2004 Mar; Vol. 4 (3) , pp. 269-77) ; en todos estos protocolos las células madre son cultivadas y en ocasiones expandidas con los métodos y medios de cultivo descritos previamente en los
antecedentes de la presente invención, y las células madre se administran en masa o como bolos mediante procedimientos conocidos como trasplante de médula ósea, de forma muy similar a las convencionales transfusiones sanguíneas, o bien se aplican inyecciones de células madre purificadas, en las que se incluyen procedimientos quirúrgicos altamente especializados, en los que se pueden integrar procedimientos de radiología intervencionista, los cuales además requieren de la erogación de gasto de honorarios médicos, los de hospitalización, anestesia, estudios de laboratorio clínico y gabinete. Orlic y colaboradores inyectaron células madre en la zona periférica del infarto agudo al miocardio; , estas células se diferenciaron en estructuras del corazón, mejorando la función del corazón infartado. La reparación cardiaca producida por las células madre redujo la mortalidad en un 68% y el tamaño del infarto en un 40%. (Orlic D. et. al. Proc. Natl. Acad. Sci. USA 2001; 98 (18) :10344–10349) . Otros trabajos relacionados con la células madre están contribuyendo a establecer que cuanto más altos sean los niveles de células madre en circulación, mayor es la habilidad del cuerpo para regenerarse y estar por más tiempo sano (Werner et.al. N Engl J Med.2005; 8; 353 (10) :999-1007) . Este tipo de invenciones e investigaciones están cambiando el paradigma en la historia de la humanidad en la que se pensó que era imposible reparar el daño causado una vez que se ha establecido la muerte o daño celular en un órgano vital como es el caso de los infartos al corazón.
Otras investigaciones complementarias son las de Bozlar M et. La. (2005) Saudi Med J. 26 (8) :1250-4. Kong D, et. al. (2004) Circulation. 110 (14) :2039-46. Eroglu E, et al. Agalar F, Altuntas I, Eroglu F. (2004) Tohoku J Exp Med. 204 (1) :11-6. Tomoda H, Aoki N.et.al. Clin Cardiol. 2003 Oct; 26 (10) :455-7. Krause DS et. Al. Cell 105:369-77. Eglitis M. et. Al. Proc. Natl. Acad. Sci. USA Vol. 94, pp. 4080–4085. Camargo FD, et. Al. Nature 2003 9 (12) :1520-27; y el de Ianus A, et. Al. J. Clin. Invest. (2003) 111:843-850. Secretaría de Salud.Manual de Procedimiento Operativo de la Unidad de Transplante de Progenitores Hematopoyéticos del Instituto Nacional de Pediatría (2008) .
DESCRIPCIÓN DE LA INVENCIÓN
Como se puede constatar...
Reivindicaciones:
1) Procedimiento para la preparación de un Compuesto para la Regeneración Celular que comprende las siguientes etapas:
a) proporcionar una línea purificada de células madre pluripotenciales a partir de, o bien células madre criopreservadas a -198ºC que se descongelan gradualmente aumentado la temperatura a una velocidad de 2 ºC/min hasta alcanzar la temperatura de -20 ºC, o bien células madre en polvo en estado de deshidratación total obtenido por un proceso de liofilización convencional, en donde las células madre no han sido obtenidas mediante métodos que destruyan o utilicen embriones humanos como materia prima;
b) preparar una solución base “A” de acuerdo con el siguiente procedimiento:
i) disolver cloruro de sodio (NaCl) , lactato de sodio (NaC3H5O3) , cloruro de calcio (CaCl2) y cloruro de potasio (KCl) en agua bidestilada hasta alcanzar la siguiente proporción iónica: Na+= 130 mEq, Cl-= 109 mEq, lactato= 28 mEq, Ca2+ = 3 mEq y K+ = 4 mEq, alcanzando una osmolaridad de al menos 273 mOsm/L y no superior a 300 mOsm/L en condiciones de esterilidad y en un ambiente controlado a una temperatura de refrigeración menor de 16°C y mayor de 4°C;
ii) esterilizar la solución de la sub-etapa i) mediante un proceso tradicional de esterilización tal como el de autoclave;
iii) agregar a la solución de la sub-etapa ii) una solución estéril con 55 mg de cloruro de zinc, 16, 9 mg de sulfato cúprico pentahidratado, 38, 1 mg de sulfato de magnesio, 1, 3 mg de yoduro de sodio, 14 mg de fluoruro de sodio, 163, 9 mg de cloruro de sodio, 10 mg de tiamina, 250 mg de piridoxina, 1000 mg de ácido ascórbico, 1, 0 mg de activina, 0, 2 mg de factor estimulador de células pluripotenciales (C-kit) , 0, 6 mg de derivado procaínico G1, 0, 4 mg de derivado procaínico G2, y 0, 4 mg de derivado procaínico G3;
c) hidratar las fuentes de células madre de la etapa a) en la solución base “A” obtenida en la etapa b) a una temperatura de 8 ºC;
d) seleccionar las células madre prehidratadas con morfología saludable y recogerlas en una jeringa estéril;
e) suspender aproximadamente 1.000.000.000 células madre en 500 ml de la solución base “A”, proporcionando así una solución base “A” enriquecida con células madre;
f) preparar una solución base “B” mezclando en forma controlada y en condiciones estériles 500 ml de solución “A” con una concentración de 2.000.000 células madre, con 1, 0 mg de L-cisteína, 0, 5 μg de interleucina 7 (IL7) , X0, 5XIgXdeXinterleucinaX3X (IL-3) , 0, 1 mg de Factor de crecimiento mesodérmico A1 (FGM) , 0, 1 mg de factor estimulador de colonias de monocitos (M-CSF) , y 0, 1 mg de factor estimulador de colonias de granulocitos (GM-CSF) , almacenados a 8º C durante no más de una semana, o a -4º C durante no más de cinco semanas,
o a -20 ºC durante no más de veinticuatro semanas;
g) preparar una solución base “C” mezclando en forma controlada y en condiciones estériles 500 ml de la solución “B” con 0, 3 mg de factor de transformación de crecimiento beta (TGF-B) y 0.2 mg de factor de crecimiento endodérmico K2 (FGE) , almacenados 8º C por no más de una semana, o a -4º C por no más de cinco semanas, o a -20 ºC por no más de veinticuatro semanas;
h) preparar una solución base “D” mezclando 500 ml de solución “C” con 100 mg de retinol, 0, 5 mg factor de crecimiento de fibroblastos (FGF) y 0, 2 mg de factor de crecimiento neurológico (FGFN) .
i) proporcionar el Compuesto para la Regeneración Celular integrado por las cuatro soluciones base “A”, “B”, “C” y “D”.
2) Compuesto para la Regeneración Celular obtenido mediante el procedimiento de la reivindicación 1.
3) Uso del Compuesto para la Regeneración Celular obtenido según el procedimiento de la reivindicación 1 en la fabricación de un medicamento para tratar padecimientos crónicos degenerativos que requieren de una regeneración celular.
4) Uso según la reivindicación 3, en el que los padecimientos crónicos degenerativos se seleccionan del grupo que consiste en insuficiencia renal crónica, insuficiencia cardíaca, cardiopatía isquémica, diabetes mellitus, artrosis, fibromialgias, demencias, enfermedad de Alzheimer, artritis reumatoide, lupus eritematoso sistémico, esclerosis lateral amiotrófica, esclerosis múltiple, enfermedad de Parkinson, vitíligo, hernias discales, síndrome de Down, autismo, esquizofrenia, pérdida de la audición y otros sentidos, parálisis e insuficiencia vascular arterial o venosa.
Patentes similares o relacionadas:
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivado de dihidropiridazin-3,5-diona, del 15 de Julio de 2020, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen […]
Derivado de dihidroindolizinona, del 1 de Julio de 2020, de ONO PHARMACEUTICAL CO., LTD.: (3S)-3-[2-(6-amino-2-fluoro-3-piridinil)-4-fluoro-1H-imidazol-5-il]-7-[5-cloro-2-(1H-tetrazol-1-il)fenil]-2,3-dihidro- (1H)-indolizinona, una…
Inhibidor de fibrosis, del 1 de Julio de 2020, de NIPPON SHINYAKU CO., LTD.: Composición farmacéutica que comprende un derivado heterocíclico seleccionado de ácido 2-{4-[N-(5,6-difenilpirazin-2-il)-N-isopropilamino]butiloxi}acético […]
Derivado de amina cíclica y uso farmacéutico del mismo, del 1 de Julio de 2020, de TORAY INDUSTRIES, INC.: Un derivado de amina cíclica representado por la siguiente fórmula general (I): **(Ver fórmula)** donde R1 representa un grupo alquiloxi que tiene de 1 a 3 átomos […]
Compuestos utilizados como inhibidores de la quinasa reordenada durante la transfección (RET), del 1 de Julio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto de acuerdo con la Fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: X es N o CR5; Y es un enlace; […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]