Comprimidos de liberación inmediata de rasagilina hemitartrato.
Una composlclon farmacéutica estable en forma de comprimidos de liberación inmediata que comprende hemitartrato de (R)-N-propargil-1-aminoindano,
preferiblemente para su uso en el tratamiento de la enfermedad de Parkinson.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E13154290.
Solicitante: GALENICUM HEALTH, S.L.
Inventor/es: PÉREZ CADAHÍA,BEATRIZ.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/135 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos aromáticos, p. ej. metadona.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
- A61P25/16 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Medicamentos contra el Parkinson.
PDF original: ES-2502140_T1.pdf



Reivindicaciones:
1.- Una composición farmacéutica estable en forma de comprimidos de liberación inmediata que comprende hemitartrato de (R)-N-propargil-l-aminoindano, preferiblemente para su uso en el tratamiento de la enfermedad de
Parkinson.
2.- La composición farmacéutica de acuerdo con la reivindicación anterior que comprende entré un 0,3 y un 1,5 % en peso de hemitartrato de (R)-N-propargiM-aminoindano con respecto a la cantidad total de la composición farmacéutica.
3.- La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores, donde la composición farmacéutica comprende además al menos un ácido, preferiblemente la cantidad total de ácido o ácidos presentes en la composición farmacéutica oscila entre 0,3 y 3,5 % en peso con respecto a la cantidad total de la composición farmacéutica, la composición farmacéutica comprende al menos un ácido seleccionado entre
ácido cítrico y ácido tartárico y/o la composición farmacéutica comprende ácido tartárico.
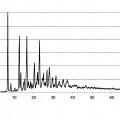
4.- La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores, donde el hemitartrato de (R)-N-propargil-l-aminoindano está en forma cristalina o la composición farmacéutica comprende la forma cristalina GH del hemitartrato de (R)-N-propargil-l-aminoindano caracterizada al menos por los picos de difracción
de rayos X 6,7, 12,6 y 16,4° 20 (± 0,2° 20), y/o la D50 del hemitartrato de (R)-N-propargiM-aminoindano está entre 4 y 39 mieras medida por espectroscopia de difracción láser y/o la D90 del hemitartrato de (R)-N-propargiM- aminoindano es menor de 159 mieras, medida por espectroscopia de difracción láser.
5.- La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores, donde la 25 composición farmacéutica comprende al menos un diluyente, preferiblemente: la cantidad total de diluyente o
diluyentes presente en la composición farmacéutica oscila entre 25 % y 95 % en peso con respecto a la cantidad total de la composición farmacéutica; la cantidad total de diluyente o diluyentes presente en la composición farmacéutica oscila entre 45 % y 90 % en peso con respecto a la cantidad total de la composición farmacéutica; y/o la composición farmacéutica comprende al menos un diluyente, seleccionado de entre celulosa microcrístalina, 30 manitol, trehalosa, y mezclas de los mismos, más preferiblemente la composición farmacéutica comprende trehalosa.
6.- La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores, donde la composición farmacéutica comprende al menos un lubricante, preferiblemente la cantidad total de lubricante o
lubricantes presente en la composición farmacéutica oscila entre 0,5 y 5 % en peso con respecto la cantidad total de la composición farmacéutica y/o la composición farmacéutica comprende al menos un lubricante seleccionado de entre estearato de magnesio, ácido esteárico, sodio estearil fumarato o mezclas de los mismos, más preferiblemente la composición farmacéutica comprende ácido esteárico.
7.- La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores, donde la composición farmacéutica comprende al menos un disgregante, preferiblemente la cantidad total de disgregante o disgregantes presente en la composición farmacéutica oscila entre 5 y 25 % en peso con respecto a la cantidad total de la composición farmacéutica y/o la composición farmacéutica comprende por lo menos un disgregante seleccionado de entre almidón, almidón pregelatinizado, e hidroxipropil celulosa de baja sustitución, más 45 preferiblemente la composición farmacéutica comprende almidón pregelatinizado.
8.- La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores, donde la composición farmacéutica comprende entre 0,74 y 2,18 mg de hemitartrato de (R)-N-propargiM-aminoindano por dosis unitaria, preferiblemente la composición farmacéutica comprende unos 1,44 mg de hemitartrato de (R)-N-
propargil-1-aminoindano por dosis unitaria.
9.- La composición farmacéutica de acuerdo con la reivindicación anterior, donde la composición farmacéutica se fabrica por técnicas de granulación húmeda o técnicas, de mezclado en seco, preferiblemente la composición farmacéutica se fabrica por compresión directa.
10.- Forma cristalina GH del hemitartrato de (R)-N-propargil-l-aminoindano que presenta al menos los picos de difracción de rayos X 6,7, 12,6 y 16,4° 20 (± 0,2° 20), preferiblemente que presenta al menos los picos de difracción de rayos X 6,7, 12,6, 13,3, 16,4, 20,4 y 23,0° 20 (± 0,2° 20) o uso de dicho hemitartrato de (R)-N- propargil-1-aminoindano para la fabricación de comprimidos de liberación inmediata que comprenden hemitartrato
de (R)-N-propargil-l-aminoindano, y/o uso de dicho hemitartrato de (R)-N-propargiM-aminoindano para un proceso de fabricación de comprimidos de liberación inmediata que comprenden hemitartrato de (R)-N-propargiM- aminoindano.
11.- Un lote farmacéutico que comprende al menos 20.000 unidades, preferiblemente que comprende al menos
50.000 unidades, más preferiblemente que comprende ai menos 100.000 unidades de la composición farmacéutica como se define en una cualquiera de las reivindicaciones 1 a 9, donde el contenido de hemitartrato de (R)-N- propargil-1-aminoindano es uniforme y/o los comprimidos están empaquetados en un blister de aluminio/PVC o aluminio/ aluminio.
12.- Un proceso para la fabricación de la composición farmacéutica como se define en las reivindicaciones 1 a 9 o del lote farmacéutico como se define en la reivindicación 11, que comprende las siguientes etapas:
i) tamizar cuando sea apropiado los ingredientes a través de un tamiz de 500 mieras;
ii) mezclar hemitartrato de (R)-N-propargil-l-aminoindano con al menos un excipiente farmacéuticamente aceptable, preferiblemente un diluyente, preferiblemente al menos 10 % del peso total de dicho diluyente;
iii) adicionalmente, y cuando sea apropiado, mezclar la mezcla obtenida en la etapa (ii) con excipientes 15 farmacéuticamente aceptables adicionales;
iv) opcionalmente, mezclar la mezcla obtenida en la etapa (iii) o (ii) con al menos un lubricante; y
v) comprimir la mezcla en comprimidos.
13.- Un proceso para la fabricación de una composición farmacéutica estable que comprende hemitartrato de (R)-N- propargil-1-aminoindano en forma de un comprimido de liberación inmediata o para, la fabricación de un lote farmacéutico de dicha composición farmacéutica, que comprende las siguientes etapas:
i) preparar una composición farmacéutica de prueba que comprende hemitartrato de (R)-N-propargiM-aminoindano en forma de un comprimido;
ii) comprobar la estabilidad y el perfil de disolución de la composición farmacéutica de prueba de la etapa (i), preferiblemente la estabilidad después de al menos un día a 40° C y humedad relativa del 75 %; y
iii) fabricar una composición farmacéutica que comprende hemitartrato de (R)-N-propargiM-aminoindano en forma de un comprimido de liberación inmediata o un lote farmacéutico de dicha composición farmacéutica, por el mismo proceso usado para preparar la composición farmacéutica de prueba de la etapa (i) solamente si la composición farmacéutica de prueba es estable y tiene un perfil de disolución de liberación inmediata; y
iv) opcionalmente, empaquetar la composición farmacéutica estable o el lote farmacéutico fabricado en la etapa (iii), preferiblemente en blister o en botellas.
14.- Un lote farmacéutico validado por un proceso que comprende las siguientes etapas:
i) fabricar el lote farmacéutico;
ii) comprobar la uniformidad de contenido de hemitartrato de (R)-N-propargil-l-aminoindano; y 45 iii) validar el lote solamente si el contenido es uniforme.
15.- Una composición farmacéutica empaquetada, donde dicha composición farmacéutica empaquetada es: un blister que comprende la composición farmacéutica como se define en cualquiera de las reivindicaciones 1 a 9, o una botella que contiene al menos 10 comprimidos como se definen en una cualquiera de las reivindicaciones 1 a 9,
o una caja de cartón con un folleto de información para el paciente que comprende al menos uno de dichos blisters o de dicha botella.
Patentes similares o relacionadas:
Uso de (1R,2R)-3-(3-dimetilamino-1-etil-2-metil-propil)-fenol para tratar el dolor inflamatorio, del 22 de Julio de 2020, de GRUNENTHAL GMBH: (1R, 2R)-3-(3-Dimetilamino-1-etil-2-metil-propil)-fenol para uso en el tratamiento del dolor inflamatorio.
Régimen de dosificación para un agonista del receptor S1P, del 3 de Junio de 2020, de NOVARTIS AG: Uso de un modulador o agonista del receptor S1P en la fabricación de un medicamento para el tratamiento de una enfermedad autoinmune, mediante […]
Métodos de administración de terapia con pirfenidona, del 13 de Mayo de 2020, de Intermune, Inc: Pirfenidona para su uso en el tratamiento de un paciente que necesita terapia con pirfenidona, caracterizada por que el tratamiento comprende reducir la dosis de […]
Composiciones congeladas fluidas que comprenden un agente terapéutico, del 8 de Abril de 2020, de Tavakoli, Zahra: Una composición fluida congelada que comprende un agente terapéutico y al menos un agente aromatizante para su uso en terapia, donde dicha composición […]
Sistema terapéutico transdérmico para la administración de principios activos hidrosolubles, del 18 de Marzo de 2020, de LTS LOHMANN THERAPIE-SYSTEME AG: Sistema terapéutico transdérmico para la administración controlada de un principio activo farmacéutico soluble en agua a partir de una fase acuosa que comprende una […]
COMBINACIÓN FARMACÉUTICA SINÉRGICA QUE COMPRENDE TRAMADOL CLORHIDRATO Y PREGABALINA, Y SU USO PARA EL TRATAMIENTO DEL DOLOR NEUROPÁTICO, del 5 de Marzo de 2020, de GRUNENTHAL GMBH: Combinación farmacéutica sinérgica que contiene tramadol clorhidrato y pregabalina en una razón p/p entre 1 :1,5 a 1 :2,5 y excipientes farmacéuticamente […]
COMBINACIÓN FARMACÉUTICA SINÉRGICA QUE COMPRENDE TRAMADOL CLORHIDRATO Y PREGABALINA, Y SU USO PARA EL TRATAMIENTO DEL DOLOR NEUROPÁTICO, del 5 de Marzo de 2020, de GRUNENTHAL GMBH: Combinación farmacéutica sinérgica que contiene tramadol clorhidrato y pregabalina en una razón p/p entre 1 :1,5 a 12,5 y excipientes farmaceuticamente aceptables, […]
Composiciones antimicrobianas mejoradas, del 5 de Febrero de 2020, de NOVAPHARM RESEARCH (AUSTRALIA) PTY LTD: Una composición antiséptica para frotado de manos que cuando es usada a una tasa menor que 6 ml de composición durante hasta 60 segundos produce un nivel de eficacia biocida […]