COMPRIMIDO RECUBIERTO O GRANULADO QUE CONTIENE UNA PIRIDILPIRIMIDINA.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06016747.
Solicitante: SIEGFRIED GENERICS INTERNATIONAL AG.
Nacionalidad solicitante: Suiza.
Dirección: UNTERE BRUHLSTRASSE 4,4800 ZOFINGEN.
Inventor/es: MULLER, BEAT W., ROHRICH,LAMBERT TILLMANN.
Fecha de Publicación: .
Fecha Solicitud PCT: 10 de Agosto de 2006.
Fecha Concesión Europea: 14 de Octubre de 2009.
Clasificación Internacional de Patentes:
- A61K9/20H6B
- A61K9/20H6F2
- A61K9/20H6F4
- A61K9/20P
Clasificación PCT:
- A61K31/529 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › formando parte de sistemas cíclicos puenteados.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
- A61P35/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 35/00 Agentes antineoplásicos. › específicos para la leucemia.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Comprimido recubierto o granulado que contiene una piridilpirimidina.
La presente invención se refiere a una forma de administración de aplicación oral, estable, preferentemente en forma de comprimidos recubiertos y granulados, para uso oral, que contiene, como mínimo, un compuesto de piridilpirimidina o una sal farmacéuticamente aceptable de un compuesto de dicha clase, en especial 4-(4-metil-piperazin-1-ilmetil)-N-[4-metil-3-(4-(3-piridin-3-il-pirimdin-2-ilamino)-fenil]-benzamida (imatinib) o una sal farmacéuticamente aceptable del mismo. Una sal preferente de imatinib es la sal del ácido metansulfónico, en lo sucesivo denominada monometansulfonato de imatinib o imatinib-mesilato, que corresponde al siguiente compuesto de fórmula (I):
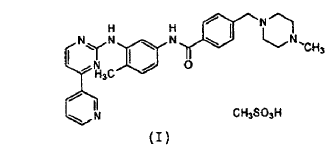
Son conocidos la fabricación y los efectos farmacológicos de la sustancia activa 4-(4-metil-piperazin-1-ilmetil)-N-[4-metil-3-(4-(3-piridin-3-il-pirimdin-2-ilamino)-fenil]-benzamida y sus sales farmacéuticamente aceptables en forma anhidra o hidratada. Así, el documento EP 0 998 473 da a conocer la fabricación de imatinib-mesilato de forma cristalina alfa (a) y de forma cristalina (ß), donde la forma alfa se designa como higroscópica. Se señala, además, que la forma alfa está presente como cristales con forma de aguja y que, por ello, debido a sus desfavorables propiedades de flujo, no es especialmente adecuada para formar comprimidos.
Se ha observado que ciertos tratamientos médicos, por ejemplo la administración como inhibidor de tirosina-quinasa para la terapia de la leucemia, requieren administrar dosis diarias relativamente elevadas, del orden de 100 mg a 800 mg, en especial de 400 mg a 800 mg de la sustancia activa (imatinib). Esto significa que se deben fabricar comprimidos con un contenido relativamente elevado de sustancia activa, preferentemente del 25% en peso hasta 80% en peso, para que el comprimido no sea demasiado grande.
En el documento WO 03/090720 se describen comprimidos con alto contenido de la sustancia activa imatinib-mesilato para administración oral, aunque todos ellos se fabrican mediante granulación húmeda convencional. Según dicho documento, al parecer sólo mediante la granulación húmeda se puede conseguir, por una parte, la dureza y resistencia a la abrasión del comprimido y, por otra, la suficiente biodisponibilidad de la sustancia activa, de manera que se utiliza el imatinib-mesilato preferentemente en la forma cristalina beta.
Ahora se ha descubierto que es posible fabricar formas de administración sólidas, en especial comprimidos recubiertos y granulados, que contienen un compuesto de piridilpirimidina o una sal farmacéuticamente aceptable de dicho compuesto, preferentemente imatinib o una sal de imatinib farmacéuticamente aceptable, preferentemente imatinib-mesilato, tanto en la forma alfa como en la forma beta, preferentemente en la forma alfa, mediante la compresión de las sustancias de partida, es decir, de la sustancia activa junto con los aditivos, si antes de la compresión de las sustancias de partida como mínimo una de las sustancias de partida se granula en seco, preferentemente se densifica o compacta, preferentemente se densifica o compacta con rodillos, de manera que, en su caso, después del subsiguiente mezclado de todas las sustancias de partida se obtiene una mezcla capaz de fluir de todas las sustancias de partida. Para ello, antes de comprimir las sustancias de partida se puede granular en seco la sustancia activa sola, o la sustancia activa con uno de los aditivos, o bien la sustancia activa con varios de los aditivos o bien junto con todos los aditivos.
A partir de la mezcla de sustancias iniciales así obtenida se pueden fabricar comprimidos recubiertos con un contenido de sustancia activa del 25% al 80% en peso, los cuales poseen tanto una dureza suficiente, una resistencia a la abrasión suficiente y una suficiente biodisponibilidad de la sustancia activa, así como una suficiente estabilidad de almacenamiento, en especial, una suficiente estabilidad frente a la humedad. Esto se aplica, en especial, cuando se emplea imatinib-mesilato en la forma cristalina alfa.
La presente invención está definida en las reivindicaciones. En especial, la presente invención se refiere a un comprimido recubierto que consta de un núcleo de comprimido con una película de recubrimiento o un granulado, que contiene como sustancia activa un compuesto de piridilpirimidina o una sal aceptable de dicho compuesto, preferentemente imatinib-monometano-sulfonato, caracterizado porque (i) los núcleos de comprimido y los granulados se han fabricado mediante compresión de las sustancias de partida, es decir, mediante compresión de la mezcla de la sustancia activa junto con los aditivos y, antes de la compresión de las sustancias de partida, como mínimo una de las sustancias de partida ha sido granulada en seco, preferentemente compactada; (ii) los núcleos de comprimidos y núcleos de granulado contienen la sustancia activa en una cantidad del 25% al 80% en peso, respecto al peso total de los núcleos de comprimido o de los núcleos de granulado, junto con (iii), como mínimo, un agente de carga y ligante, así como, en su caso, otros aditivos.
Preferentemente, la distribución media de tamaños de grano de, como mínimo, el 80% de la cantidad de sustancia activa está entre 0,01 mm y 1,0 mm, preferentemente entre 0,05 mm y 1,0 mm.
En el marco de la presente invención, el término "comprimido recubierto" significa un núcleo de comprimido dotado de una película de recubrimiento. El término "granulado" significa aquí un granulado sin película o un núcleo de granulado dotado de una película de recubrimiento, preferentemente un granulado sin película.
Compresión de las sustancias de partida significa que todos los componentes de las sustancias de partida en la mezcla, subsiguientemente al granulado en seco según la invención, en su caso tamizados, se procesan para formar un comprimido o granulado.
Granulado en seco de las sustancias de partida significa que, como mínimo, una de las sustancias de partida se densifica, preferentemente se compacta o granula en seco, preferentemente se compacta o densifica con rodillos de manera tal que todas las sustancias de partida de la mixtura forman una mezcla capaz de fluir. Preferentemente, según la invención, se granula en seco como mínimo la sustancia activa junto con, como mínimo, uno de los aditivos, o bien la sustancia activa junto con varios aditivos seleccionados o junto con todos los aditivos.
Las piezas prensadas obtenidas con la granulación en seco o compactación (también llamadas costras o piezas compactadas) se parten para formar granos, en su caso, se tamizan, y se someten a un procesado ulterior para formar comprimidos o granulados. Con ello, sorprendentemente, se obtienen comprimidos y granulados con las propiedades requeridas de dureza, disgregación, velocidad de disolución y estabilidad de almacenamiento, en especial, también cuando se utiliza imatinib-mesilato en la forma cristalina alfa.
El granulado en seco o compactación son conocidos de por sí y se pueden realizar en un compactador de rodillos, por ejemplo, de la marca Gerteis®, Alexanderwerk® o Powtec®. Por lo general, estos aparatos granulan o compactan a presiones de 10 a 300 bares, preferentemente de 30 a 100 bares. Preferentemente, es suficiente una presión de aproximadamente 40 a 80 bares (equivalente a aproximadamente 2,8 a 5,5 KN/cm). Generalmente, la presión empleada para la compactación o densificación óptima depende del conjunto de aparatos utilizado y puede ser ajustada de forma óptima sin dificultades por un especialista, a fin de conseguir la mezcla capaz de fluir de los componentes, según la invención.
La presente invención también se refiere a mezclas de polvos, núcleos de comprimidos y granulados que no están dotados de una película de recubrimiento y que se utilizan como productos intermedios en la fabricación de los comprimidos recubiertos y granulados con película, según la invención. La presente invención también se refiere a procedimientos para la fabricación de los comprimidos recubiertos y granulados con película, según la invención.
La presente invención se refiere, además, a la utilización de los comprimidos recubiertos y granulados, según la invención, como inhibidores de tirosina-quinasa y, en especial, en calidad de medicamentos para el tratamiento de la leucemia y otras indicaciones conocidas.
Los comprimidos recubiertos y granulados, según...
Reivindicaciones:
1. Procedimiento para la fabricación de comprimidos recubiertos, que constan de un núcleo de comprimido con una película de recubrimiento o de un granulado, que contienen como principio activo monometansulfonato de imatinib en forma cristalina alfa, en el que los núcleos de comprimido y los granulados se fabrican por compresión de las sustancias de partida y dichas sustancias de partida contienen en la mezcla la sustancia activa y, como mínimo, un compuesto que actúa como agente de carga y ligante, así como, en su caso, otros aditivos, caracterizado porque, antes de comprimir las sustancias de partida, se densifica y/o compacta, como mínimo, la sustancia activa, preferentemente se densifica y/o compacta, como mínimo, la sustancia activa junto con uno de los aditivos, y los núcleos obtenidos y, en su caso, los granulados, se cubren con una película de recubrimiento, de modo que los núcleos de comprimidos y los núcleos de granulados fabricados de esta manera contienen la sustancia activa en una proporción del 25% al 80% en peso, respecto al peso total de los núcleos de comprimidos o de los núcleos de granulados.
2. Procedimiento, según la reivindicación 1, caracterizado porque la distribución media de tamaños de grano de, como mínimo, el 80% de la cantidad de sustancia activa está entre 0,01 mm y 1,0 mm, preferentemente entre 0,05 mm y 1,0 mm.
3. Procedimiento, según la reivindicación 1 ó 2, caracterizado porque se compacta y/o densifica con rodillos.
4. Procedimiento, según una de las reivindicaciones 1 a 3, caracterizado porque, antes de comprimir las sustancias de partida para formar núcleos de comprimidos o granulados, se densifica y/o compacta, como mínimo, la sustancia activa junto con varios aditivos seleccionados o junto con todos los aditivos.
5. Procedimiento, según una de las reivindicaciones 1 a 4, caracterizado porque la densificación y/o compactación se realiza en un compactador de rodillos, preferentemente con una presión entre 10 y 300 bares, preferentemente en el intervalo de 30 a 100 bares, y preferentemente en el intervalo de presiones de aproximadamente 40 a 80 bares (que corresponde a 3,5 KN/cm hasta aproximadamente 5,5 KN/cm).
6. Comprimido recubierto o granulado, fabricado según una de las reivindicaciones 1 a 5, caracterizado porque el núcleo de comprimido o el núcleo de granulado contiene la sustancia activa en una proporción del 30% al 80% en peso, preferentemente en una proporción del 40% al 75% en peso, y preferentemente en una proporción del 50% al 70% en peso, respecto al peso total del núcleo de comprimido o del núcleo de granulado.
7. Comprimido recubierto o granulado, fabricado según una de las reivindicaciones 1 a 5, caracterizado porque el comprimido recubierto constituye una unidad de dosis y el granulado está envasado como unidad de dosis en un sobre o cápsula de gelatina dura, y la cantidad de sustancia activa por unidad de dosis es de aproximadamente 50 mg a 1000 mg, preferentemente 100 mg, 200 mg, 300 mg, 400 mg o 600 mg.
8. Comprimido recubierto o granulado, fabricado según una de las reivindicaciones 1 a 5, caracterizado porque el contenido de agua del agente de carga y ligante está entre 0,5% y 10,0% en peso, preferentemente entre 0,5% y 5,0% en peso, respecto al peso total del agente de carga y ligante.
9. Comprimido recubierto o granulado, fabricado según una de las reivindicaciones 1 a 5, caracterizado porque el agente de carga y ligante se elige del grupo que incluye los azúcares, preferentemente sacarosa y/o lactosa, como monohidrato o en forma anhidra, alcoholes de azúcares, preferentemente manitol, xilitol y/o sorbitol, glucósidos polímeros, preferentemente maltodextrina, celulosa microcristalina y/o almidones de diversa procedencia, preferentemente almidón de maíz, y/o sales inorgánicas, preferentemente fosfato hidrogenado de calcio como dihidrato o en forma anhidra, silicatos de calcio y/o carbonato de sodio, preferentemente silicato cálcico, celulosa y/o almidón.
10. Comprimido recubierto o granulado, fabricado según una de las reivindicaciones 1 a 5, caracterizado porque el agente de carga y ligante se selecciona del grupo que incluye almidones modificados de por sí conocidos, celulosa modificada, preferentemente carboximetilcelulosa, hidroxietilcelulosa, hidroxipropilmetilcelulosa, metilcelulosa y/o propilcelulosa, (hipromelosa), azúcar modificado, alcoholes de azúcares modificados y lactosa modificada, gelatinas, goma arábiga, almidón gelatinizado, y/o povidonas, preferentemente hidroxipovidona.
11. Comprimido recubierto o granulado, fabricado según una de las reivindicaciones 1 a 5, caracterizado porque el agente de carga y ligante está presente, complementando la sustancia activa presente, en una concentración del 75% al 20% en peso, preferentemente del 70% al 20% en peso, preferentemente del 60% al 25% en peso, y preferentemente del 50% al 30% en peso, respecto al peso total del núcleo de comprimido o del núcleo de granulado, de manera que la suma de las proporciones de sustancia activa y de agente de carga y ligante completa el 100%.
12. Comprimido recubierto o granulado, fabricado según una de las reivindicaciones 1 a 5, caracterizado porque su núcleo de comprimido o núcleo de granulado contiene otros aditivos, preferentemente elegidos del grupo que incluye desintegradores, reguladores de flujo, lubricantes y desmoldeantes, preferentemente una combinación de sustancia activa, agente de carga y ligante y desintegrador, preferentemente una combinación de sustancia activa, agente de carga y ligante, desintegrador y regulador de flujo.
13. Comprimido recubierto o granulado, fabricado según una de las reivindicaciones 1 a 5, caracterizado porque la película de recubrimiento contiene, como mínimo, un compuesto elegido del grupo que incluye las sustancias formadoras de películas, preferentemente hidroxipropil-metilcelulosa, propilcelulosa, metilcelulosa, polivinilalcohol, polimetacrilato y carragenato, de manera que, en su caso, están presentes otras sustancias auxiliares tales como plastificantes, lubricantes y colorantes.
14. Comprimido recubierto o granulado, fabricado según una de las reivindicaciones 1 a 5, caracterizado porque la distribución media de tamaños de grano de, como mínimo, el 80% de la sustancia activa está entre 0,05 mm y 1,0 mm, preferentemente entre 0,1 mm y 0,8 mm, y en especial entre 0,1 mm y 0,6 mm.
15. Núcleos de comprimido, según una de las reivindicaciones 6 a 14, dotados de una película de recubrimiento, que constituyen productos intermedios para la fabricación de comprimidos recubiertos, según una de las reivindicaciones 1 a 5.
16. Núcleos de granulado, según la reivindicación 15, envasados en sobres o cápsulas de gelatina.
17. Comprimidos recubiertos, fabricados mediante compresión a partir de un granulado obtenido según una de las reivindicaciones 1 a 5.
18. Utilización de monometansulfonato de imatinib en forma cristalina alfa para la fabricación de comprimidos recubiertos y granulados, según una de las reivindicaciones 1 a 5, como inhibidor de tirosin-quinasa, y como medicamento para el tratamiento de la leucemia y otras indicaciones de por sí conocidas.
Patentes similares o relacionadas:
COMPRIMIDOS DE VALSARTÁN, del 6 de Febrero de 2012, de NOVARTIS AG: Un comprimido que comprende de 20 a 65% del valsartán en forma libre y más del 30% de celulosa microcristalina en peso basándose en el peso total de los componentes […]
FORMA DE DOSIFICACIÓN DE OPIOIDES DE LIBERACIÓN CONTROLADA RESISTENTE AL ABUSO, del 14 de Junio de 2011, de ENDO PHARMACEUTICALS INC.: Una forma de dosificación oral en forma de un comprimido de liberación controlada que comprende: un agonista opioide en una matriz de liberación controlada; […]
PREPARACIONES DE LIBERACIÓN CONTROLADA DE OXCARBAZEPINA QUE TIENEN PERFIL DE LIBERACIÓN SIGMOIDAL, del 3 de Junio de 2011, de SUPERNUS PHARMACEUTICALS, INC.: Una formulación farmacéutica para administración una vez al día de oxcarbazepina constituida esencialmente por una matriz homogénea que comprende: (a) una oxcarbazepina; […]
 FORMULACIÓN EN COMPRIMIDOS DE LIBERACIÓN EXTENDIDA QUE CONTIENE PRAMIPEXOL O UNA DE SUS SALES FARMACÉUTICAMENTE ACEPTABLES, MÉTODO PARA SU FABRICACIÓN Y SU USO, del 30 de Marzo de 2011, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Una formulación en comprimidos de liberación extendida que comprende pramipexol, o su sal farmacéuticamente aceptable, en una matriz que comprende al menos […]
FORMULACIÓN EN COMPRIMIDOS DE LIBERACIÓN EXTENDIDA QUE CONTIENE PRAMIPEXOL O UNA DE SUS SALES FARMACÉUTICAMENTE ACEPTABLES, MÉTODO PARA SU FABRICACIÓN Y SU USO, del 30 de Marzo de 2011, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Una formulación en comprimidos de liberación extendida que comprende pramipexol, o su sal farmacéuticamente aceptable, en una matriz que comprende al menos […]
PREPARACIÓN FARMACÉUTICA SÓLIDA QUE COMPRENDE BENZACEPINAS, Y PROCEDIMIENTO DE PRODUCCIÓN DE LA MISMA, del 9 de Marzo de 2011, de OTSUKA PHARMACEUTICAL CO., LTD.: Preparación farmacéutica sólida que comprende: (a) 7-cloro-5-hidroxi-1-[2-metil-4-(2-metilbenzoilamino)benzoil]-2,3,4,5tetrahidro-1H-benzoacepina…
COMPOSICIÓN FARMACÉUTICA ESTABILIZADA, del 3 de Febrero de 2011, de EISAI R&D MANAGEMENT CO., LTD: Una composición farmacéutica que comprende: [2-[4-(4-cianofenil)-1,3-tiazol-2-il]-1-(2,4-difluorofenil)-1-(1H-1,2,4-triazol-1-ilmetil)propil]oxi]metil…
FORMULACIONES FARMACEUTICAS ESTABLES DE MONTELUKAST SODICO, del 13 de Julio de 2010, de TEVA PHARMACEUTICAL INDUSTRIES LTD.: Composición farmacéutica estable en forma de comprimido recubierto de película, que comprende montelukast o una sal del mismo y un excipiente […]
 COMPOSICION FARMACEUTICA SOLIDA QUE COMPRENDE IRBESARTAN, del 8 de Junio de 2010, de KRKA, D.D., NOVO MESTO: Una formulación farmacéutica sólida que comprende, como ingrediente activo, clorhidrato de irbesartan y opcionalmente hidroclorotiazida, manitol, […]
COMPOSICION FARMACEUTICA SOLIDA QUE COMPRENDE IRBESARTAN, del 8 de Junio de 2010, de KRKA, D.D., NOVO MESTO: Una formulación farmacéutica sólida que comprende, como ingrediente activo, clorhidrato de irbesartan y opcionalmente hidroclorotiazida, manitol, […]