Composiciones para reducir el peso y la grasa corporal.
Composiciones para reducir el peso y la grasa corporal.
La presente invención se refiere a una composición que comprende ácido hialurónico y sulfato de dermatano para su uso en reducir la ingesta de alimento,
inducir la sensación de saciedad, reducir el apetito, reducir el peso corporal, prevenir el aumento de peso, reducir la grasa corporal o reducir la formación de grasa, todo ello asociado al sobrepeso u obesidad en un mamífero. La composición está en forma de alimento, alimento funcional o complemento alimenticio. Además la composición puede contener hidrolizado de colágeno.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201331468.
Solicitante: BIOIBERICA, S.A..
Nacionalidad solicitante: España.
Inventor/es: ESCAICH FERRER,JOSEP, PALOU OLIVER,ANDREU, MARTINEZ PUIG,DANIEL, CHETRIT RUSSI,CARLES, BONET PIÑA,Mª Luisa, GRANADOS BORBOLLA,Nuria, REYNÉS MIRALLES,Bàrbara.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
Fragmento de la descripción:
Composiciones para reducir el peso y la grasa corporal.
Sector técnico de la invención La presente invención se refiere a composiciones para su uso en la reducción del sobrepeso o de la obesidad en un mamífero. Las composiciones pueden estar en forma de alimentos, alimentos funcionales o complementos alimenticios.
Estado de la técnica anterior
La obesidad, definida como un exceso de peso corporal en forma de grasa, es un importante factor de riesgo de desórdenes clínicos graves, entre ellos la diabetes tipo 2 y la enfermedad cardiovascular, y es un problema de incidencia creciente y difícil tratamiento que acarrea un importante gasto socio-sanitario (véase http://www.iaso.org/iotf/obesity/) . Es conocido que muchas personas con sobrepeso u obesidad desarrollan resistencia a la insulina e hiperinsulinemia, intolerancia a la glucosa, dislipidemia, e hipertensión, características que, en conjunto, conforman el llamado síndrome metabólico.
Una de las complicaciones metabólicas más frecuentes en la obesidad es la resistencia a la insulina (A. Astrup & N. Finer, Obes. Rev. 1, 57-59 (2000) ) . La conexión entre ambas condiciones ha sido ampliamente estudiada y parece deberse a que, en los individuos obesos, el tejido adiposo libera cantidades incrementadas o anormales de ácidos grasos no esterificados, hormonas (adipoquinas) y citoquinas pro-inflamatorias, entre otros factores, que favorecen la pérdida de sensibilidad a la insulina en diferentes tejidos (S.E. Kahn et al., Nature 444, 840-846 (2006) ) . La resistina, en particular, es una proteína secretada por adipocitos y/o macrófagos infiltrados en el tejido adiposo obeso que actúa como un factor pro-inflamatorio y de resistencia a la insulina, y cuyos niveles circulantes están elevados en individuos obesos (D.R. Schwartz & M.A. Lazar, Trends Endocrinol. Metab. 22, 259-265 (2011) ) . La reducción de la resistina se correlaciona con incrementos de la sensibilidad a la insulina (C.M. Steppan et al., Nature 409, 307-312 (2001) ; F. Felipe et al., Diabetes 53, 882-889 (2004) ) .
La resistencia a la insulina es clínicamente relevante porque está estrechamente asociada a la diabetes de tipo 2 y otros problemas como hipertensión, dislipidemia, y defectos en la coagulación sanguínea y la fibrinolisis, todos los cuales se relacionan a su vez con la enfermedad cardiovascular (G. Boden, Curr. Opin. Endocrinol. Diabetes Obes. 18, 139-143 (2011) ) . En general, se acepta que el defecto primario en el desarrollo de diabetes de tipo 2 es el deterioro de la sensibilidad a la insulina, al que sigue una hiperinsulinemia compensatoria, e hiperglucemia cuando los mecanismos de compensación fallan. Por tanto, la mejora de la homeostasis de la glucosa-insulina es un objetivo de salud de interés específico en sí mismo.
Las estrategias para la reducción de peso basadas únicamente en la restricción calórica y el aumento de la actividad física son difíciles de seguir, y se han mostrado ineficaces frente a la actual pandemia de obesidad. Paralelamente, hay evidencia de que nutrientes específicos y otros ingredientes alimentarios influencian procesos bioquímicos que impactan sobre el balance energético y la acumulación de grasa de manera tal que pueden favorecer un fenotipo más magro (K. H. Kim & Y. Park, Annu. Rev. Food Sci. Technol. 2, 237-257 (2011) ; C. Pico et al., Rev. Esp. Obes. 4, 156-174 (2006) ; E. M. Kovacs & D. J. Mela, Obes. Rev. 7, 59-78 (2006) ) . Esta evidencia es la base para el desarrollo de complementos alimenticios o alimentos funcionales para el control de la obesidad.
Se han definido las siguientes estrategias principales en alimentación funcional para el control de la obesidad: (i) reducción de la ingesta, vía modulación de las sensaciones de hambre y/o saciedad, o limitando la biodisponibilidad de nutrientes; (ii) reducción de la densidad calórica en alimentos light; (iii) estimulación del gasto energético mediante activación de la termogénesis adaptativa; y (iv) redireccionamiento de nutrientes hacia tejidos y vías metabólicas que los consumen, desfavoreciendo así la deposición de grasa (C. Pico et al., Rev. Esp. Obes. 4, 156174 (2006) ) . Se considera de especial interés el uso de nutrientes o combinaciones de nutrientes capaces de afectar simultáneamente a varios de estos procesos (C Pico et al., Rev. Esp. Obes. 4, 156-174 (2006) ) .
La inhibición de la adipogénesis es otra posible estrategia anti-obesidad (K. H. Kim & Y. Park, Annu. Rev. Food Sci. Technol. 2, 237-257 (2011) ) . La adipogénesis es el proceso de diferenciación de los adipocitos a partir de células precursoras, y ha sido muy estudiada principalmente en modelos celulares (B. Feve, Best Pract. Res. Clin. Endocrinol. Metab. 19, 483-499B (2005) ) . En humanos, un porcentaje considerable de los adipocitos, en torno al 10%, es renovado anualmente durante toda la vida adulta mediante la coordinación de adipogénesis de novo y muerte de adipocitos preexistentes (K. L. Spalding et al., Nature 453, 783-787 (2008) ) . Muchos individuos obesos presentan un número excesivo de adipocitos (hiperplasia) en sus depósitos adiposos, y estos individuos son especialmente refractarios a la pérdida de peso a largo plazo y propensos al conocido efecto yo-yo. El control farmacológico o nutricional de la adipogénesis emerge en este contexto como una nueva diana terapéutica en el control de la obesidad, como coadyuvante en estrategias convencionales de control del balance energético: la inhibición de la adipogénesis puede ayudar a normalizar (reducir) el número de adipocitos, y con ello al mantenimiento del peso tras la pérdida de peso (P. Arner & K. L. Spalding, Biochem. Biophys. Res. Commun. 396, 101-104 (2010) ) .
Los glicosaminoglicanos (GAGs) son biomoléculas poliméricas de elevado peso molecular formados por repeticiones de una unidad disacarídica. Se encuentran fundamentalmente en los organismos vivos, donde desarrollan diferentes funciones fisiológicas.
El ácido hialurónico es un glicosaminoglicano no sulfatado, con una estructura polimérica caracterizada por un disacárido que se repite, constituido por los monosacáridos N-acetil-D-glucosamina y ácido D-glucurónico. Es uno de los principales componentes del cartílago, de la membrana sinovial y del líquido sinovial. En particular, es importante su uso en el tratamiento de disfunciones articulares como la artrosis, generalmente por vía intraarticular. También se ha descrito su uso en oftalmología, en la cicatrización de heridas, así como en cosmética.
El sulfato de dermatano es un glicosaminoglicano sulfatado con una estructura polimérica constituida mayoritariamente por disacáridos de N-acetil-D-galactosamina sulfatada en posición 4 y ácido L-idurónico, a menudo sulfatado en posición 2. Se ha descrito que participa en la reparación de heridas y en la regulación de la coagulación de la sangre. Esta sustancia se usa en gran medida en cosmética.
El hidrolizado de colágeno está constituido por una mezcla de aminoácidos y péptidos de peso molecular bajo. Se obtiene por hidrólisis enzimática controlada de la proteína colagenosa contenida en la piel y en otros tejidos conjuntivos. Se utiliza mayoritariamente en cosmética.
La solicitud de patente US 2005084518 describe un alimento para la salud (health food) que contiene ácido hialurónico y sulfato de dermatano. Dicho alimento es útil para el embellecimiento de la piel.
En la patente US 7, 763, 594 se describe el uso de una composición de ácido hialurónico y sulfato de dermatano para tratar la artrosis.
A la vista de lo anterior, el proporcionar composiciones para el control del sobrepeso y/o de la obesidad, así como de algunas de sus complicaciones metabólicas, es un tema de enorme interés en el campo nutricional.
Explicación de la invención Los presentes inventores han encontrado que las composiciones definidas más abajo, ejercen un efecto sinérgico anti-adipogénico, incluso en presencia de un cóctel hormonal pro-adipogénico; inhiben la expresión de resistina (adipoquina relacionada con la resistencia a la insulina) ; reducen la ganancia de peso y la ingesta energética acumulada en ratones alimentados ad libitum; reducen la insulinemia y la trigliceridemia en ratones; y provocan la pérdida de peso y de grasa, así como ganancia de masa grasa, en ratones obesos. Por ello, las referidas composiciones pueden ser utilizadas en forma de alimento, alimento funcional o complemento alimenticio en reducir la ingesta de alimento, inducir la sensación de saciedad, reducir el apetito, reducir el peso corporal, prevenir el aumento de peso, reducir la grasa corporal, reducir la formación de grasa, reducir el colesterol en sangre, mantener los niveles normales...
Reivindicaciones:
1. Uso de una composición que comprende ácido hialurónico y sulfato de dermatano para la preparación de un alimento, un alimento funcional o un complemento alimenticio para reducir la ingesta de alimento, inducir la sensación de saciedad, reducir el apetito, reducir el peso corporal, prevenir el aumento de peso, reducir la grasa corporal o reducir la formación de grasa, todo ello asociado al sobrepeso u obesidad en un mamífero.
2. Uso según la reivindicación 1 para reducir la ingesta de alimento, inducir la sensación de saciedad o reducir el apetito.
3. Uso según la reivindicación 1 para reducir el peso corporal o prevenir el aumento de peso.
4. Uso según la reivindicación 1 para reducir la grasa corporal o reducir la formación de grasa.
5. Uso según una cualquiera de las reivindicaciones 1 a 4, en el que la composición comprende ácido hialurónico y sulfato de dermatano presentes en una relación en peso ácido hialurónico a sulfato de dermatano comprendida entre 1:0, 05 y 1:0, 75, preferentemente entre 1:0, 10 y 1:0, 50.
6. Uso según la reivindicación 5, en el que la composición comprende ácido hialurónico y sulfato de dermatano presentes en una relación en peso ácido hialurónico a sulfato de dermatano de 1:0, 25.
7. Uso según una cualquiera de las reivindicaciones 1 a 6, en el que la composición además comprende hidrolizado de colágeno.
8. Uso según la reivindicación 7, en el que la composición comprende ácido hialurónico, sulfato de dermatano e hidrolizado de colágeno presentes en una relación en peso ácido hialurónico a sulfato de dermatano a hidrolizado de colágeno comprendida entre 1:0, 06:0, 03 y 1:0, 80:0, 40, preferentemente entre 1:0, 10:0, 05 y 1:0, 40:0, 20.
9. Uso según la reivindicación 8, en el que la composición comprende ácido hialurónico, sulfato de dermatano e hidrolizado de colágeno presentes en una relación en peso ácido hialurónico a sulfato de dermatano a hidrolizado de colágeno de 1:0, 20:0, 10.
10. Uso según una cualquiera de las reivindicaciones 1 a 9, donde el mamífero tiene obesidad o sobrepeso asociado al síndrome metabólico.
11. Uso según una cualquiera de las reivindicaciones 1 a 10, donde el mamífero es un humano.
12. Uso según una cualquiera de las reivindicaciones 1 a 11, donde la composición se adapta para la administración oral.
X200
FIGURA 1
A) 1, 25
1, 00
PPAR mRNA/ l-actina mRNA 0, 50 0, 75
0, 25
0, 00 vehículo HA DS CS HA80+DS20
B) 1, 25
1, 00
C/EBPa mRNA/ l-actina mRNA 0, 50 0, 75
0, 25
0, 00 vehículo HA DS CS HA80+DS20
C) 1, 50
1, 25
FAS mRNA/ l-actina mRNA 0, 50 0, 75 1, 00
0, 25
0, 00 vehículo HA DS CS HA80+DS20
FIGURA 2
A)
1, 40 1, 20 1, 00
PPARy mRNA/ 0, 80 l-actina mRNA
0, 60 0, 40 0, 20 0, 00
vehículo HA DS HA80+DS20 B)
1, 20
1, 00
0, 80
C/EBPa mRNA/ 0, 60 l-actina mRNA
0, 40
0, 20
0, 00 vehículo HA DS HA80+DS20
C)
1, 75 1, 50 1, 25 1, 00
FAS mRNA/ l-actina mRNA 0, 75
*
0, 50 0, 25 0, 00 vehículo HA DS HA80+DS20
FIGURA 3
resistina mRNA/ -actina mRNA
FIGURA 4
ingesta acumulada (Kcal/animal)
FIGURA 5 1700 1600 1500 1400 1300 1200 1100 1000
1 1, 2
0 0, 2 0, 4 0, 6 0, 8 0 25 50 75 100 125 150 175 200 225
Concentración final (!g/mL) de HA+DS (relación en peso 1:0, 25)
Control HA+DS+CH
A) 8
6 glucosa5 circulante 4 (mM)
2 1 0
B) 1, 2 1, 0 0, 8
insulina circulante 0, 6 (!g/L)
0, 4
0, 2
0, 0
C) 8, 0 7, 0 6, 0 5, 0
HOMA-IR 4, 0 3, 0 2, 0 1, 0 0, 0
FIGURA 6
Control HA+DS+CH
Control HA+DS+CH
Control HA+DS+CH
triacilglicerolescirculantes (mg/mL)
15, 0 12, 5 10, 0 7, 5 5, 0 2, 5 0, 0
Control HA+DS+CH
FIGURA 7
A) B)
tiempo (días)
Pérdida de masa grasa (%)
-
-
-
- 14
P=0, 132
2 0 -10
-
tiempo (días)
FIGURA 8
A)
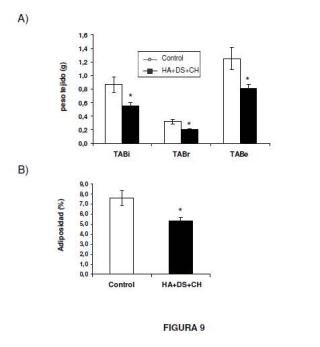
TABi TABr TABe B)
Adiposidad (%)
9, 0 8, 0 7, 0 6, 0 5, 0 4, 0 3, 0 2, 0 1, 0 0, 0
Control HA+DS+CH
FIGURA 9
A)
B)
FIGURA 10
insulina circulante (!g/L) glucosa circulante (mM)
8 7 6 5 4 3 2 1 0
2, 5
2, 0
1, 5
1, 0
0, 5
0, 0
Control
Control HA+DS+CH
HA+DS+CH
Patentes similares o relacionadas:
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Métodos y composiciones para trastornos relacionados con la proliferación celular, del 27 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un método in vitro para diagnosticar a un sujeto que tiene un trastorno relacionado con la proliferación celular o que se sospecha que tiene un trastorno relacionado con […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]
Inhibidores de ERK y sus usos, del 8 de Abril de 2020, de Celgene CAR LLC: Un compuesto de fórmula VIII: **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: el anillo A se selecciona de **(Ver fórmula)** […]
Procedimiento de uso de inmunoconjugados anti-CD79b, del 8 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Un inmunoconjugado que comprende un anticuerpo anti-CD79b unido a un agente citotóxico para su uso en un procedimiento para tratar un trastorno proliferativo […]
IMIPRAMINA PARA USO COMO INHIBIDOR DE LA SOBREXPRESIÓN DE LA FASCINA 1, del 2 de Abril de 2020, de FUNDACION UNIVERSITARIA SAN ANTONIO: La presente invención se refiere a imipramina para su uso como inhibidor de la sobreexpresión de la fascina 1, preferiblemente dicha sobreexpresión de la fascina 1 está asociada […]
Mutación novedosa del receptor de andrógenos, del 25 de Marzo de 2020, de NOVARTIS AG: Una composicion terapeutica para su uso en el tratamiento de un paciente que padece cancer de prostata o de mama, asociado con una mutacion del receptor de […]
Composiciones y métodos para la distribución de moléculas en células vivas, del 25 de Marzo de 2020, de THE TEXAS A & M UNIVERSITY SYSTEM: Un compuesto que tiene la fórmula: **(Ver fórmula)** En donde X es un resto de unión, Y es un residuo de aminoácido acoplado de forma covalente […]