Composiciones farmacéuticas de rifaximina.
Una composición farmacéutica de liberación controlada oral que comprende un comprimido multicapa en el que almenos una capa consiste en un polímero de control de la liberación y rifaximina o sal/es farmacéuticamenteaceptable/s o enantiómero/s o polimorfo/s de la misma y al menos una capa consiste en un polímero bioadhesivo,
enel que cada capa incluye uno o más excipientes.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E08252198.
Solicitante: LUPIN LTD.
Nacionalidad solicitante: India.
Dirección: 159, CST ROAD KALINA, SANTACRUZ (EAST) MUMBAI, MAHARASHTRA 400 098 INDIA.
Inventor/es: JAHAGIRDAR,HARSHAL ANIL, KULKARNI,RAJESH, KULKARNI,SHIRISHKUMAR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piridinas no condensadas; Sus derivados hidrogenados.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
PDF original: ES-2389358_T3.pdf
Fragmento de la descripción:
Composiciones farmacéuticas de rifaximina.
Campo de la invención
La presente invención se refiere a composiciones farmacéuticas de rifaximina para controlar la liberación y/o aumentar el tiempo de residencia en el tracto gastrointestinal y el procedimiento de preparación de las mismas.
Antecedentes de la invención
El antibiótico rifaximina se desveló originariamente en Italia como la patente IT 1154655. La patente de Estados Unidos Nº 4.341.785 de Marchi y col. relacionada desvela derivados de imidazo-rifamicina que tienen utilidad antibacteriana, y el procedimiento relacionado para prepararla. El documento US '785 también desvela una composición antibacteriana farmacéutica y un procedimiento de uso de la misma para tratar enfermedades antibacterianas del tracto gastrointestinal (GIT) .
El documento WO 2006/094737 desvela microgránulos recubiertos entéricos de rifaximina y su uso en el tratamiento de enfermedades inflamatorias del intestino.
La rifaximina es esencialmente un antibiótico semi-sintético, no sistémico, no absorbible relacionado con la rifamicina. El espectro antimicrobiano (in vitro) incluye principalmente bacterias Gram-positivas y Gram-negativas; y tanto aerobias como anaerobias. La rifaximina ha sido autorizada en varios países para el tratamiento de patologías cuya etiología es en parte o totalmente debida a infecciones agudas y crónicas intestinales sostenidas por bacterias Gram-positivas y Gram-negativas, con síndromes de diarrea, flora microbiana intestinal alterada, episodios similares a diarrea estival, diarrea del viajero y enterocolitis; profilaxis antes y después de la cirugía de las complicaciones infecciosas en la cirugía gastrointestinal; y terapia para la hiperamonemia como coadyuvante. Se ha encontrado que el fármaco no tiene efectos secundarios significativos.
La rifaximina se comercializa actualmente como comprimidos a la dosificación de 200 mg para diarrea del viajero bajo el nombre de marca “Xifaxan®”.
La administración de fármacos por vía oral es la vía más preferible para tomar medicaciones. Sin embargo, en la administración por vía oral, el vaciamiento del estómago normal o patológico y los movimientos peristálticos intestinales limitan el tiempo durante el cual una forma de dosificación de liberación de fármaco permanece en el tracto gastrointestinal o en el sitio de acción requerido. Como el fármaco está actuando localmente debe permanecer en el sitio de acción / en el GIT durante el periodo de tiempo suficiente. Específicamente, durante afecciones patológicas tales como diarrea, el movimiento peristáltico del tracto GI aumenta. Por tanto, el tiempo del tránsito GI de formas de dosificación es menor que el normal. De ahí que formas de dosificación convencionales tengan un tiempo de residencia más corto en el sitio de acción requerido y no necesiten dosificarse frecuentemente con el fin de ser terapéuticamente eficaces. Un enfoque lógico para resolver este problema y para mejorar los perfiles farmacodinámicos es retener el depósito de fármaco en el sitio de acción, y liberar el fármaco de una forma controlada, durante un periodo de tiempo controlado. Los inventores han desarrollado ahora una forma de dosificación de liberación controlada y/o mucoadhesiva de rifaximina, que sorprendentemente prolonga el tiempo de residencia GI de la rifaximina.
Objetos de la invención
Un objeto de la invención es producir una composición farmacéutica en forma de un comprimido multicapa que comprende, a) al menos una capa que comprende una cantidad terapéuticamente eficaz de rifaximina
o sal (es) farmacéuticamente aceptable (s) o enantiómero (s) o polimorfo (s) de la misma, excipiente (s) farmacéuticamente aceptable (s) ; en la que dicha capa proporciona una rifaximina de liberación controlada; y b) al menos otra capa que proporciona un aumento del tiempo de residencia de la forma de dosificación en el tracto gastrointestinal.
Otro objeto de la invención es proporcionar una composición farmacéutica que comprende rifaximina usada para aumentar la conformidad del paciente para tratamiento de diarrea del viajero, encefalopatía hepática, diarrea infecciosa, enfermedad diverticular, un profiláctico antibacteriano antes de cirugía del colon, síndrome del intestino irritable, enfermedad de Crohn, diarrea asociada a Clostridum difficile, crecimiento bacteriano del intestino delgado, profilaxis de la diarrea del viajero, disentería, pouchitis, enfermedad por úlcera peptídica, profilaxis quirúrgica y dispepsia gástrica.
Otro objeto de la invención es proporcionar una composición farmacéutica que comprende rifaximina usada para aumentar la conformidad del paciente para el tratamiento de diarrea del viajero.
Descripción detallada de la invención
La presente invención se refiere a una composición farmacéutica de liberación controlada oral según la reivindicación 1.
La presente invención se refiere adicionalmente a una composición farmacéutica de liberación controlada oral según la reivindicación 1, en la que la composición se formula para aumentar el tiempo de residencia de la rifaximina en el tracto gastrointestinal.
“Cantidad terapéuticamente eficaz” significa que la cantidad de agente activo que detiene o reduce el progreso de la afección que se trata o se cura de otro modo completamente o parcialmente o actúa paliativamente sobre la afección. Un experto en la materia puede determinar fácilmente una cantidad tal por experimentación rutinaria y con excesiva carga.
“Liberación controlada” significa un sistema de administración de fármaco que libera el fármaco a una velocidad predeterminada, local o sistémicamente, durante un periodo de tiempo especificado. La liberación controlada puede usarse indistintamente con liberación prolongada, liberación programa, liberación diferida, liberación sostenida y otras formas de dosificación similares.
“Opcional” u “opcionalmente” significa que la circunstancia posteriormente descrita puede o puede no producirse, de manera que la descripción incluye casos en los que la circunstancia se produce y casos en los que no se produce.
Por “farmacéuticamente aceptable” se indica un vehículo que comprende un material que es no biológicamente o de otro modo no deseable.
“Entidades” o “entidad” pueden usarse indistintamente con gránulos, pellas, perlas, minicomprimidos y similares.
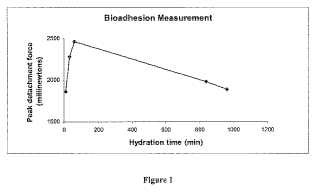
“Bioadhesión” se define como la capacidad de un material para adherirse a un tejido biológico durante un periodo de tiempo prolongado. La bioadhesión es una solución al problema de tiempo de residencia inadecuado resultante del vaciamiento del estómago y peristalsis intestinal, y del desplazamiento por movimiento ciliar. Las propiedades bioadhesivas de polímeros están afectadas tanto por la naturaleza del polímero como por la naturaleza de los medios de alrededor.
Bioadhesivo y mucoadhesivo pueden usarse indistintamente.
“Aumento del tiempo de residencia” para el fin de la presente invención, el tiempo de residencia es el tiempo requerido para que una forma de dosificación farmacéutica transite por el estómago al recto, es decir, las formas de dosificación farmacéuticas de la invención pueden tener un aumento del tiempo de retención en el estómago y/o intestino delgado y/o grueso, o en el área del tracto gastrointestinal que es el sitio de acción o absorción del fármaco contenido en la forma de dosificación farmacéutica. Por ejemplo, formas de dosificación farmacéuticas de la invención pueden ser retenidas en el intestino delgado (o una o dos porciones del mismo, seleccionadas del duodeno, el yeyuno y el íleon) . Estas formas de dosificación farmacéuticas como un todo pueden incluir un recubrimiento de liberación controlada o bioadhesivo que se aplica a al menos una superficie de la forma de dosificación.
En la presente invención, el aumento en el tiempo de residencia de la formulación de rifaximina en el tracto gastrointestinal se logra por la bioadhesión, lográndose la bioadhesión usando polímeros que tienen afinidad por la mucosa gastrointestinal. Ejemplos de mucoadhesivos para su uso en las realizaciones desveladas en este documento incluyen, pero sin limitación, polímeros naturales, semisintéticos... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica de liberación controlada oral que comprende un comprimido multicapa en el que al menos una capa consiste en un polímero de control de la liberación y rifaximina o sal/es farmacéuticamente aceptable/s o enantiómero/s o polimorfo/s de la misma y al menos una capa consiste en un polímero bioadhesivo, en el que cada capa incluye uno o más excipientes.
2. La composición farmacéutica de liberación controlada oral según la reivindicación 1, en la que la composición se formula para aumentar el tiempo de residencia de la rifaximina en el tracto gastrointestinal.
3. La composición farmacéutica de liberación controlada oral según la reivindicación 2, en la que el aumento en el tiempo de residencia de la formulación de rifaximina en el tracto gastrointestinal se logra por bioadhesión.
4. La composición farmacéutica de liberación controlada oral según la reivindicación 1, en la que la bioadhesión se logra con polímeros que tienen afinidad por la mucosa gastrointestinal seleccionados de policarbófilos, carbómeros, lectinas, pectina, zeína, zeína modificada, caseína, gelatina, gluten, albúmina de suero, colágeno, quitosano, oligosacáridos y polisacáridos tales como celulosa, sus derivados tales como metilcelulosa, etilcelulosa, hidroxipropilcelulosa, hidroxipropilmetilcelulosa, hidroxibutilmetilcelulosa, acetato de celulosa, propionato de celulosa, acetato-butirato de celulosa, acetato-ftalato de celulosa, carboximetilcelulosa, triacetato de celulosa, sal de sodio de sulfato de celulosa, dextranos, polisacárido de la semilla del tamarindo, gelano, carragenina; ácido hialurónico, ácido polihialurónico, ácido algínico, alginato de sodio; gomas como goma de xantano, goma guar, goma arábiga, goma de semilla de algarroba; poli (acetato de vinilo) , poli (alcohol vinílico) , povidona/poli (óxido de etileno) , ácido acrílico y metacrílico, sus copolímeros, poliamidas, policarbonatos, polialquilenos, polialquilenglicoles, poli (óxidos de alquileno) , poli (tereftalatos de alquileno) , poli (alcoholes vinílicos) , poli (éteres vinílicos) , poli (ésteres vinílicos) , poli (haluros de vinilo) , polivinilpirrolidona, poliglicolidas, polisiloxanos, poliuretanos, poliestireno, polímeros de ésteres acrílicos y metacrílicos, polilactidas, poli (ácido butírico) , poli (ácido valérico) , poli (lactida-co-glicolida) , polianhídridos, poliortoésteres, poli (ácido fumárico) , poli (ácido maleico) , polímeros que tienen un esqueleto hidrófobo con al menos un grupo hidrófilo colgante del esqueleto, polímeros que tienen un esqueleto hidrófobo con al menos un grupo hidrófobo colgante del esqueleto, y mezclas y copolímeros o mezclas de los mismos.
5. La composición farmacéutica de liberación controlada oral según la reivindicación 1, en la que los polímeros de control de la liberación comprenden polímero de control de la tasa hidrófilo o polímero de control de la tasa hidrófobo y combinaciones de los mismos.
6. La composición farmacéutica de liberación controlada oral según la reivindicación 5, en la que el polímero de control de la tasa hidrófilo se selecciona de hidratos de carbono como celulosas tales como etilcelulosa, hidroxipropilcelulosa, hidroxipropilmetilcelulosa, hidroxipropiletilcelulosa; gomas como goma de xantano, goma guar, goma de semilla de algarroba; alginatos; carbómero; poli (acetato de vinilo) , poli (alcohol vinílico) , povidona/poli (óxido de etileno) , copolímeros de ácido acrílico y metacrílico o mezclas de los mismos.
7. La composición farmacéutica de liberación controlada oral según la reivindicación 1, que comprende además agente/s solubilizante/s seleccionado/s de tensioactivo/s tal/es como agentes tensioactivos no iónicos solubles en agua o dispersables en agua, no iónicos semi-polares, aniónicos, catiónicos, anfóteros o de ión bipolar; ciclodextrina y sus derivados; sustancias lipófilas; vitamina E y sus derivados; ésteres de alcoholes monohidroxilados tales como citratos de trialquilo, lactonas y ésteres de ácidos grasos de alcoholes inferiores; disolventes que contienen nitrógeno; fosfolípidos; acetatos de glicerol tales como acetina, diacetina y triacetina; ésteres de ácidos grasos de glicerol tales como mono-, di-y triglicéridos y mono-y diglicéridos acetilados; ésteres de propilenglicol; ésteres de etilenglicol o cualquier combinación de los mismos.
8. La composición farmacéutica de liberación controlada oral según la reivindicación 1, en la que los excipientes farmacéuticamente aceptables se seleccionan de aglutinantes, diluyentes, lubricantes, tensioactivos o deslizantes.
9. La composición farmacéutica de liberación controlada oral según la reivindicación 8, en la que el aglutinante es uno o más seleccionados de hidratos de carbono como celulosas; almidones; gomas; polivinilpirrolidona, povidona, jarabe, poli (óxido de etileno) , poliacrilamida, poli-N-vinilamida, carboximetilcelulosa de sodio, polietilenglicol, gelatina, poli (óxido de etileno) , polipropilenglicol, tragacanto, ácido algínico o combinaciones de los mismos.
10. La composición farmacéutica de liberación controlada oral según la reivindicación 8, en la que el diluyente es uno o más seleccionados de hidratos de carbono, derivados de hidratos de carbono, polioles, alcoholes de azúcar, sales de carbonato, sulfato o fosfato de metales inorgánicos o mezclas de los mismos.
11. La composición farmacéutica de liberación controlada oral según la reivindicación 8, en la que el lubricante es uno o más seleccionados de estearato de magnesio, aluminio, cinc o calcio, estearilfumarato de sodio, polietilenglicol, aceite mineral, ácido esteárico, aceite vegetal hidrogenado, behenato de glicerilo, palmitoestearato de glicerilo, estearato de glicerilo, almidón de maíz, talco, silicato de calcio, silicato de magnesio, dióxido de silicio coloidal, hidrogel de silicio o mezclas de los mismos.
12. La composición farmacéutica de liberación controlada oral según la reivindicación 8, en la que el tensioactivo es uno o más seleccionados de tensioactivos iónicos o no iónicos o de ión bipolar.
13. La composición farmacéutica de liberación controlada oral según la reivindicación 8, en la que el deslizante es uno o más seleccionados de dióxido de silicio, sílice coloidal, celulosa en polvo, talco, fosfato de calcio tribásico o mezclas de los mismos.
14. La composición farmacéutica de liberación controlada oral según la reivindicación 1 es una forma de dosificación de una vez al día.
15. La composición farmacéutica de liberación controlada oral según la reivindicación 1 es una forma de dosificación de una vez al día que comprende de 20 a 2400 mg de rifaximina.
16. La composición farmacéutica de liberación controlada oral según la reivindicación 1 es una forma de dosificación de una vez al día que comprende 550 mg de rifaximina.
17. La composición farmacéutica de liberación controlada oral según la reivindicación 1 es una forma de dosificación de una vez al día que comprende 600 mg de rifaximina.
18. La composición farmacéutica de liberación controlada oral según la reivindicación 1 para aumentar la conformidad del paciente para el tratamiento de diarrea del viajero, encefalopatía hepática, diarrea infecciosa, enfermedad diverticular, un profiláctico antibacteriano antes de cirugía del colon, síndrome del intestino irritable, enfermedad de Crohn, diarrea asociada a Clostridum difficile, crecimiento bacteriano del intestino delgado, profilaxis de la diarrea del viajero, disentería, pouchitis, enfermedad por úlcera peptídica, profilaxis quirúrgica y dispepsia gástrica.
19. La composición farmacéutica de liberación controlada oral según la reivindicación para el uso en el tratamiento de diarrea del viajero, encefalopatía hepática, diarrea infecciosa, enfermedad diverticular, un profiláctico antibacteriano antes de cirugía del colon, síndrome del intestino irritable, enfermedad de Crohn, diarrea asociada a Clostridum difficile, crecimiento bacteriano del intestino delgado, profilaxis de la diarrea del viajero, disentería, pouchitis, enfermedad por úlcera peptídica, profilaxis quirúrgica y dispepsia gástrica.
20. La composición farmacéutica de liberación controlada oral según la reivindicación 1 para su uso en el tratamiento de diarrea del viajero.
21. La composición farmacéutica de liberación controlada oral según la reivindicación 1 para su uso en el tratamiento de diarrea del viajero producida por E. coli.
22. La composición farmacéutica de liberación controlada oral según la reivindicación 14 para su uso en el tratamiento de diarrea del viajero inducida por Klebsiella.
23. La composición farmacéutica de liberación controlada oral según la reivindicación 1 está adicionalmente recubierta, incluyendo el recubrimiento un recubrimiento de película, recubrimiento de azúcar, recubrimiento entérico, recubrimiento bioadhesivo o mucoadhesivo.
24. La composición farmacéutica de liberación controlada oral según la reivindicación 23, en la que la capa de recubrimiento comprende agentes de recubrimiento, plastificantes, agentes antiadherentes, tensioactivos, agentes colorantes, opacificantes o mezclas de los mismos.
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Procedimiento de compuestos antifúngicos, del 22 de Julio de 2020, de NQP 1598, Ltd: Procedimiento para preparar un compuesto de fórmula 5 ó 5*, o una mezcla de los mismos: **(Ver fórmula)** comprendiendo el método: (a) hacer reaccionar un compuesto […]
Productos terapéuticos basados en la lantionina sintetasa 2 tipo C, del 15 de Julio de 2020, de LANDOS BIOPHARMA, INC: Un compuesto de la fórmula: **(Ver fórmula)** o una sal o éster farmacéuticamente aceptable de este, en donde: Q es piperazina-1,4-diilo; […]
Derivados de piperidina en calidad de inhibidores de HDAC1/2, del 8 de Julio de 2020, de Regenacy Pharmaceuticals, Inc: Un compuesto de Fórmula IIIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde R1 se selecciona del grupo que consiste […]
Compuestos orgánicos, del 17 de Junio de 2020, de INTRA-CELLULAR THERAPIES, INC: Un compuesto de Fórmula I: **(Ver fórmula)** en forma libre o de sal, donde: R1 y R2 son independientemente H o alquilo C1-4 (por ejemplo, metilo o […]
Compuestos ahorradores de PPAR para el tratamiento de enfermedades metabólicas, del 3 de Junio de 2020, de Metabolic Solutions Development Company LLC (100.0%): Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: cada uno de R1 y R2 se selecciona independientemente entre […]
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Nuevos usos terapéuticos de derivados de la bencilidenguanidina para el tratamiento de proteopatías, del 20 de Mayo de 2020, de InFlectis BioScience: Compuesto de la fórmula (I), o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** o un tautómero de los mismos donde: […]