COMPOSICIONES DE OXICODONA DE LIBERACION CONTROLADA.
Forma de dosificación de clorhidrato de oxicodona de liberación controlada para administración oral a pacientes humanos,
que comprende entre 10 mg y 40 mg de clorhidrato de oxicodona, que comprende
una matriz de liberación controlada, que comprende
- clorhidrato de oxicodona, y
- un material de matriz de liberación controlada,
en la que los materiales de la matriz de liberación controlada incluidos en la forma de dosificación de liberación controlada se seleccionan del grupo consistente en ácidos grasos, alcoholes grasos, gliceril ésteres de ácidos grasos, aceites vegetales y ceras, y en la que la forma de dosificación proporciona una disolución in vitro de la forma de dosificación, cuando se mide por el Método de las Paletas de la USP a 100 rpm en 900 ml de tampón acuoso (pH entre 1,6 y 7,2) a 37ºC, de entre el 12,5% y el 42,5% (en peso) de clorhidrato de oxicodona liberado después de 1 hora, entre el 25% y el 56% (en peso) de clorhidrato de oxicodona liberado después de 2 horas, entre el 45% y el 75% (en peso) de clorhidrato de oxicodona liberado después de 4 horas y entre el 55% y el 85% (en peso) de clorhidrato de oxicodona liberado después de 6 horas, siendo la liberación in vitro independiente con respecto al pH
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07100188.
Solicitante: NAPP PHARMACEUTICAL HOLDINGS LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: CAMBRIDGE SCIENCE PARK MILTON ROAD,CAMBRIDGE CB4 OGW.
Inventor/es: OSHLACK, BENJAMIN, CHASIN, MARK, MINOGUE, JOHN JOSEPH, KAIKO, ROBERT FRANCIS.
Fecha de Publicación: .
Fecha Solicitud PCT: 25 de Noviembre de 1992.
Fecha Concesión Europea: 6 de Enero de 2010.
Clasificación Internacional de Patentes:
- A61K31/485 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Derivados del morfinano, p. ej. morfina, codeína.
- A61K9/20H4
- A61K9/20H6B
- A61K9/20H6F2
Clasificación PCT:
- A61K31/485 A61K 31/00 […] › Derivados del morfinano, p. ej. morfina, codeína.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
- A61P25/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Analgésicos que actúan sobre el sistema nervioso central, p.ej. opioides.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda.
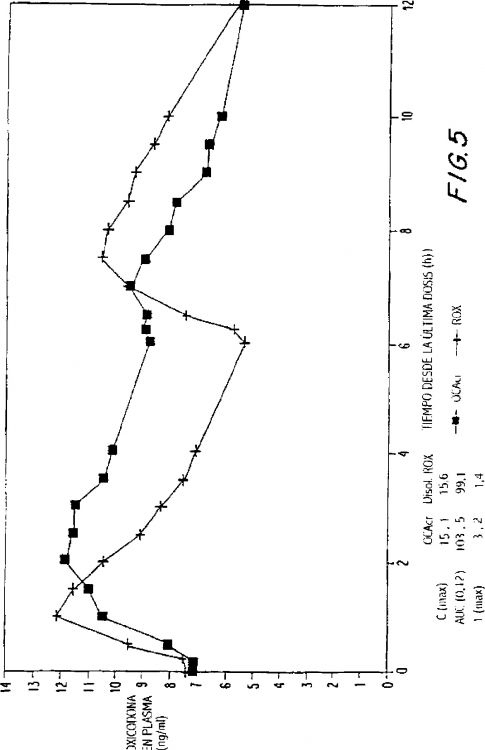
Fragmento de la descripción:
Composiciones de oxicodona de liberación controlada.
Antecedentes de la invención
Los estudios de las dosificaciones diarias de analgésicos opioides requeridas para controlar el dolor sugieren que se requiere un margen de dosificaciones diarias que abarca aproximadamente ocho veces el límite inferior para controlar el dolor en aproximadamente el 90% de los pacientes. Este margen extraordinariamente amplio en la dosificación adecuada hace que el proceso de titulación consuma particularmente mucho tiempo y muchos recursos, al mismo tiempo que deja al paciente sin un control aceptable del dolor durante un periodo de tiempo inaceptablemente largo.
Habitualmente, en el tratamiento del dolor con analgésicos opioides, se ha observado y se han obtenido informes sobre la existencia de una variación interindividual considerable en la respuesta a una dosis determinada de un medicamento determinado, y, por lo tanto, una variabilidad considerable entre pacientes en la dosificación del analgésico opioide requerido para controlar el dolor sin efectos secundarios inaceptables. Esta situación requiere un esfuerzo considerable por parte de los médicos clínicos a la hora de establecer la dosis adecuada en un paciente individual a través del proceso de titulación de larga duración, el cual requiere una valoración cuidadosa de efectos tanto terapéuticos como secundarios y unos ajustes de la dosificación durante un periodo de días y a veces más tiempo antes de que se determine la dosificación adecuada. La 3ª edición de Principies of Analgesic Use in the Treatment of Acute Pain and Cáncer Pain de la American Pain Society explica que se debería "saber que la dosis óptima del analgésico varía ampliamente entre pacientes. Los estudios han demostrado que en todos los grupos de edades, existe una variabilidad enorme en las dosis de opioides requeridas para proporcionar alivio, incluso entre pacientes vírgenes a los opioides con lesiones quirúrgicas idénticas.... Esta gran variabilidad subraya la necesidad de recetar analgésicos que incluyen la previsión de dosis suplementarias, y de utilizar bolos e infusiones intravenosos para proporcionar un alivio rápido del dolor severo... Aplíquese un ensayo adecuado a cada analgésico mediante una titulación de la dosis... antes de cambiar a otro medicamento".
Por esta razón, un tratamiento con analgésicos opioides que controle aceptablemente el dolor durante un margen de dosificación diaria sustancialmente menor mejoraría sustancialmente la eficacia y la calidad del tratamiento del dolor.
En la técnica se ha sabido anteriormente que en una matriz adecuada se podían preparar composiciones de liberación controlada de analgésicos opioides tales como morfina, hidromorfona o sales de las mismas. Por ejemplo, la patente U.S. n.º 4.990.341 (Goldie), transferida también al cesionario de la presente invención, describe composiciones de hidromorfona en las que la velocidad de disolución in vitro de la forma de dosificación, medida con el Método de las Paletas de la USP a 100 rpm en 900 ml de tampón acuoso (pH entre 1,6 y 7,2) a 37ºC, está comprendida entre el 12,5 y el 42,5% (en peso) de hidromorfona liberada después de 1 hora, entre el 25 y el 55% (en peso) liberada después de 2 horas, entre el 45 y el 75% (en peso) liberada después de 4 horas y entre el 55 y el 85% (en peso) liberada después de 6 horas.
El documento EP 253 104 A da a conocer una formulación que comprende 9,2 mg de base libre de oxicodona.
Resumen de la invención
Es un objetivo de la presente invención proporcionar un método para mejorar sustancialmente la eficacia y la calidad del tratamiento del dolor.
Es otro objetivo de la presente invención proporcionar una formulación analgésica opioide que mejora sustancialmente la eficacia y la calidad del tratamiento del dolor.
Es otro objetivo de la presente invención proporcionar un método y una(s) formulación(es) que reducen sustancialmente el margen de aproximadamente ocho veces el límite inferior de las dosificaciones diarias requeridas para controlar el dolor en aproximadamente el 90% de los pacientes.
Es otro objetivo de la presente invención proporcionar un método y una(s) formulación(es) que reducen sustancialmente la variabilidad en las dosificaciones diarias y los requisitos de las formulaciones necesarios para controlar el dolor en sustancialmente todos los pacientes.
Es todavía otro objetivo de la presente invención proporcionar un método para reducir sustancialmente el tiempo y los recursos necesarios para titular pacientes que requieren un alivio del dolor con analgésicos opioides.
Es todavía otro objetivo de la presente invención proporcionar formulaciones opioides de liberación controlada que tienen una variación interindividual sustancialmente menor con respecto a la dosis de analgésico opioide requerida para controlar el dolor sin efectos secundarios inaceptables.
Los objetivos anteriores y otros se consiguen gracias a la presente invención, que se refiere a una forma de dosificación oral sólida de liberación controlada, comprendiendo la forma de dosificación de unos 10 a unos 40 mg de HCL de oxicodona en una matriz en la que la velocidad de disolución in vitro de la forma de dosificación, cuando se mide por el Método de las Paletas de la USP a 100 rpm en 900 ml de tampón acuoso (pH de entre 1,6 y 7,2) a 37ºC está comprendida entre 12,5 y 42,5% (en peso) de oxicodona liberada después de 1 hora, entre 25 y 56% (en peso) de oxicodona liberada después de 2 horas, entre 45 y 75% (en peso) de oxicodona liberada después de 4 horas y entre 55 y 85% (en peso) de oxicodona liberada después de 6 horas, siendo la velocidad de liberación in vitro sustancialmente independiente con respecto al pH, según se define en la reivindicación 1.
El Método de las Paletas de la USP es el Método de las Paletas descrito, por ejemplo, en la Farmacopea XXII de U.S. (1990).
En la presente memoria descriptiva, "sustancialmente independiente con respecto al pH" significa que la diferencia, en cualquier momento determinado, entre la cantidad de oxicodona liberada con, por ejemplo, un pH 1,6, y la cantidad liberada con cualquier otro pH, por ejemplo, pH 7,2 (medida in vitro utilizando el Método de las Paletas de la USP a 100 rpm en 900 ml de tampón acuoso), es del 10% (en peso) o menor. En todos los casos, las cantidades liberadas son una media de por lo menos tres experimentos.
La presente invención se refiere además a un método para reducir sustancialmente el margen de las dosificaciones diarias requeridas para controlar el dolor en aproximadamente el 90% de pacientes, que comprende la administración de una formulación de dosificación sólida y oral de liberación controlada que comprende entre aproximadamente 10 y aproximadamente 40 mg de HCL de oxicodona, proporcionando dicha formulación una concentración plasmática media máxima de oxicodona de entre aproximadamente 6 y aproximadamente 60 ng/ml desde una media de aproximadamente 2 a aproximadamente 4,5 horas después de la administración, y una concentración plasmática media mínima de entre aproximadamente 3 y aproximadamente 30 ng/ml desde una media de aproximadamente 10 a aproximadamente 14 horas después de una administración repetida "q12h" (es decir, cada 12 horas) en condiciones de estado de equilibrio.
La presente invención se refiere además a un método para reducir sustancialmente el margen de las dosificaciones diarias requeridas para controlar el dolor en sustancialmente todos los pacientes, que comprende la administración de una formulación de dosificación sólida y oral de liberación controlada que comprende hasta aproximadamente 160 mg de HCL de oxicodona, proporcionando dicha formulación una concentración plasmática media máxima de oxicodona de hasta aproximadamente 240 ng/ml desde una media de hasta aproximadamente 2 a aproximadamente 4,5 horas después de la administración, y una concentración plasmática media mínima de hasta aproximadamente 120 ng/ml desde una media de aproximadamente 10 a aproximadamente 14 horas después de una administración repetida "q12h" (es decir, cada 12 horas) en condiciones de estado de equilibrio.
La presente invención se refiere además a formulaciones de oxicodona de liberación controlada que comprenden entre aproximadamente 10 y aproximadamente 40 mg de HCL de oxicodona, proporcionando dichas formulaciones una concentración plasmática media máxima de oxicodona de entre aproximadamente 6 y aproximadamente 60 ng/ml desde una media de aproximadamente 2 a...
Reivindicaciones:
1. Forma de dosificación de clorhidrato de oxicodona de liberación controlada para administración oral a pacientes humanos, que comprende entre 10 mg y 40 mg de clorhidrato de oxicodona, que comprende
una matriz de liberación controlada, que comprende
en la que los materiales de la matriz de liberación controlada incluidos en la forma de dosificación de liberación controlada se seleccionan del grupo consistente en ácidos grasos, alcoholes grasos, gliceril ésteres de ácidos grasos, aceites vegetales y ceras, y en la que la forma de dosificación proporciona una disolución in vitro de la forma de dosificación, cuando se mide por el Método de las Paletas de la USP a 100 rpm en 900 ml de tampón acuoso (pH entre 1,6 y 7,2) a 37ºC, de entre el 12,5% y el 42,5% (en peso) de clorhidrato de oxicodona liberado después de 1 hora, entre el 25% y el 56% (en peso) de clorhidrato de oxicodona liberado después de 2 horas, entre el 45% y el 75% (en peso) de clorhidrato de oxicodona liberado después de 4 horas y entre el 55% y el 85% (en peso) de clorhidrato de oxicodona liberado después de 6 horas, siendo la liberación in vitro independiente con respecto al pH.
2. Forma de dosificación de clorhidrato de oxicodona de liberación controlada según la reivindicación 1, en la que la matriz de liberación controlada comprende además diluyentes, lubricantes, aglutinantes, medios de granulación, colorantes, aromatizantes y deslizantes.
3. Forma de dosificación de clorhidrato de oxicodona de liberación controlada según cualquier reivindicación anterior, en la que dicha forma de dosificación comprende 10 mg, 20 mg ó 40 mg de clorhidrato de oxicodona.
4. Forma de dosificación de clorhidrato de oxicodona de liberación controlada según cualquier reivindicación anterior, en la que dicha forma de dosificación comprende 10 mg de clorhidrato de oxicodona.
5. Forma de dosificación de clorhidrato de oxicodona de liberación controlada según cualquier reivindicación anterior, en la que dicha forma de dosificación comprende 20 mg de clorhidrato de oxicodona.
6. Forma de dosificación de clorhidrato de oxicodona de liberación controlada según cualquier reivindicación anterior, en la que dicha forma de dosificación comprende 40 mg de clorhidrato de oxicodona.
Patentes similares o relacionadas:
Regímenes de dosificación de buprenorfina, del 1 de Julio de 2020, de Indivior UK Limited: Buprenorfina para su uso en un método para tratar el trastorno por uso de opioides en un ser humano que lo necesite, que comprende las etapas […]
 Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Pulverizador de buprenorfina sublingual, del 22 de Abril de 2020, de Fresh Cut Development, LLC: Una formulación de pulverización sublingual que comprende una cantidad efectiva de buprenorfina, o una sal farmacéuticamente aceptable de la misma, […]
Dispositivos de administración transdérmica resistentes al abuso y composiciones que comprenden un agonista de opioides y un derivado N-óxido no administrado por vía transdérmica de un antagonista de opioide para el tratamiento del dolor, del 22 de Abril de 2020, de EURO-CELTIQUE S.A.: Un dispositivo de administración transdérmica que comprende una composición farmacéutica, en el que dicha composición comprende un derivado […]
Formulación farmacéutica a base de ibuprofeno y codeína que tiene estabilidad mejorada, del 15 de Abril de 2020, de FARMASIERRA MANUFACTURING S.L: Formulación farmacéutica a base de ibuprofeno y codeínade estabilidad mejorada. La invención consiste en una nueva formulación farmacéuticaen forma […]
Parche transdérmico de oximorfona, del 8 de Abril de 2020, de Buzzz Pharmaceuticals Limited: Un parche transdérmico que tiene una capa que contiene el fármaco que comprende oximorfona o una sal farmacéuticamente aceptable de la misma, […]
Composiciones de buprenorfina y antagonistas del receptor de opioides mu, del 1 de Abril de 2020, de Alkermes Pharma Ireland Limited: Una composición que comprende buprenorfina y un antagonista del receptor opioide μ, en donde la composición está caracterizada por un Índice […]