COMPOSICIONES DE LIPOSOMAS INMUNOGENICAS.
Una composición de liposomas inmunogénica que comprende:
lípidos formadores de vesículas;
y
una construcción de proteína antigénica que es un producto de fusión hidrosoluble que comprende uno o más determinantes antigénicos y un dominio hidrófobo, en la que el dominio hidrófobo está asociado con la membrana de la composición de liposomas inmunogénica
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US99/20880.
Solicitante: MOLECULAR EXPRESS INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 13310 SOUTH FIGUEROA STREET,LOS ANGELES, CA 90061.
Inventor/es: CRAMER, DONALD, V., ADLER-MOORE, JILL, FUJII, GARY, ERNST,WILLIAM,A, PERRY,L.,JEANNE.
Fecha de Publicación: .
Fecha Concesión Europea: 19 de Mayo de 2010.
Clasificación Internacional de Patentes:
- A61K39/39 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61K9/127B
- C07K14/035 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Virus herpes simple I o II.
- C07K14/11 C07K 14/00 […] › Orthomyxoviridae, p. ej. virus de la influenza.
- C07K14/16D
- C07K14/18F4
- C12N15/62 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
Clasificación PCT:
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K9/127 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Liposomas.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
- C12N15/85 C12N 15/00 […] › para células animales.
Clasificación antigua:
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K9/127 A61K 9/00 […] › Liposomas.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
- C12N15/85 C12N 15/00 […] › para células animales.
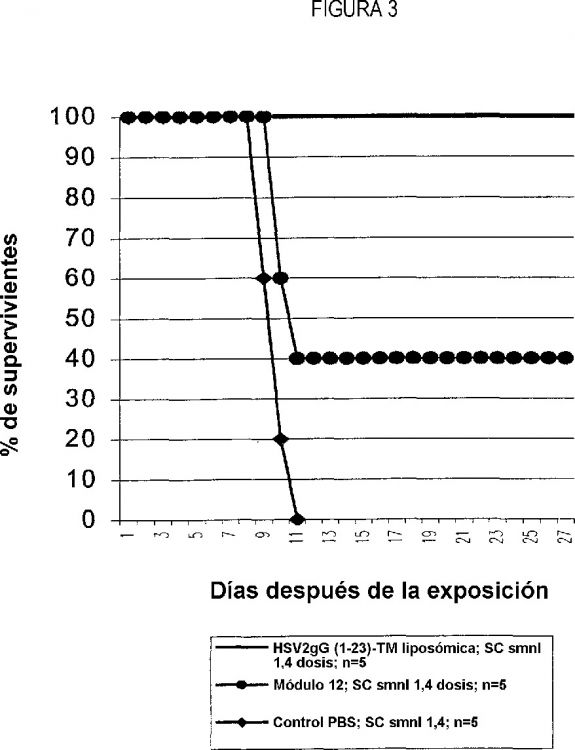
Fragmento de la descripción:
Composiciones de liposomas inmunogénicas.
Antecedentes de la invención
El uso de vacunas ha proporcionado históricamente un método seguro y eficaz para proteger a poblaciones grandes frente a una amplia variedad de enfermedades infecciosas. La inmunización frente a organismos víricos y frente a otros organismos microbianos es en general segura y eficaz, y ha sido responsable de gran parte de la mejora en la longevidad experimentada por los individuos en los países desarrollados. Sin embargo puede producirse una serie de efectos secundarios dependiendo de la naturaleza de la vacuna y del inmunógeno específico. En el pasado, una inactivación inadecuada del virus intacto ha conducido a una infección no intencionada, en lugar de a la protección tras la vacunación (Tigertt, 1959, Military Med., 124:342). A veces la inmunización con organismos intactos, como la gripe, puede precipitar el desarrollo de enfermedades autoinmunológicas dirigidas contra tejidos normales, como el síndrome de Guillain Barre (Langmuir et al., 1984, J. Epidemiol., 119:841). Además de los propios agentes, la presencia de sustancias dentro de las células o del medio complejo puede producir la inducción de graves reacciones alérgicas frente a proteínas extrañas (Yamana y Uemura, 1988, Epidem. Inf., 100:291). Puesto que los procedimientos de vacunación eficaces a menudo requieren múltiples inmunizaciones, estos acontecimientos adversos pueden reducir la eficacia de la vacuna y pueden reducir la aceptación ciudadana del procedimiento de vacunación. Las técnicas de biología molecular modernas se han ensayado en fechas recientes para intentar proporcionar una mejor seguridad y eficacia a las nuevas preparaciones de vacunas. Las estrategias potenciales actualmente en estudio incluyen las vacunas basadas en técnicas de ADN recombinante (Conry et al., 1994, Cancer Res., 54:1164; Hu et al., 1988, J. Virol., 62:176), la generación de péptidos sintéticos sencillos como antígenos (Nardelli et al., 1992, Vaccines, 8:1405; Watari et al., 1987, J. Exp. Med., 165:459) y la inyección directa de material genético en tejidos para estimular respuestas protectoras (Ulmer et al., 1993, Science, 259:1745). En particular, el uso de antígenos peptídicos sencillos para inducir respuestas de inmunización específicas ha sido el centro de muchos estudios. Esta estrategia resulta atractiva porque tiene el potencial de proporcionar especificidad inmunológica, un mayor control de los procesos de fabricación, y la eliminación de la mayoría de las fuentes secundarias de materiales o contaminantes asociados con la producción del inmunógeno.
Sin embargo, el uso de fragmentos peptídicos o proteínas purificados para la vacunación depende del transporte del material hacia el sitio de inmunización por un vehículo del antígeno eficaz. En potencia, uno de los vehículos más seguros han sido los complejos de vacuna basados en lípidos/liposomas. Desde hace tiempo los liposomas se han establecido como una técnica comercialmente viable, porque pueden reducir las toxicidades de los fármacos, prolongar la circulación en la corriente sanguínea, y alterar la biodistribución y la farmacocinética de las moléculas del fármaco (Fujii, 1996, Vesicles, ed. M. Rosoff, Marcel Dekker, Nueva York, NY, p. 491). Cuando se administran in vivo, los liposomas circulan en la sangre y son eliminados por el sistema fagocítico de monocitos/macrófagos, en particular en los tejidos del hígado, del bazo, de los nódulos linfáticos y del pulmón (Claasen, 1996, Vesicles, ed. M. Rosoff, Marcel Dekker, Nueva York, NY, p. 649). La capacidad de los liposomas para dirigir el patrón de distribución antigénico sugiere que un inmunógeno liposómico estaría expuesto de forma máxima al sistema inmunológico. Hasta la fecha se han ensayado varios sistemas basados en lípidos, incluyendo péptidos conjugados con lípidos (Nardelli et al., et al., 1992, Vaccines, 8:1405; Watari et al., 1987, J. Exp. Med., 165:459), la reconstitución de subunidades de la proteína completa en presencia de lípidos (Morein y Simons, 1985, Vaccines, 4:166; Gregoriadis, 1995, Tibtech, 13:527) y la asociación de proteínas con liposomas preformados (Therien y Shahum, 1989, Immunol. Lett., 22:253; Alving et al., 1985, Vaccines, 4:166). Aunque estas estrategias han demostrado ser inmunológicamente activas, las dificultades técnicas asociadas con la producción a gran escala de las proteínas y de sus vehículos lipídicos, así como las restricciones del precio, hacen que sean menos atractivas como tecnología comercial. Por tanto, es necesario un sistema o una estrategia mejores para preparar antígenos proteicos para aprovechar el potencial ofrecido por los liposomas en el desarrollo de vacunas.
El documento EP-A-0247497 describe liposomas funcionalizados que contienen un compuesto anfifílico de alto peso molecular, como LPS. Un antígeno, como un anticuerpo, puede inmovilizarse sobre los liposomas utilizando el compuesto anfifílico como espaciador.
El documento FR-A-2754543 describe liposomas que comprenden FHA de Bordetella, una proteína heteróloga y lípidos.
Sumario de la invención
La presente invención proporciona una composición de liposomas inmunogénica que comprende lípidos formadores de vesículas y una construcción antigénica que es un producto de fusión hidrosoluble que comprende uno o más determinantes antigénicos y un dominio hidrófobo, en el que el dominio hidrófobo es un péptido y, según una realización preferida, consiste en aproximadamente 15 a aproximadamente 500 restos aminoácidos, más preferiblemente menos de aproximadamente 300, y lo más preferiblemente menos de aproximadamente 50 restos, en la que al menos uno o más de los aminoácidos se seleccionan del grupo que consiste en Ala, Asn, Cys, Gln, Gly, His, Ile, Leu, Met, Phe, Pro, Ser, Thr, Trp, Tyr y Val.
Según una realización de la presente invención, la composición de liposomas inmunogénica comprende además uno o más adyuvantes. Los ejemplos de adyuvantes adecuados incluyen moléculas lipófilas, como lípido A y otros lipopolisacáridos, Quil A, QS21, MF59, P3CSS, MTP-PE, así como moléculas hidrosolubles, incluyendo citoquinas como IL-2, IL-4, IL-12, los interferones y similares. Otros ejemplos de citoquinas se proporcionan en la tabla 1 que aparece a continuación.
Según otra realización de la invención, la construcción antigénica comprende además una región conectora que une el o los determinantes antigénicos con el dominio hidrófobo. En una realización preferida, la región conectora es un péptido que consiste en 1 a aproximadamente 200 restos aminoácidos. Preferiblemente, los restos aminoácidos son aminoácidos naturales, como Ala, Arg, Asn, Asp, Cys, Glu, Gln, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr y/o Val.
La presente invención proporciona un método para inducir una respuesta inmunológica en un animal hospedante, que comprende administrar una cantidad inmunogénicamente eficaz de una composición de liposomas como se describió anteriormente. Aunque el hospedante puede ser cualquier animal, incluyendo aves de corral, preferiblemente el animal hospedante es un mamífero y más preferiblemente un ser humano. En ciertas realizaciones preferidas, la composición de liposomas inmunogénica comprende además uno o más adyuvantes adecuados.
La presente invención proporciona además un módulo de ADN para su inserción en un vector que comprende secuencias que codifican una proteína de fusión inmunogénica hidrosoluble, en el que la proteína de fusión comprende un dominio de proteína hidrófobo y uno o más determinantes antigénicos.
La presente invención proporciona también un método para preparar una composición de liposomas inmunogénica que comprende expresar un gen que codifica una proteína de fusión hidrosoluble que comprende un determinante antigénico y un dominio hidrófobo; disolver lípidos y la proteína de fusión en un disolvente orgánico o una mezcla de disolventes orgánicos adecuados; formar una película lipídica evaporando el disolvente orgánico; hidratar la película lipídica; y dispersar la película lipídica hidratada para formar una composición de liposomas inmunogénica.
La presente invención proporciona además un método para preparar una composición de liposomas inmunogénica que comprende expresar un gen que codifica una proteína de fusión hidrosoluble que comprende un determinante antigénico y un dominio hidrófobo; disolver la proteína de fusión en un tampón acuoso; hidratar polvos lipídicos...
Reivindicaciones:
1. Una composición de liposomas inmunogénica que comprende:
lípidos formadores de vesículas; y
una construcción de proteína antigénica que es un producto de fusión hidrosoluble que comprende uno o más determinantes antigénicos y un dominio hidrófobo, en la que el dominio hidrófobo está asociado con la membrana de la composición de liposomas inmunogénica.
2. Una composición de liposomas inmunogénica según la reivindicación 1, que comprende además uno o más adyuvantes.
3. Una composición de liposomas inmunogénica según la reivindicación 1, en la que la construcción antigénica se sintetiza de modo químico.
4. Una composición de liposomas inmunogénica según la reivindicación 1, en la que el dominio hidrófobo es un péptido.
5. Una composición de liposomas inmunogénica según la reivindicación 4, en la que el dominio hidrófobo consiste en aproximadamente 15 a aproximadamente 500 restos aminoácidos.
6. Una composición de liposomas inmunogénica según la reivindicación 5, en la que el dominio hidrófobo comprende uno o más aminoácidos seleccionados del grupo que consiste en Ala, Asn, Cys, Gln, Gly, His, Ile, Leu, Met, Phe, Pro, Ser, Thr, Trp, Tyr y Val.
7. Una composición de liposomas inmunogénica según la reivindicación 1, en la que el determinante antigénico se deriva de un antígeno seleccionado del grupo que consiste en gD o gB de HSV, gp120 de VIH, gB de CMV, E2 de HCV, HA o NA de INFV, y P6 de H. influenzae.
8. Una composición de liposomas inmunogénica según la reivindicación 1, en la que la construcción antigénica comprende además una región conectora que une el uno o más determinantes antigénicos con el dominio hidrófobo.
9. Una composición de liposomas inmunogénica según la reivindicación 8, en la que la región conectora es un péptido.
10. Una composición de liposomas inmunogénica según la reivindicación 9, en la que la región conectora consiste de aproximadamente 1 a aproximadamente 200 restos aminoácidos.
11. Una composición de liposomas inmunogénica según la reivindicación 10, en la que los restos aminoácidos se seleccionan del grupo que consiste en Ala, Arg, Asn, Asp, Cys, Glu, Gln, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr y Val.
12. Una composición de liposomas inmunogénica según la reivindicación 1, que comprende una construcción antigénica que comprende uno o más determinantes antigénicos y un dominio hidrófobo, y un vehículo farmacéuticamente aceptable.
13. Una composición de liposomas inmunogénica según la reivindicación 12, en la que la construcción antigénica comprende además una región conectora que une el uno o más determinantes antigénicos con el dominio hidrófobo.
14. Una composición de liposomas inmunogénica según la reivindicación 12, que comprende además uno o más adyuvantes.
15. Una composición de liposomas inmunogénica según la reivindicación 1, en la que el uno o más determinantes antigénicos es un determinante antigénico de una toxina o patógeno bacteriano, de un patógeno vírico, de un patógeno fúngico, o de un patógeno parasitario.
16. Una composición de liposomas inmunogénica según una cualquiera de las reivindicaciones anteriores para su uso en un método para inmunizar un animal hospedante.
17. Una composición de liposomas inmunogénica según una cualquiera de las reivindicaciones anteriores para su uso en un método para inducir una respuesta inmunológica en un animal hospedante.
18. Una composición de liposomas inmunogénica según la reivindicación 16 ó 17, en la que el animal hospedante es un mamífero.
19. Una composición de liposomas inmunogénica según la reivindicación 18, en la que el mamífero es un ser humano.
20. Una composición de liposomas inmunogénica según la reivindicación 19, en la que el determinante antigénico se selecciona del grupo que consiste en gD o gB de HSV, gp120 de VIH, gB de CMV, E2 de HCV, HA o NA de INFV, y P6 de H. influenzae.
21. Una composición de liposomas inmunogénica según la reivindicación 16 ó 17, en la que el animal es un ave.
22. Un método para fabricar una composición de liposomas inmunogénica que comprende:
expresar un gen que codifica una proteína de fusión hidrosoluble que comprende un determinante antigénico y un dominio hidrófobo; y
(a) disolver lípidos formadores de vesículas y la proteína de fusión en un disolvente orgánico adecuado;
formar una película lipídica o un polvo secado por pulverización lipídico mediante la evaporación del disolvente orgánico;
hidratar la película o el polvo lipídicos; y
dispersar la película o el polvo lipídicos hidratados para formar una composición de liposomas inmunogénica; o
(b) disolver la proteína de fusión en un tampón acuoso;
hidratar un polvo lipídico o una película lipídica con el tampón que contiene la proteína de fusión; y
dispersar el polvo o la película lipídicos para formar una composición de liposomas inmunogénica; o
(c) disolver la proteína de fusión en un tampón acuoso; y
añadir la proteína de fusión a liposomas preformados para formar una composición de liposomas inmunogénica.
23. Una composición de liposomas inmunogénica que puede obtenerse mediante un método según la reivindicación 22.
Patentes similares o relacionadas:
Cadena ligera de enteroquinasa modificada, del 22 de Julio de 2020, de NOVO NORDISK A/S: Un análogo de la cadena ligera de la enteroquinasa bovina que comprende una secuencia de aminoácidos establecida en la SEQ ID NO: 1, en donde dicho análogo comprende […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Métodos y composiciones para ingeniería genómica, del 3 de Junio de 2020, de Sangamo Therapeutics, Inc: Una pareja de nucleasas de dedo de zinc (ZFN) que comprende una ZFN izquierda y una ZFN derecha, comprendiendo cada ZFN un dominio de escisión […]
Métodos y composiciones para escisión dirigida y recombinación, del 20 de Mayo de 2020, de Sangamo Therapeutics, Inc: Un método in vitro para la escisión selectiva de un gen HLA clase I, un gen HLA que codifica una proteína de clase 1 del Complejo de Histocompatibilidad Mayor (MHC) […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Etiqueta de epítopo y método de detección, captura y/o purificación de polipéptidos etiquetados, del 15 de Abril de 2020, de ChromoTek GmbH: Péptido epítopo aislado que tiene de 12 a 25 aminoácidos, en donde la secuencia de aminoácidos comprende una secuencia según se define en SEQ ID NO: 32 (X1X2RX4X5AX7SX9WX11X12), […]
Utilización diagnóstica de un polipéptido de fusión que comprende una proteína vírica y un enzima MGMT, del 15 de Abril de 2020, de INSTITUT PASTEUR: Utilización in vitro de un polipéptido de fusión que comprende una proteína vírica y i) el enzima 6-metilguanina-ADN-metiltransferasa (MGMT, EC 2.1.1.63) o un homólogo […]