COMPOSICIONES QUE COMPRENDEN COMPLEJOS DE ANTÍGENOS, PROCEDIMIENTO PARA SU PREPARACIÓN ASÍ COMO PRECEDIMIENTOS DE UTILIZACIÓN DE LOS COMPLEJOS DE ANTÍGENOS PARA LA VACUNACIÓN.
Procedimiento para la producción de una comicela que comprende las etapas que consisten en:
i) poner en contacto un compuesto anfifílico que presenta actividad adyuvante y un antígeno en una disolución que comprende un detergente, en el que dicho antígeno es una proteína anfifílica o un fragmento de la misma; y ii) reducir la concentración de detergente bajo condiciones que causan la formación de una comicela en la que dicho compuesto anfifílico y dicho antígeno interaccionan a través de interacciones hidrófobas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2003/013084.
Solicitante: BESTEWIL HOLDING B.V.
Nacionalidad solicitante: Países Bajos.
Dirección: WASSENAARSEWEG 72 2333 AL LEIDEN PAISES BAJOS.
Inventor/es: STEGMANN,ANTONIUS,JOHANNES,HENDRIKUS.
Fecha de Publicación: .
Fecha Solicitud PCT: 20 de Noviembre de 2003.
Clasificación PCT:
- A61K39/145 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Orthomyxoviridae, p. ej. virus de la influenza.
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61K9/107 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Emulsiones.
Clasificación antigua:
- A61K39/145 A61K 39/00 […] › Orthomyxoviridae, p. ej. virus de la influenza.
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61K9/107 A61K 9/00 […] › Emulsiones.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358900_T3.pdf


Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a vacunas dirigidas contra antígenos de patógenos o células tumorales. La invención se refiere además a procedimientos de formación de complejos específicos de antígenos con compuestos anfifílicos, y a composiciones farmacéuticas que comprenden dichos complejos.
ANTECEDENTES DE LA INVENCIÓN
Clásicamente, las vacunas contra los virus con envuelta contienen virus muertos o vivos atenuados, o comprenden sus proteínas de membrana (por ejemplo, preparación de virus fraccionado). Después de la inyección las partículas virales o proteínas son adquiridas por las células del sistema inmune (por ejemplo células dendríticas o macrófagos) seguido de la presentación de sus partes antigénicas a las células efectoras del sistema inmune. La mayoría de las vacunas han de ser inyectadas para inducir una respuesta inmune suficientemente fuerte debido a que los fagocitos presentadores de antígenos son más abundantes justo debajo de la piel. Sin embargo, ahora se ha descubierto que tales células se encuentran también en la mucosa que, por ejemplo, recubre la nariz (Ogra et al., 2001). Los fagocitos de la mucosa requieren una estimulación mucho más fuerte que la de los presentes bajo la piel (Janeway et al., 2001).
Mientras que la inyección de algunos virus o proteínas, por ejemplo el virus de la gripe, estimula una respuesta inmune que es suficientemente fuerte como para proteger contra una infección posterior por el mismo virus, este no es el caso para muchos otros, por ejemplo el virus sincicial respiratorio. Se han realizado múltiples intentos de reforzar la respuesta inmune por medios físicos o químicos (mediante compuestos denominados adyuvantes). Los principios más importantes emergentes de estos experimentos son los siguientes. Para la estimulación física, se ha descubierto que las partículas que comprenden múltiples copias de las subunidades virales, tales como virus enteros, virosomas y proteínas en vehículos de micropartículas estimulan el sistema inmune mejor que las subunidades individuales (Ogra et al., 2001; Janeway et al., 2001), mientras que la estimulación química requiere que los fagocitos o las células efectoras del sistema inmune reciban ciertas señales a través de receptores presentes en la superficie celular, por ejemplo mediante la utilización de un adyuvante. Con la suficiente estimulación fisicoquímica adicional, las proteínas virales pueden inducir respuestas inmunes potentes incluso si se aplican a las membranas mucosas, por ejemplo, mediante aplicación intranasal (Ogra et al., 2001). La mayoría de los procedimientos actuales y composiciones para estimular una respuesta inmune mediante tales medios, ya sean medios físicos o químicos o combinaciones de los dos principios, presentan desventajas significativas que se exponen a continuación.
Un tipo particular de composición de vacuna que se desarrolló en la técnica se conoce como “virosomas”, que son bicapas lipídicas que comprenden glicoproteínas virales (figura 1). Los virosomas se producen generalmente mediante la extracción de las proteínas de la membrana de los virus con detergentes, seguida de la eliminación del detergente en presencia de lípidos de tal modo que se formen bicapas lipídicas características con las proteínas sobresaliendo de las mismas (Stegmann et al., 1987). Para ciertos antígenos víricos, tales virosomas inducen respuestas protectoras inmunes que son fuertes incluso cuando la vacuna se administre mediante aplicación intranasal (tal como se describe en el documento WO 88/08718 y en el documento WO 92/19267). Sin embargo, entre el 30 y el 85% de las proteínas virales se pierden durante el procedimiento de formación de virosomas (WO 88/08718; Stegmann et al., 1987). Además, debido a que la inserción de la proteína viral en cada uno de los lados de la membrana tienen lugar con aproximadamente la misma probabilidad durante la reconstitución, una gran parte de la proteína (un tercio en el caso de la hemaglutinina de la gripe, Stegmann et al., 1987) presente en los virosomas está en el interior de las partículas, y por consiguiente invisible al sistema inmune. Además, es bien conocido en la técnica que tales bicapas lipídicas artificiales hacen que las preparaciones sean frágiles, provocando problemas de almacenamiento, manipulación y transporte. Además, la formulación óptima requiere frecuentemente mezclas complejas de lípidos, cuyas proporcionas han de ser estrictamente controladas durante la producción. Esto produce problemas regulatorios.
La inmunogenicidad de muchos antígenos víricos, por ejemplo la hemaglutinina de la gripe, solamente se mejora ligeramente con respecto a los virus muertos cuando el antígeno se presenta en virosomas (Gluck et al., 1994). Por consiguiente, con el fin de amplificar la respuesta inmune, para permitir la aplicación intranasal de esta vacuna, se mezcló una proteína adyuvante de Escherichia coli (la toxina termo lábil) con la vacuna de la gripe de virosomas (documento EP 0 538 437). Los ensayos clínicos indican que la adición de la toxina fue necesaria para inducir títulos séricos de anticuerpo equivalentes a los de la vacuna inyectada (Gluck et al., 1994). Aunque la adición de la toxina incrementó la inmunogenicidad de la vacuna, también indujo un serio efecto secundario conocido como la parálisis cerebral de Bell, una parálisis temporal de los músculos faciales. En este caso, la toxina no formó parte de los virosomas, pero se encontró en la disolución envolvente. Como el efecto adyuvante de la toxina es debido al reconocimiento por una células presentadora de antígeno, amplificando su reacción a una proteína viral que la célula pueda adquirir, y como no existe certeza de que la toxina y la proteína viral hagan contacto con la misma célula, se necesita utilizar una elevada concentración de toxina con el fin de asegurar la activación de cada una de las células. Por consiguiente, claramente, los virosomas presentan características prometedoras, tales como su naturaleza de partícula, pero también un número sustancial de desventajas.
Por el contrario, los investigadores en la técnica han generado también complejos de antígeno diferentes a los virosomas, como los “complejos inmunoestimulantes” (ISCOM, Morein et al., 1984), que comprenden proteínas virales acomplejadas con compuestos tales como Quil A® y saponinas (documento EP 0 231 039 B1; documento EP 0 109 942 A1; documento EP 0 180 564 A1), predominantemente aislado de la corteza de Quillaia sopanaria Molina. Mezclados con antígeno y lípidos tales como el colesterol, estos compuestos forman estructuras en forma de jaula de entre 30 y 40 nm, que hacen que el antígeno esté en forma de partículas, a la vez que actúan como un adyuvante. Aunque los ISCOM se han utilizado en múltiples vacunas veterinarias y amplifican la inmunogenicidad de las proteínas de membranas viral, el desarrollo de tales vacunas para humanos ha sido inhibido debido a la preocupación por su toxicidad y la complejidad de la mezcla (Cox et al., 1998).
**(Ver fórmula)**
Más recientemente, se desarrollaron las vacunas de proteosoma de la gripe (solicitud de patente US nº 20010053368), que comprenden complejos no covalentes de proteínas de membrana externa purificadas de bacterias tales como meningococos, mezcladas con proteínas antigénicas tales como la hemaglutinina de la gripe o la glicoproteína de envuelta de la inmunodeficiencia humana. Mientras que la presencia de múltiples proteínas bacterianas puede actuar como adyuvante, la compleja naturaleza de tales mezclas, que comprenden múltiples proteínas, presentará un problema regulatorio.
Otra formulación en partículas desarrollada por Viovector Therapeutics comprende un núcleo interno de carbohidrato rodeado por una envuelta lipídica que comprende antígenos. Con la hemaglutinina de la gripe como antígeno se ha percibido cierto incremento de la respuesta inmune, pero no lo suficientemente significativa como para garantizar un desarrollo futuro.
Las versiones vivas atenuadas de los virus respiratorios, tales como una cepa del virus de la gripe adaptada al frío con replicación mínima en el tracto respiratorio, se han desarrollado como vacunas intranasales. Estas vacunas presentan la ventaja de inducir respuestas inmunes que son próximas a la inmunidad natural inducida por la infección con el virus silvestre. Para la gripe, dichas vacunas han sido conocidas durante más de 20 años, y su comercialización parece inminente en la actualidad. El retraso ha sido provocado por la preocupación por la capacidad de muchos virus para... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la producción de una comicela que comprende las etapas que consisten en:
i) poner en contacto un compuesto anfifílico que presenta actividad adyuvante y un antígeno en una disolución que comprende un detergente, en el que dicho antígeno es una proteína anfifílica o un fragmento de la misma; y
ii) reducir la concentración de detergente bajo condiciones que causan la formación de una comicela en la que dicho compuesto anfifílico y dicho antígeno interaccionan a través de interacciones hidrófobas.
2. Procedimiento según la reivindicación 1, en el que dicha proteína anfifílica es una proteína de superficie de un agente infeccioso.
3. Procedimiento según la reivindicación 1 ó 2, en el que dicha proteína anfifílica es una proteína de membrana.
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, en el que dicha proteína anfifílica es una proteína de membrana exterior.
5. Procedimiento según cualquiera de las reivindicaciones 1 a 3, en el que dicha proteína anfifílica es una proteína de membrana integral.
6. Procedimiento según cualquiera de la reivindicaciones 1 a 5, que comprende además la etapa que consiste en recoger dicha comicela de la disolución.
7. Procedimiento según cualquiera de las reivindicaciones 1 a 6, en el que dicho antígeno se purifica antes de la puesta en contacto con dicho compuesto anfifílico.
8. Procedimiento según cualquiera de las reivindicaciones 1 a 7, en el que dicho antígeno es deslipidado antes de la puesta en contacto con dicho compuesto anfifílico.
9. Comicela que comprende un compuesto anfifílico que presenta una actividad adyuvante y un antígeno, en la que dicho compuesto anfifílico y dicho antígeno interaccionan mediante interacciones hidrófobas, en la que dicho antígeno es por lo menos una proteína anfifílica o un fragmento de la misma, y en la que las partes hidrófobas de dicho compuesto anfifílico y dicho antígeno se dirigen hacia el interior de dicha comicela en un ambiente acuoso.
10. Comicela según la reivindicación 9, en la que dicha proteína anfifílica es una proteína de superficie de un agente infeccioso.
11. Comicela según la reivindicación 9, en la que dicha proteína anfifílica es una proteína de membrana.
12. Comicela según cualquiera de las reivindicaciones 9 a 11, en la que dicha proteína anfifílica es una proteína de membrana exterior.
13. Comicela según cualquiera de las reivindicaciones 9 a 11, en la que dicha proteína anfifílica es una proteína de membrana integral.
14. Comicela según cualquiera de las reivindicaciones 9 a 13, en la que dicho compuesto anfifílico es farmacéuticamente aceptable para su utilización en humanos.
15. Comicela según cualquiera de las reivindicaciones 9 a 14, en la que dicho compuesto anfifílico puede proceder de una bacteria.
16. Comicela según cualquiera de las reivindicaciones 9 a 15, en la que dicho compuesto anfifílico comprende un lipopéptido.
17. Comicela según la reivindicación 16, en la que dicho lipopéptido es seleccionado de entre el grupo constituido por: N-palmitoil-S-2,3(bispalmitoiloxi)-propil-cisteinil-seril-serina, S-2,3(bispalmitoiloxi)-propil-cisteinil-serilserina, N-palmitoil-S-2,3(bispalmitoiloxi)-propil-cisteinil-seril-(lisil)3-lisina, S-2,3(bispalmitoiloxi)-propil-cisteinil-seril-(lisil)3lisina, N-palmitoil-S-2,3(bisoleoiloxi)-propil-cisteinil-seril-(lisil)3-lisina, S-2,3(bisoleoiloxi)-propil-cisteinil-seril-(lisil)3-lisina, N-palmitoil-S-2,3(bismiristoiloxi)-propil-cisteinil-seril-(lisil)3-lisina; S-2,3(bismiristoiloxi)-propil-cisteinil-seril-(lisil)3-lisina, Npalmitoil-S-2,3(palmitoiloxi)-propil-cisteinil-seril-(lisil)3-lisina y S-2,3-hidroxi-propil-cisteinil-seril-(lisil)3-lisina.
18. Comicela según la reivindicación 16, en la que dicho lipopéptido es la N-palmitoil-S-2,3(bispalmitoiloxi)propil-cisteinil-seril-(lisil)3-lisina.
19. Comicela según la reivindicación 16, en la que dicho lipopéptido es reconocido por un receptor similar a Toll.
20. Comicela según cualquiera de las reivindicaciones 9 a 15, en la que dicho compuesto anfifílico comprende un glicolípido.
21. Comicela según la reivindicación 20, en la que dicho glicolípido comprende fosfatidil inositol manósido y/o alfa-galactosil ceramida o un derivado de los mismos.
22. Comicela según cualquiera de las reivindicaciones 9 a 15, en la que dicho compuesto anfifílico comprende un péptido.
23. Comicela según cualquiera de las reivindicaciones 20 a 22, en la que dicho glicolípido o dicho péptido se une a un receptor en una célula presentadora de antígenos, preferentemente una célula dendrítica.
24. Comicela según la reivindicación 10, en la que dicho agente infeccioso es un virus.
25. Comicela según la reivindicación 24, en la que dicho virus es el virus de la gripe.
**(Ver fórmula)**
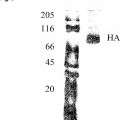
26. Comicela según la reivindicación 25, en la que dicho antígeno comprende la proteína de hemaglutinina (HA) de la gripe y/o la proteína de la neuraminidasa (NA) y/o la proteína M2.
27. Comicela según la reivindicación 24, en la que dicho antígeno procede de un virus que pertenece a una familia seleccionada de entre el grupo constituido por: Retroviridae, Adenoviridae, Paramixoviridae, Flaviviridae, Herpesviridae, Bunyaviridae, Hantaviridae, Papovaviridae, Rhabdoviridae, Coronaviridae, Alphaviridae, Arteriviridae, Filoviridae, Arenaviridae y Poxviridae.
28. Comicela según la reivindicación 9, en la que dicho antígeno procede de un parásito o una bacteria.
29. Comicela según la reivindicación 9, en la que dicho antígeno comprende un antígeno específico de tumor.
30. Preparación farmacéutica que comprende una comicela según cualquiera de las reivindicaciones 9 a 29, y un vehículo terapéuticamente aceptable.
31. Comicela según cualquiera de las reivindicaciones 9 a 29 para la utilización en terapia, profilaxis o diagnóstico.
32. Preparación farmacéutica según la reivindicación 30 para su utilización en la administración intranasal.
33. Preparación farmacéutica según la reivindicación 30 para su utilización en la administración oral.
34. Comicela según cualquiera de las reivindicaciones 9 a 29, en la que dicha comicela presenta un tamaño de entre 25 y 42 nm en diámetro.
Patentes similares o relacionadas:
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Respuesta inmune mejorada en especies aviares, del 1 de Julio de 2020, de Bayer Intellectual Property GmbH: Una composición de inmunomodulador, en que la composición del inmunomodulador comprende: a. un vehículo catiónico de administración de liposomas; y […]
Composición farmacéutica que comprende un complejo de carga portador polimérico y al menos un antígeno proteínico o peptídico, del 1 de Julio de 2020, de CureVac AG: Composición farmacéutica que incluye: (A) un complejo de carga portador polimérico, que comprende: a) un portador polimérico que comprende componentes catiónicos reticulados […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Métodos para proporcionar virosomas con adyuvante y virosomas con adyuvante obtenibles de esta manera, del 3 de Junio de 2020, de BESTEWIL HOLDING B.V: Un método para preparar los virosomas con adyuvante, que comprende las etapas de: (i) proporcionar una composición acuosa de los virosomas sin adyuvante que comprende […]
Composición de medio para preparar toxina botulínica, del 6 de Mayo de 2020, de Daewoong Co., Ltd: Una composición de medio libre de EET para su uso en el cultivo de Clostridium botulinum, la composición de medio comprende: peptonas de origen […]
Inmunomodulación mediante inhibidores de IAP, del 6 de Mayo de 2020, de NOVARTIS AG: Una vacuna que comprende una cantidad inmunogénica de un antígeno procedente de tumor o antígeno tumoral y un adyuvante que comprende un inhibidor de IAP […]