COMPOSICION QUE COMPRENDE ROSIGLITAZONA Y METFORMINA.
Una forma de dosificación oral, que comprende un núcleo erosionable que comprende 5-[4-[2-(N-metil-N-(2-piridil)-amino)-etoxi]-bencil]-tiazolidino-2,
4-diona, o una sal o solvato farmacéuticamente aceptable de la misma, y metformina o una sal o solvato farmacéuticamente aceptable de la misma, en la que el núcleo tiene un revestimiento con una o múltiples aberturas que conducen al núcleo, caracterizada porque el revestimiento se erosiona bajo condiciones de pH predeterminadas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/008970.
Solicitante: SMITHKLINE BEECHAM (CORK) LIMITED.
Nacionalidad solicitante: Irlanda.
Dirección: CURRABINNY,CARRIGALINE CORK.
Inventor/es: COLES,PETER JOHN,GLAXOSMITHKLINE INC, MACKENZIE,DONALD COLIN,GLAXOSMITHKLINE , MUDD,PAUL NORMAN,JR.,GLAXOSMITHKLINE.
Fecha de Publicación: .
Fecha Concesión Europea: 20 de Enero de 2010.
Clasificación Internacional de Patentes:
- A61K45/06 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K9/28H6F2
Clasificación PCT:
- A61K31/155 A61K […] › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Amidinas ( ), p. ej. Guanidina (H 2 N—C(=NH)—NH 2 ), isourea (HN=C(OH)NH 2 ), isotiourea (HN=C(SH)—NH 2 ).
- A61K31/4439 A61K 31/00 […] › conteniendo un ciclo de cinco eslabones con el nitrógeno como heteroátomo del ciclo, p. ej. omeprazol (nicotina A61K 31/465).
- A61K9/28 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Grageas; Píldoras o comprimidos con revestimientos.
- A61P3/10 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › para la hiperglucemia, p.ej. antidiabéticos.
Clasificación antigua:
- A61K31/155 A61K 31/00 […] › Amidinas ( ), p. ej. Guanidina (H 2 N—C(=NH)—NH 2 ), isourea (HN=C(OH)NH 2 ), isotiourea (HN=C(SH)—NH 2 ).
- A61K31/4439 A61K 31/00 […] › conteniendo un ciclo de cinco eslabones con el nitrógeno como heteroátomo del ciclo, p. ej. omeprazol (nicotina A61K 31/465).
- A61K9/28 A61K 9/00 […] › Grageas; Píldoras o comprimidos con revestimientos.
- A61P3/10 A61P 3/00 […] › para la hiperglucemia, p.ej. antidiabéticos.
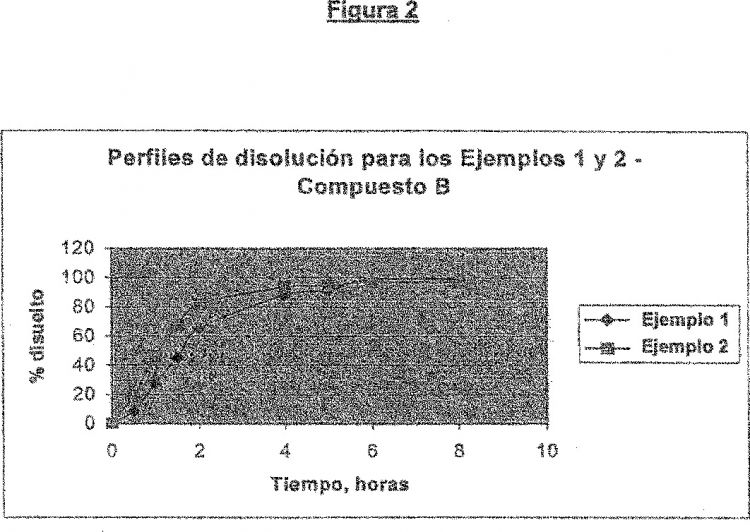
Fragmento de la descripción:
Composición que comprende rosiglitazona y metformina.
La presente invención se refiere a una forma de dosificación oral que comprende 5-[4-[2-(N-metil-N-(2-piridil)-amino)-etoxi]-bencil]-tiazolidino-2,4-diona (en lo sucesivo, "Compuesto A") o una sal o solvato farmacéuticamente aceptable de la misma, y otro agente antidiabético adicional, a un procedimiento para preparar esta forma de dosificación y al uso de esta forma de dosificación en medicina.
El uso de un revestimiento para controlar la velocidad de liberación de un agente activo ha recibido considerable atención, habiéndose desarrollado muchos y diferentes dispositivos para este propósito. Por ejemplo, la Solicitud de Patente Internacional, Número de Publicación WO 01/05430 describe un dispositivo de suministro de fármaco que permite el aporte de sustancias farmacológicas que exhiben una solubilidad dependiente del pH, en particular, de compuestos que son más solubles a niveles bajos de pH (menores que pH 2), que a niveles próximos a la neutralidad (mayor que aproximadamente pH 5). Estos dispositivos de suministro se distinguen por la presencia de un revestimiento que es impermeable e insoluble en el fluido del ambiente de uso.
La Solicitud de Patente Internacional, Número de Publicación WO 95/30422 describe una serie de formas de dosificación de liberación controlada de azitromicina. En particular, se describe una serie de formas de dosificación que reducen la exposición del tracto GI superior (por ejemplo, el estómago) a concentraciones elevadas de azitromicina, por medio del empleo de un revestimiento dependiente del pH. Estas formas de dosificación no muestran aberturas a través de las cuales se pueda producir la liberación de la sustancia farmacológica.
La Patente de EE.UU. Número 6.099.859 describe un comprimido de liberación controlada para el suministro de un fármaco antihiperglucémico, que comprende un núcleo que contiene un fármaco osmóticamente activo y una membrana semipermeable, en donde la membrana semipermeable es permeable al paso de agua y fluidos biológicos, y es impermeable al paso de la sustancia farmacológica. La membrana semipermeable contiene al menos una vía de paso para la liberación del fármaco antihiperglucémico.
La Patente de EE.UU. Número 5.543.155 describe una composición farmacéutica, cuyo medicamento se libera de manera controlada por ósmosis de difusión, que comprende un núcleo de comprimido de una o dos capas, que contiene hidroxipropil metilcelulosa, teniendo dicho núcleo un revestimiento de película que comprende un copolímero de metacrilato de amonio.
Dispositivos adicionales que utilizan un revestimiento para controlar la velocidad de liberación de un agente activo se describen en la Patente de EE.UU. Número 5.004.614. Esta patente describe un núcleo de comprimido dotado de un revestimiento exterior que es sustancialmente impermeable al fluido ambiental. Dicho revestimiento exterior se puede preparar a partir de materiales que son insolubles o solubles en los fluidos del ambiente. Cuando se utiliza un material soluble, el revestimiento tiene un grosor suficiente para que el núcleo no resulte expuesto al fluido ambiental antes de que haya transcurrido la duración deseada de la liberación controlada del agente activo. A través de este revestimiento exterior impermeable, se han generado una o múltiples aberturas que proporcionan al fluido ambiental una vía de acceso al núcleo. Por lo tanto, tras la ingesta del comprimido recubierto, el fluido gastrointestinal puede penetrar a través de la o las aberturas y contactar o penetrar en el núcleo, para liberar el agente activo. El resultado es que el agente activo se libera de manera controlada sólo a través de la o las aberturas. La geometría preferida es aquella en la que existe una perforación circular en las caras superior e inferior del comprimido recubierto. La o las aberturas en cuestión tienen una superficie de aproximadamente 10 a 60% de la superficie de la cara del comprimido recubierto. La velocidad de liberación del medicamento ha demostrado estar directamente relacionada con el diámetro de la o las aberturas, y con la solubilidad del núcleo de matriz y del agente activo, permitiendo la posibilidad de una variedad de perfiles de liberación del medicamento, ya sea liberación cero o de primer orden.
Los revestimientos sustancialmente impermeables del documento US 5.004.614 no son adecuados para la liberación controlada de todos los agentes activos, especialmente de bases débiles farmacéuticamente activas o sales y solvatos farmacéuticamente aceptables de las mismas. Estos agentes activos exhiben una solubilidad marcadamente dependiente del pH, es decir, son más solubles a aproximadamente pH 2, asociadas con zonas halladas en el estómago, en comparación con su solubilidad en las condiciones generalmente neutras del intestino delgado, de alrededor de pH 7.
La Solicitud de Patente Internacional, Número de Publicación WO 03/068195 describe una forma de dosificación oral que comprende un núcleo erosionable que contiene una base débil farmacéuticamente activa, o una sal o solvato farmacéuticamente aceptable de la misma, tal como el Compuesto A, disponiendo el núcleo de una o múltiples aberturas que conducen al núcleo y siendo el revestimiento erosionable para condiciones de pH predeterminadas. Esto proporciona un medio beneficioso para la administración de una base débil, farmacéuticamente activa, o una sal o solvato farmacéuticamente aceptable de la misma, tal como el Compuesto A, en la que resulta deseable que la liberación del compuesto activo tenga lugar en más de un ambiente de pH, basado en el hallazgo de que también resulta beneficioso para el revestimiento que sea erosionable o soluble de forma dependiente del pH.
Los presentes inventores han encontrado ahora que la forma de dosificación oral descrita en la Solicitud de Patente Internacional Número WO 03/068195 se puede utilizar de manera beneficiosa como plataforma para el suministro de más de un agente activo tal como, por ejemplo, el Compuesto A, o una sal o solvato farmacéuticamente aceptable del mismo, y metformina o una sal o solvato farmacéuticamente aceptable del mismo. Con este objetivo, la forma de dosificación oral proporciona un medio beneficioso para suministrar la metformina, que tiene una estrecha ventana de absorción.
La Solicitud de Patente Europea, Número de Publicación 0 306 228 A1 hace referencia a ciertos derivados de tiazolidinodionas descritos como poseedores de actividad antihiperglucémica e hipolipidémica. Una tiazolidinodiona particular descrita en el documento EP 0 306 228 A1 es el Compuesto A. La Solicitud de Patente Internacional, Número de Publicación WO 94/05659 describe ciertas sales del Compuesto A, incluida la sal maleato en su Ejemplo 1. El Compuesto A, o una sal farmacéuticamente aceptable del mismo, o un solvato farmacéuticamente aceptable del mismo, se puede preparar usando métodos conocidos, por ejemplo, los que se describen en los documentos EP 0 306 228 y WO 94/05659.
El Compuesto A es una base débil, farmacéuticamente aceptable.
El Compuesto A y las sales o solvatos farmacéuticamente aceptables del mismo, tienen útiles propiedades farmacéuticas. En particular, el Compuesto A, o una sal o solvato del mismo, está indicado como útil en el tratamiento y/o la profilaxis de la diabetes mellitus, trastornos asociados con la diabetes mellitus y determinadas complicaciones de la misma, el síndrome metabólico, la tolerancia alterada a la glucosa y la alteración de la glucosa en ayunas.
La Solicitud de Patente Internacional, Número de Publicación WO 01/35941 describe ciertas composiciones de dosis fija que comprenden una tiazolidinodiona tal como el Compuesto A o un derivado farmacéuticamente aceptable del mismo, y otro agente antidiabético adicional tal como hidrocloruro de metformina.
La Patente Europea Número 0 861 666 describe composiciones farmacéuticas que comprenden sensibilizadores de insulina tales como pioglitazona o Compuesto A, y metformina.
La Solicitud de Patente Internacional, Número de Publicación WO 00/28989 describe diversas composiciones farmacéuticas de liberación modificada que comprenden Compuesto A o una sal o solvato farmacéuticamente aceptable del mismo, y otro agente antidiabético adicional.
La Solicitud de Patente Internacional, Número de Publicación US 2003/0187074 describe un sistema de suministro oral que comprende una biguanida tal como hidrocloruro de metformina, que proporciona una liberación controlada de la biguanida, independiente del pH ambiental.
Reivindicaciones:
1. Una forma de dosificación oral, que comprende un núcleo erosionable que comprende 5-[4-[2-(N-metil-N-(2-piridil)-amino)-etoxi]-bencil]-tiazolidino-2,4-diona, o una sal o solvato farmacéuticamente aceptable de la misma, y metformina o una sal o solvato farmacéuticamente aceptable de la misma, en la que el núcleo tiene un revestimiento con una o múltiples aberturas que conducen al núcleo, caracterizada porque el revestimiento se erosiona bajo condiciones de pH predeterminadas.
2. Una forma de dosificación oral según la reivindicación 1, que comprende:
en la que la liberación de 5-[4-[2-(N-metil-N-(2-piridil)-amino)-etoxi]-bencil]-tiazolidino-2,4-diona o de una sal o solvato farmacéuticamente aceptable del mismo, y de la metformina o una sal o solvato farmacéuticamente aceptable de la misma, desde el núcleo erosionable, se produce sustancialmente a través de la(s) citada(s) abertura(s) y a través de la erosión de dicho revestimiento erosionable bajo condiciones de pH predeterminadas.
3. Una forma de dosificación oral según la reivindicación 1 ó 2, en la que el revestimiento erosionable es un revestimiento entérico.
4. Una forma de dosificación oral según la reivindicación 3, en la que el revestimiento entérico es impermeable.
5. Una forma de dosificación oral según la reivindicación 1, en la que el núcleo erosionable se formula para proporcionar la liberación inmediata tanto de 5-[4-[2-(N-metil-N-(2-piridil)-amino)-etoxi]-bencil]-tiazolidino-2,4-diona, o de una sal o solvato farmacéuticamente aceptable del mismo, como de la metformina o una sal o solvato farmacéuticamente aceptable de la misma.
6. Una forma de dosificación oral según una cualquiera de las reivindicaciones anteriores, en la que dicha forma de dosificación tiene la forma de comprimido.
7. Una forma de dosificación oral según una cualquiera de las reivindicaciones anteriores, en la que el revestimiento erosionable se erosiona en el intervalo de pH de 4,5 a 8.
8. Una forma de dosificación oral según una cualquiera de las reivindicaciones anteriores, en la que el revestimiento erosionable se erosiona en el intervalo de pH de 5 a 7.
9. Una forma de dosificación oral según las reivindicaciones 7 u 8, en donde el material usado para el revestimiento erosionable se selecciona de polímeros de polimetacrilato, poli(acetato-ftalato de vinilo) co-procesado, acetato-trimelitato de celulosa, acetato-ftalato de celulosa, polímeros de ftalato de hidroxipropil metilcelulosa y sus copolímeros.
10. Una forma de dosificación oral según la reivindicación 9, en donde dicho material de revestimiento se selecciona de acetato-trimelitato de celulosa, poli(acetato-ftalato de vinilo), ftalato de hidroxipropil metilcelulosa 55, Acryl-eze®, Aquateric®, acetato-ftalato de celulosa, Eudragit® L30D, Eudragit® L, Eudragit® S y laca.
11. Una forma de dosificación oral según la reivindicación 10, en donde dicho material de revestimiento es Eudragit® L30D.
12. Una forma de dosificación oral según cualquiera de las reivindicaciones precedentes, que comprende 2 a 12 mg de 5-[4-[2-(N-metil-N-(2-piridil)-amino)-etoxi]-bencil]-tiazolidino-2,4-diona.
13. Una forma de dosificación oral según la reivindicación 12, que comprende 4 u 8 mg de 5-[4-[2-(N-metil-N-(2-piridil)-amino)-etoxi]-bencil]-tiazolidino-2,4-diona.
14. Una forma de dosificación oral según cualquiera de las reivindicaciones precedentes, que comprende 100 a 3.000 mg de metformina.
15. Una forma de dosificación oral según la reivindicación 14, que comprende 500 o 1.000 mg de metformina.
16. Una forma de dosificación oral según cualquiera de las reivindicaciones precedentes, en donde la 5-[4-[2-(N-metil-N-(2-piridil)-amino)-etoxi]-bencil]-tiazolidino-2,4-diona está en forma de la sal maleato.
17. Una forma de dosificación oral según cualquiera de las reivindicaciones precedentes, en donde la metformina está en forma de sal hidrocloruro.
18. Una forma de dosificación oral según cualquiera de las reivindicaciones precedentes, en donde los tamaños típicos para la(s) abertura(s), cuando son circulares, que se han de formar en el revestimiento tienen un diámetro en el intervalo de 0,5 mm a 8 mm.
19. Una forma de dosificación oral según una cualquiera de las reivindicaciones 1 a 17, en donde las aberturas no circulares ocupan un espacio en el intervalo de 0,19 a 50,3 mm2.
20. Una forma de dosificación oral según cualquiera de las reivindicaciones precedentes, en donde el revestimiento erosionable que rodea el núcleo está provisto de dos aberturas que se extienden sustancialmente por completo a través de dicho revestimiento pero sin penetrar sustancialmente en dicho núcleo y comunican el ambiente de uso con dicho núcleo.
21. Una forma de dosificación oral según la reivindicación 20, en dopnde las aberturas en el revestimiento erosionable están en superficies opuestas.
22. Un procedimiento para la preparación de una forma de dosificación oral según la reivindicación 1, en donde dicho procedimiento comprende:
Patentes similares o relacionadas:
Uso de cannabinoides en el tratamiento de convulsiones atónicas en el síndrome de Lennox-Gastaut, del 29 de Julio de 2020, de GW Research Limited: Cannabidiol (CBD) para su uso en el tratamiento de las convulsiones en el síndrome de Lennox-Gastaut en el que el CBD está en forma de un extracto de cannabis […]
 Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Tratamientos de combinación que comprenden imidazopirazinonas para el tratamiento de trastornos psiquiátricos y/o cognitivos, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de Fórmula (I) **(Ver fórmula)** en donde n es 0 o 1; q es 0 o 1; R1 se selecciona del grupo que consiste en bencilo, indanilo, indolina y heteroarilos […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Combinación de anticuerpo anti-CD20 e inhibidor selectivo de PI3 quinasa, del 15 de Julio de 2020, de TG Therapeutics Inc: Un metodo in vitro para inhibir la proliferacion de una poblacion celular que comprende poner en contacto la poblacion con una combinacion que comprende […]