Composición para la prevención, tratamiento y diagnóstico de la enfermedad pulmonar obstructiva crónica (EPOC).
Una composición farmacéutica para su uso en un procedimiento para prevenir o tratar la enfermedad pulmonarobstructiva crónica,
que comprende la proteína citoqueratina 18 como principio activo, en la que la proteínacitoqueratina 18 tiene una secuencia de aminoácidos de SEC ID Nº 2.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2006/000380.
Solicitante: JEON, SOOK-YEONG.
Nacionalidad solicitante: República de Corea.
Dirección: 217-1702 SSANGYONG APARTMENT, 831 SANGHYEON-RI, SUJI-EUP YONGIN-SI, GYEONGGI-DO 449-843 REPUBLICA DE COREA.
Inventor/es: JEON,SOOK-YEONG, NAHM,DONG-HO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
PDF original: ES-2403905_T3.pdf
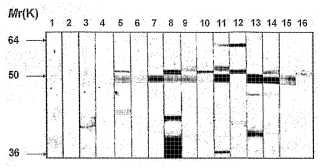
Fragmento de la descripción:
Composición para la prevención, tratamiento y diagnóstico de la enfermedad pulmonar obstructiva crónica (EPOC)
Antecedentes de la invención Campo de la técnica La presente invención se refiere a composiciones para la prevención, tratamiento y diagnóstico de la enfermedad pulmonar obstructiva crónica (EPOC) .
Técnica anterior
Actualmente, la enfermedad pulmonar obstructiva crónica (EPOC) se define como una enfermedad crónica que muestra obstrucción irreversible de las vías respiratorias a causa de la progresión de dos enfermedades 10 subyacentes principales, incluidas bronquitis crónica y enfisema pulmonar. La bronquitis crónica se define clínicamente como la persistencia de tos, esputo y dificultades respiratorias, un enfisema pulmonar se define histopatológicamente como la destrucción irreversible de las paredes de las vías respiratorias distales a los bronquiolos terminales y clínicamente muestra dificultades respiratorias lentamente progresivas (resumen del taller GOLD, Am J Respir Crit Care Med 2001; 163:1256-1276) . Por tanto, la definición actual de EPOC excluye un asma bronquial que muestra obstrucción reversible de las vías respiratorias. Actualmente, la EPOC es la cuarta causa principal de muerte en Estados Unidos y Europa y causas de muerte en pacientes con EPOC son las complicaciones de la enfermedad, como insuficiencia respiratoria o infección (resumen del taller GOLD, Am J Respir Crit Care Med 2001; 163:1256-1276) .
En la actualidad, el tabaquismo se considera como el factor de riesgo más importante para el desarrollo de EPOC. Y
las secreciones de muchos mediadores inflamatorios (IL-8 etc.) de las células epiteliales de las vías respiratorias estimuladas por el tabaquismo y otros factores, incluida la contaminación del aire o la infección crónica por bacterias o virus se consideran responsables del desarrollo de inflamación crónica del tejido de las vías respiratorias en la EPOC (resumen del taller GOLD, Am J Respir Crit Care Med 2001; 163:1256-1276) . No obstante, el motivo de la persistencia crónica de inflamación tras inflamación aguda inducida por dichos estímulos externos todavía no se ha 25 determinado. En consecuencia, se ha sugerido que otros mecanismos patogenéticos además del tabaquismo pueden estar implicados en el mecanismo patogenético de la EPOC (O’Byrne PM, Postma DS. Am J Respir Crit Care Med 1999; 159: S41-S66) . Especialmente, las razones de la persistencia de la inflamación de las vías respiratorias y la apoptosis de las células epiteliales de las vías respiratorias en pacientes con EPOC incluso después de dejar de fumar todavía no se han explicado (Hodge S y col., Eur Respir J 2005;25:447-54) . La etiología y
el mecanismo patogenético de la EPOC todavía no se han determinado y, por tanto, ahora el tratamiento fundamental de la EPOC es difícil. Los pacientes de EPOC que tienen enfermedad avanzada y una disminución grave de la función pulmonar tienen un riesgo elevado de muerte prematura asociada con la enfermedad (resumen del taller GOLD, Am J Respir Crit Care Med 2001; 163: 1256-1276) .
Actualmente, el diagnóstico de la enfermedad pulmonar obstructiva se puede establecer cuando los pacientes se quejen de síntomas clínicos típicos (tos, esputo y disnea etc.) y su FEV1 medido tras la inhalación de un broncodilatador muestra menos del 80 % del valor previsto y la proporción de FEV1/FVC sea inferior a 70 % en la prueba de la función pulmonar (resumen del taller GOLD, Am J Respir Crit Care Med 2001; 163:1256-1276) . No obstante, sigue sin haber una prueba de laboratorio que se pueda usar para la detección precoz de pacientes con EPOC con quejas de síntomas clínicos típicos pero que muestran una función pulmonar normal y, por tanto, que se pueda usar para la prevención de la progresión adicional de la EPOC.
Como terapia farmacológica de la EPOC, se sabe que los broncodilatadores y los corticosteroides son eficaces para la mejora de los síntomas clínicos. La administración directa de corticosteroides en el tejido de las vías respiratorias diana mediante dispositivos de inhalación es el método preferido sobre la administración sistémica para evitar efectos secundarios sistémicos. Otros medicamentos, tales como la teofilina, también pueden ser útiles. No 45 obstante, sigue sin haber un agente terapéutico disponible que pueda inducir una remisión completa de la EPOC o fundamentalmente mejorar la EPOC y modificar una evolución natural de la enfermedad.
Se ha comunicado la detección de autoanticuerpos frente a antígenos de tejidos de las vías respiratorias o pulmonares en pacientes con EPOC (Wagner V, y col., Acta Allergol 1965;20:1-9) . Aunque se ha propuesto una hipótesis de que la EPOC se debe a un mecanismo autoinmunitario (Agusti A, y col., Thorax 2003;58:832-834) , esta 50 hipótesis no se ha demostrado claramente porque todavía no se ha identificado un autoantígeno que reaccione con autoanticuerpos en la sangre de pacientes con EPOC. Recientemente se ha demostrado que el enfisema pulmonar (una de las enfermedades subyacentes principales causantes de EPOC) podría haberse desarrollado en animales mediante respuesta autoinmunitaria contra el autoantígeno endotelial vascular (Taraseviciene-Stewart L, y col., Am J Respir Crit Care Med. 2005;171:734-42) . En el estudio anterior se ha comunicado que ratas inmunizadas con 55 antígenos extraídos de células endoteliales vasculares humanas para inducir respuesta autoinmunitaria desarrollaron enfisema pulmonar y que la transferencia pasiva de células CD4+ desde los bazos de las ratas anteriores con enfisema pulmonar a ratas no tratadas previamente tuvo como resultado enfisema pulmonar en ratas receptoras y el enfisema pulmonar también se ha producido en ratones tras la inyección de anticuerpos anti-células endoteliales obtenidas de suero de ratas inmunizadas con células endoteliales vasculares (Taraseviciene-Stewart L, y col., Am J Respir Crit Care Med. 2005;171:734-42) . En este estudio se mostró que los anticuerpos contra antígenos de células endoteliales vasculares bastaban para desencadenar el desarrollo de enfisema pulmonar, aunque todavía no se habían identificado los autoantígenos diana implicados en el desarrollo de la enfermedad. En base a lo anterior, se ha sugerido que el mecanismo autoinmunitario podría estar implicado en la patogénesis de la EPOC.
Divulgación Problema de la técnica No obstante, en estudios anteriores no se ha podido establecer una relación causal entre la autoinmunidad y la EPOC debido a la falta de un autoantígeno identificado asociado con pacientes con EPOC y la falta de una asociación lógica entre los autoanticuerpos en el fluido corporal de pacientes con EPOC y los daños en el tejido de las vías respiratorias. Por tanto, actualmente no se usan las pruebas de autoanticuerpos para el diagnóstico o clasificación de la EPOC.
Dado que la etiología y el mecanismo primarios causantes del desarrollo de EPOC todavía no se entienden, todavía no se ha desarrollado un método de tratamiento que pueda inducir remisión completa de EPOC. La actual terapia farmacológica para la EPOC puede mejorar los síntomas clínicos y la función pulmonar únicamente durante la administración continua de medicación, pero no hay un método de tratamiento que pueda modificar la evolución natural a largo plazo de la EPOC o prevenir la muerte por EPOC.
Una proteína citoqueratina 18, que se identifica como un autoantígeno diana de la EPOC, es una proteína del citoesqueleto encontrada principalmente en las células epiteliales que revisten los tractos respiratorio y gastrointestinal, incluidas las células epiteliales bronquiales y las células epiteliales pulmonares (alveolares) (Moll,
R. y col., Cell 1982; 31:11-24) . Aunque la citoqueratina 18 es una proteína predominantemente intracelular, su fuerte expresión sobre la superficie celular también se observó en células epiteliales (Moll, R. y col., Cell 1982; 31:11-24; Saarloos, M.N. y col., Curr Eye Res 1999; 19:439-449) .
El documento WO 03/098211 se refiere a la detección de autoanticuerpos frente a la proteína citoqueratina 18 en pacientes con asma bronquial y rinitis crónica, y sus aplicaciones que incluyen un kit para el diagnóstico del asma bronquial y la rinitis crónica que comprende la proteína citoqueratina 18 de mamíferos. El documento WO 2006/073254 se refiere a la composición para prevención, tratamiento y diagnóstico de enfermedades inflamatorias crónicas de las vías respiratorias y es un documento EPC del artículo 54 (3) con respecto a la presente invención. El documento WO 03/023002 se refiere a nuevas proteínas humanas, polinucleótidos que los codifican y procedimientos que usan los mismos. Ryu y Scanlon (es decir,... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica para su uso en un procedimiento para prevenir o tratar la enfermedad pulmonar obstructiva crónica, que comprende la proteína citoqueratina 18 como principio activo, en la que la proteína citoqueratina 18 tiene una secuencia de aminoácidos de SEC ID Nº 2.
2. La composición para su uso de acuerdo con la reivindicación 1, en la que la enfermedad pulmonar obstructiva crónica es enfisema pulmonar o bronquitis crónica.
3. El uso de la proteína citoqueratina 18 como principio activo para la fabricación de una composición farmacéutica para usar en un procedimiento para prevenir o tratar la enfermedad pulmonar obstructiva crónica, en el que la proteína citoqueratina 18 tiene una secuencia de aminoácidos de SEC ID Nº 2.
4. El uso de acuerdo con la reivindicación 3, en la que la enfermedad pulmonar obstructiva crónica es enfisema pulmonar o bronquitis crónica.
5. Un procedimiento in vitro de diagnóstico de la enfermedad pulmonar obstructiva crónica usando composiciones diagnóstico que contienen la proteína citoqueratina 18 como principio activo, que comprende las etapas de:
(a) poner en contacto una muestra biológica de un sujeto que se sospecha que tiene enfermedad pulmonar obstructiva crónica, con proteína citoqueratina 18 para inducir la formación del complejo inmunitario; y
(b) diagnosticar dicha enfermedad pulmonar obstructiva crónica en el sujeto mediante la detección del anterior complejo inmunitario para determinar la presencia de autoanticuerpos frente a dicha proteína citoqueratina 18,
en el que la proteína citoqueratina 18 tiene una secuencia de aminoácidos de SEC ID Nº 2, en la que la enfermedad pulmonar obstructiva crónica se diagnostica cuando los pacientes se quejan de síntomas clínicos típicos, incluidos tos, esputo y disnea, y su FEV1 medido tras la inhalación de un broncodilatador mostraba menos del 80 % del valor predictivo y la proporción de FEV1/FVC era inferior a 70 % en la prueba de la función pulmonar.
6. El procedimiento de la reivindicación 5, en la que la enfermedad pulmonar obstructiva crónica es enfisema pulmonar o bronquitis crónica.
7. Un uso de una composición que comprende la citoqueratina 18 como material diana para la detección selectiva un agente terapéutico para la enfermedad pulmonar obstructiva crónica, en la que la proteína citoqueratina 18 tiene una secuencia de aminoácidos de SEC ID Nº 2.
8. El uso de acuerdo con la reivindicación 7, en la que la enfermedad pulmonar obstructiva crónica es enfisema pulmonar o bronquitis crónica.
9. Un procedimiento in vitro para ayudar en la detección de la enfermedad pulmonar obstructiva crónica en un sujeto humano, que comprende las etapas de:
(a) poner en contacto una muestra biológica del sujeto humano con la proteína citoqueratina 18 para formar un complejo inmunitario entre la proteína citoqueratina 18 y la muestra biológica con autoanticuerpos, y
(b) determinar la presencia de los autoanticuerpos contra dicha proteína citoqueratina 18 en la muestra biológica detectando el complejo inmunitario, en la que la presencia de los autoanticuerpos comporta una correlación positiva con la existencia de enfermedad pulmonar obstructiva crónica en el sujeto humano,
en el que la proteína citoqueratina 18 tiene una secuencia de aminoácidos de SEC ID Nº 2, en la que la enfermedad pulmonar obstructiva crónica se diagnostica cuando los pacientes se quejan de síntomas clínicos típicos, incluidos tos, esputo y disnea, y su FEV1 medido tras la inhalación de un broncodilatador mostraba menos del 80 % del valor predictivo y la proporción de FEV1/FVC era inferior a 70 % en la prueba de la función pulmonar.
10. El procedimiento de la reivindicación 9, en la que la enfermedad pulmonar obstructiva crónica es enfisema pulmonar o bronquitis crónica.
Patentes similares o relacionadas:
Dispositivos modulares para puntos de atención y usos de los mismos, del 29 de Julio de 2020, de Labrador Diagnostics LLC: Un sistema para la detección automatizada de un analito a partir de una muestra de fluido corporal, que comprende: un dispositivo de fluidos que comprende: […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Un ensayo de la respuesta inmunológica mediada por células, del 17 de Junio de 2020, de Cellestis Limited: Un método para medir una actividad de respuesta inmunológica mediada por células, comprendiendo dicho método: (a) proporcionar una composición de incubación […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]