Composición y método para tratar o prevenir la fibrosis del músculo esquelético.
Composición farmacéutica para su uso en el tratamiento y/o su uso en la prevención de la fibrosis de losmúsculos esqueléticos en un sujeto que lo necesita,
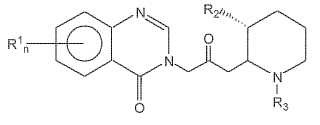
la composición comprendiendo una cantidadfarmacéuticamente eficaz de un compuesto en combinación con un portador farmacéuticamenteaceptable, el compuesto con una fórmula:**Fórmula**
donde: n es o bien 1 o 2;
R1 es un miembro en el grupo que consiste en hidrógeno, halógeno, nitro, benzo, alquiloalcoxi inferior; R2 es un miembro del grupo que consiste en hidroxi, acetoxi y alcoxi inferior; y R3 es un
miembro del grupo que consiste en hidrógeno y alquenoxi-carbonilo inferior y sales farmacéuticamenteaceptables de los mismos.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IL2008/000088.
Solicitante: Agricultural Research Organization.
Nacionalidad solicitante: Israel.
Dirección: Ministry of Agriculture Volcani Center P.O. Box 6 50250 Bet Dagan ISRAEL.
Inventor/es: PINES, MARK, NAGLER, ARNON.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/517 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinazolina, perimidina.
PDF original: ES-2447834_T3.pdf
Fragmento de la descripción:
Composición y método para tratar o prevenir la fibrosis del músculo esquelético
CAMPO DE LA INVENCIÓN
La presente invención hace referencia a un método para tratar la fibrosis y más en particular a un 5 tratamiento, prevención o mejora de la fibrosis del músculo esquelético mediante el uso de halofuginona o de compuestos relacionados.
ANTECEDENTES DE LA INVENCIÓN
La fibrosis muscular es un fenómeno que suele ocurrir en un músculo enfermo o dañado. Se caracteriza por el crecimiento excesivo de tejido fibroso, que normalmente es resultado del intento que realiza el cuerpo para 10 recuperarse de una lesión. La fibrosis perjudica la función muscular y provoca debilidad. La cantidad de pérdida de función muscular generalmente aumenta con el alcance de la fibrosis. La fibrosis es normalmente progresiva y puede contribuir a la inhabilidad del paciente para llevar a cabo tareas ordinarias para llevar una vida independiente como sujetar objetos o andar. La fibrosis suele ocurrir como resultado de una distrofia muscular, así como debido a otras aflicciones, como una atrofia por denervación, una degradación de tejido muscular
provocada por una pérdida de contacto neural con un músculo. Para algunos tipos de distrofia muscular, como la de Duchenne, la fibrosis puede resultar en muerte a medida que los músculos del diafragma se ven afectados (el diafragma es un músculo esquelético que es involuntario y no voluntario) .
Las distrofias musculares son un grupo heterogéneo de trastornos genéticos caracterizados por la pérdida progresiva de la fuerza e integridad del músculo. Un músculo distrófico muestra variación en el tamaño de la fibra muscular, la infiltración de tejido conjuntivo y adiposo, y en los núcleos situados centralmente. Las membranas de las fibras son frágiles y sufren un daño considerable, lo que lleva a la necrosis y pérdida del músculo.
Las víctimas de distrofias musculares, particularmente distrofia muscular de Becker (BMD) y distrofia muscular de Duchenne (DMD) , sufren frecuentemente una fibrosis de músculo esquelético a medida que la enfermedad progresa.
La forma más común de distrofia muscular es la DMD ligada al cromosoma X recesivo, una manifestación de alelo altamente penetrante que afecta a 1 de cada 3.500 machos nacidos vivos; aproximadamente un tercio de los casos ocurre como una mutación de novo en el bebé (Emer y AE. (1991) Neuromusc. Disord. 1:19-29) .
Normalmente la enfermedad se diagnostica a los 4-5 años y al llegar a los 8-10 años, el deterioro de la afección en el paciente hace necesario el uso de una silla de ruedas. A mitad de la adolescencia, aparecen otros síntomas neurológicos y cardiológicos. La progresión de la degeneración del músculo y el empeoramiento de los síntomas clínicos, llevan a la muerte al final de la adolescencia o hacia los veinte años, normalmente como consecuencia de complicaciones cardio-pulmonares debido a la fibrosis del diafragma.
Las principales causas de muerte en víctimas de la DMD, fallo respiratorio y cardíaco, son consecuencia de la debilidad en los músculos del diafragma y del miocardio que son los más afectados por la fibrosis 35 (Finsterer, (2003) Cardiology 99:1-19) . La fibrosis se caracteriza por un aumento en los constituyentes de la matriz extracelular (MEC) especialmente el colágeno tipo I. Tanto en la DMD como en la distrofia muscular congénita (CMD) , se observó un aumento de los colágenos tipo I y III en el músculo esquelético (Hantai et al. (1985) ConnectTissue Res. 13:273-81 y Dunace, et al. (1980) Nature 284:470-472) provocando la fibrosis, que guarda relación con la destrucción del músculo (Zhao, et al. (2003) J. Patho. 201:149-59) . La implicación cardíaca en la DMD se caracteriza patológicamente por la degeneración y la fibrosis del miocardio, probablemente debido a una actividad del miofibroblasto, centrándose alrededor de la pared posterolateral del ventrículo izquierdo.
La BMD es una afección menos grave que la DMD, caracterizada por una lenta debilitación progresiva muscular de las piernas y la pelvis, de nuevo por culpa de la fibrosis de los músculos (pese a que los músculos 45 esqueléticos se ven mucho más afectados por la BMD) . La progresión de la fibrosis suele provocar una mayor pérdida de movilidad y una esperanza de vida reducida. En algún momento, el paciente puede volverse demasiado débil para andar y necesita una silla de ruedas.
Tanto la BMD como la DMD se asocian a defectos en el gen de la distrofina, el gen responsable de la producción de proteína de la distrofina, que es una parte vital del complejo distrofino-glicoproteico. La DMD se 50 caracteriza por la ausencia casi de la proteína de la distrofina en músculos esqueléticos, mientras que los resultados de la BMD a partir de diferentes mutaciones en el mismo gen, resultan en una distrofina reducida o
dañada. La presencia de distrofina protege los músculos de aquellos con BMD de una degeneración tan mala o tan rápida como la de las víctimas de DMD.
El complejo distrofino-glicoproteico conecta el citoesqueleto de actina de miofibrillas a la matriz extracelular (ECM) y es por lo tanto integral con la estructura contráctil del músculo (Yue Y, et al. (2003) 5 Circulation, 108:1626 y Michele et al. (2003) J. Biol. Chem. 278:15457-60) . La etapa preliminar del DMD se caracteriza por la presencia de grupos focales de miofibrillas necróticas, hipertrofia muscular y niveles anormalmente altos de creatina quinasa (CK) muscular. En la fase patológica, ciclos repetidos de degeneración agotan la capacidad regenerativa de las células progenitoras (células satélite) y mecanismos fibrosos provocan el reemplazo progresivo del tejido muscular con tejido conjuntivo colagenoso (Rafael et al., 1997) . Estos procesos llevan a la contracción de la articulación, pérdida de movilidad y muerte por fallo respiratorio o cardíaco (Wells, et al. (2002) Neuromuscle Discord.12 Suppl 1:S11-22) .
La solución perfecta para los pacientes DMD y BMD sería situar una copia normal del gen de distrofina en las células musculares, y así restaurar la suficiente expresión proteínica como para mejorar la estructura y la función (Khurana, et al. (2003) Nat Rev Drug Discov. 2:379-90) . A 3, 0 MB el gen de distrofina es amplio, y una terapia exitosa requeriría una transferencia masiva y sostenida de gen (Hffman, et al. (1987) Cell 51:919-28 and Skuk, et al. (2002) Curr. Opin. Neurol. 15:563-9 and Thioudellet, et al. (2002) Neuromuscul Disord. 12 Suppl 1:S49-51) . La fibrosis muscular es un obstáculo mayor en la terapia génica ya que dificulta la administración de gen.
Una alternativa a reemplazar el gen defectuoso consiste en modular su expresión al emplear
oligonucleótidos antisentido que alteran la estabilidad del ARN, o en hacer un empalme genético (Lu QI, et al. (2003) Nat. Med. 9 (8) :1009-14 y Rando TA. (2002) Am. J. Phy. Med. Rehabil. 81 (11Suppl) :S175-86) , provocando así la producción de una proteína funcional. El trasplante de las células precursoras (transferencia de mioblasto) también se ha estudiado como un método para restaurar la proteína de distrofina del músculo distrófico (Law PK et al. (1997) Transplant Proc. 29 (4) :2234-7) . Esta técnica está limitada por las dificultades asociadas al
tratamiento de grandes volúmenes de músculo con efecto duradero. Un enfoque alternativo consiste en una regulación por aumento de la expresión de una proteína endógena que afecta alguna sustitución funcional (Krag TO, et al. (2001) Acta Physiol Scand. 171: 349-58) . Sin embargo, todos estos tratamientos no son efectivos a no ser que la progresión de la afección fibrosa subyacente pueda detenerse o al menos mejorarse de alguna manera.
El rol crucial del colágeno en la fibrosis ha incitado intentos para desarrollar agentes que inhiban o modulen su acumulación. Algunas enzimas post-transcripcionales únicas de la vía de biosíntesis de colágeno parecen objetivos atractivos para reducir la formación de fibras de colágeno o la acumulación de fibras con propiedades alteradas (Prockop DJ, (1995) Annu Rev Biochem. 64:403-34) .
La mayor desventaja de estos inhibidores es que no son específicos para el tipo de colágeno y pueden 35 inhibir la biosíntesis de otros colágenos provocando serias consecuencias tóxicas.
Hasta la fecha no existe una terapia efectiva para reducir la fibrosis del músculo esquelético. No se conoce en la actualidad ningún tratamiento que afecte al tejido fibroso sin afectar negativamente la salud del tejido muscular u otras funciones corporales. El único tratamiento que ha mostrado eficacia clínica es un tratamiento de prednisona/prednisolona que provoca un modesto... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéut tica para su uso en el tratamiento y/o su uso en la prevvención de la fibrosis de los músculos esqueléticos en un sujeto que lo necesita, la composición com mprendiendo una cantidad farmacéuticamente efic caz de un compuesto en combinación con un po ortador farmacéuticamente aceptable, el compuesto o con una fórmula:
donde: n es o bien 1 o 2 2;
R1es un miembro en el l grupo que consiste en hidrógeno, halógeno, nitro, bennzo, alquilo inferior, fenilo y alcoxi inferior; R2es un n miembro del grupo que consiste en hidroxi, acetoxi y y alcoxi inferior; y R3 es un miembro del grupo que e consiste en hidrógeno y alquenoxi-carbonilo inferior y sales farmacéuticamente aceptables de los mismo
os.
2. Composición farmacéut tica para su uso en la mejora o la inducción de la reg generación de los músculos esqueléticos en un sujeto que lo necesita, la composición comp prendiendo una cantidad farmacéuticamente efic caz de un compuesto en combinación con un po ortador farmacéuticamente aceptable, el compuestoo con una fórmula:
donde es o bien 1 o 2;
R1es un miembro del g grupo que consiste en hidrógeno, halógeno, nitro, ben nzo, alquilo inferior, fenilo y alcoxi inferior;
R2es un miembro del ggrupo que consiste en hidroxi, acetoxi y alcoxi inferio or; y R3 es un miembro del grupo que consiste e en hidrógeno y alquenoxi-carbonilo inferior y las sales farmacéuticamente aceptables de los mismo
os.
3. Composición farmacéuttica para su uso de acuerdo con la reivindicación 1, e en la que dicho compuesto es halofuginona.
4. Composición farmacéut tica para su uso de acuerdo con las reivindicaciones 1 1 y 3, en la que dicho sujeto sufre un trastorno que e engloba un tejido de músculo esquelético.
5. Composición farmacéuttica para su uso de acuerdo con las reivindicaciones s 1, 3 y 4, en la que dicho trastorno es una distrofi ia muscular.
6. Composición farmacéu utica para su uso de acuerdo con la reivindicación 55, en la que dicha distrofia muscular se selecciona del grupo que consiste en distrofia muscular de Duch henne, distrofia muscular de Becker, distrofia musc cular de Emer y -Dreifuss, distrofia muscular de cin
nturas, distrofia muscular
facioescapulohumeral, distrofia miotónica, distrofia muscular oculofaringea, , distrofia muscular distal, miopatía de Miyoshi y d distrofia muscular congénita.
7. Composición farmacéuti n
ica para su uso de acuerdo con la reivindicación 4, en la que dicho trastorno es una atrofia por denervac ción.
8. Composición farmacéuttica para su uso de acuerdo con la reivindicación 4, , en la que dicho tejido de músculo esquelético es el músculo de diafragma.
9. El uso de un compuestoo con una fórmula:
donde: n es o bien 1 o 2 2; R1es un miembro del g grupo que consiste en hidrógeno, halógeno, nitro, ben nzo, alquilo inferior, fenilo y alcoxi inferior; R2es un n miembro del grupo que consiste en hidroxi, acetoxi y y alcoxi inferior; y R3 es un miembro del grupo que e consiste en hidrógeno y alquenoxi-carbonilo inferior y sales farmacéuticamente aceptables de los mismoos. 20 en la elaboración de un medicamento para reducir la progresión de la fibrosis de los músculos esqueléticos en un suje eto que lo necesita.
10. El uso de acuerdo con laa reivindicación 9, en el que dicho compuesto es halof fuginona.
11. El uso de acuerdo con laa reivindicación 9, en el que dicho sujeto sufre un trasttorno que afecta a un tejido de músculo esquelético..
12. El uso de acuerdo con laa reivindicación 11, en el que dicho trastorno es una diisfrofia muscular.
13. El uso de acuerdo con la reivindicación 12, en el que dicha distrofia muscul lar se selecciona del grupo que consiste en distrofi cker, distrofia muscular de ia muscular de Duchenne, distrofia muscular de Bec Emer y -Dreifuss, distrof fia muscular de cinturas, distrofia muscular facioeescapulohumeral, distrofia miotónica, distrofia musscular oculofaringea, distrofia muscular distal, miopa atía de Miyoshi y distrofia muscular congénita.
14. El uso de acuerdo con la t
a reivindicación 11, en el que dicho trastorno es una atrofia por denervación.
15. El uso de acuerdo con la re eivindicación 11, en el que dicho tejido de músculo es squelético es el músculo de diafragma.
Dibujos
Halofuginona Fibroblastos Mioblastos Miostatina miogeninaColágeno Tipo I Miogénesis FIGURA 1
Cuádriceps Tibial anterior
Contenido colágeno Expresión génica de colágeno α1 (I) Contenido colágeno Expresión génica de colágeno α1 (I)
FIGURA 2
Diafragma
Gastrocnemio Tibial
Tiempo (semanas)
FIGURA 3
Proporción R/V Proporción R/V Proporción R/V
Proporción R/V Proporción R/V Proporción R/V
Proporción R/V Proporción R/V Proporción R/V
Patentes similares o relacionadas:
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Inhibidores de PDK1 heterocíclicos para uso para tratar cáncer, del 17 de Junio de 2020, de SUNESIS PHARMACEUTICALS, INC.: Un compuesto seleccionado del grupo que consiste en: **(Ver fórmula)** y sales farmacéuticamente aceptables del mismo, para uso en un método de tratamiento […]
Actividad antitumoral de inhibidores de multicinasas en cáncer colorrectal, del 10 de Junio de 2020, de ENTRECHEM, S.L: Composición para uso en la prevención y/o el tratamiento de cáncer colorrectal en un paciente, que comprende: a) un compuesto de fórmula (I) **(Ver fórmula)** […]
Aza-aril 1H-pirazol-1-il-bencenosulfonamidas como antagonistas de CCR(9), del 10 de Junio de 2020, de CHEMOCENTRYX, INC.: Un compuesto o sal del mismo de la fórmula (II): **(Ver fórmula)** donde R1 se selecciona del grupo que consiste en alquilo C2-8 sustituido o no sustituido, […]
4,6-diaminoquinazolinas como moduladores de cuna y métodos de uso de los mismos, del 13 de Mayo de 2020, de GILEAD SCIENCES, INC.: Un compuesto de Fórmula I: **(Ver fórmula)** en donde R1 es C1-9 alquilo, C3-15 cicloalquilo, heterociclilo, heteroarilo, o C6-10 arilo; en donde cada […]
Forma amorfa de un compuesto de pirimidinil-ciclopentano inhibidor de la AKT, composiciones y métodos de la misma, del 6 de Mayo de 2020, de GENENTECH, INC.: Monohidrocloruro de (S)-2-(4-clorofenil)-1-(4-((5R,7R)-7-hidroxi-5-metil-6,7-dihidro-5H-ciclopenta[d]pirimidin-4- il)piperazin-1-il)-3-(isopropilamino)propan-1-ona amorfo.
Combinaciones de moduladores duales de IRS/STAT3 y agentes anticancerígenos para el tratamiento del cáncer, del 29 de Abril de 2020, de TyrNovo Ltd: Una composición farmacéutica que comprende un inhibidor de EGFR y/o un anticuerpo EGFR en combinación con un compuesto representado por la estructura […]