Composición de liposomas de colistina para su uso terapéutico por vía intravenosa, oral y cutánea, y procedimiento para su preparación.
Un procedimiento para la preparación de una composición de liposomas que contiene colistina para suuso terapéutico por vía intravenosa,
oral y tópica, caracterizado porque prevé las siguientes etapas:
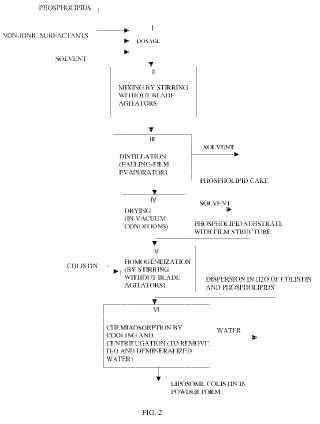
I) una etapa de dosificación, en la que una cantidad apropiada de fosfolípidos se disuelve en una mezcla decloroformo y etanol, en un reactor de fondo redondo;
II) una etapa de mezcla, en la que la solución obtenida se mezcla por agitación;
III) una etapa de destilación, en la que dicha solución se procesa en un evaporador rotatorio, destilando eldisolvente para obtener una torta de fosfolípidos;
IV) una etapa de secado, en la que la torta obtenida de esta manera se seca de las trazas residuales dedisolvente por medio de destilación en condiciones de vacío a una temperatura no superior a 35 ºC paraobtener un sustrato de fosfolípidos con una estructura de película;
V) una etapa de homogeneización, en la que añadido a dicho sustrato de fosfolípidos se encuentra unasolución fisiológica de colistina, para obtener una dispersión que se homogeneiza por agitación durante untiempo suficiente para dispersar el soluto por completo;
VI) una etapa de quimioadsorción de colistina en el sustrato de liposomas, en la que la dispersiónhomogeneizada se enfría a una temperatura mínima de 4 ºC y finalmente se centrifuga con una aceleraciónde al menos 20.000 g, durante un tiempo suficiente para expulsar todo el agua, con el fin de extraer de lacentrífuga dicha colistina en el sustrato de liposomas en forma de polvo
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E08172770.
Solicitante: Tascini, Carlo.
Nacionalidad solicitante: Italia.
Dirección: Via C. Battisti 26 55048 Torre del Lago-Viareggio (LU) ITALIA.
Inventor/es: TASCINI,CARLO, TASCINI,GIOVANNI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos cíclicos.
- A61K9/127 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Liposomas.
PDF original: ES-2426986_T3.pdf
Fragmento de la descripción:
Composición de liposomas de colistina para su uso terapéutico por vía intravenosa, oral y cutánea, y procedimiento para su preparación. 5 RESUMEN DE LA INVENCIÓN
La presente invención se refiere a una composición de liposomas que contiene la colistina antibiótica, que, gracias al hecho de portarse por los liposomas, puede administrarse por vía intravenosa a dosificaciones superiores con mayor 10 eficacia clínica, alcanzando concentraciones tisulares mayores y sin determinar una toxicidad grave. En las formulaciones orales, la composición de liposomas de colistina puede usarse como un descontaminante intestinal, mientras que, en las formulaciones tópicas, tales como cremas o geles, puede usarse en el tratamiento de infecciones cutáneas o en la profilaxis de infecciones en pacientes afectados por quemaduras. También forma el objeto de la presente invención el procedimiento para la preparación de la composición de liposomas que contiene colistina que se ha mencionado anteriormente.
ESTADO DE LA TÉCNICA
La colistina antibiótica La colistina o polimixina E es un antibiótico polipeptídico, que se aisló en Japón en 1947 a partir de Bacillus Polymyxa subesp. Colistinus y ha estado disponible para su uso clínico desde 1959.
La colistina tiene una estructura heptapeptídica y una cadena lateral N-terminal acetilada por un ácido graso para 25 formar decapéptidos como se muestra en la figura 1A.
El conjunto de diferentes decapéptidos correlacionados estrictamente entre sí forma la colistina, cuyos dos componentes principales son colistina A a colistina B, que difieren entre sí por sus ácidos grasos: ácido 6-metil octanoico y ácido 6-metil heptanoico, respectivamente.
Se sebe que la colistina es un bactericida contra bacterias Gram-negativas con un mecanismo similar al de los detergentes en la membrana externa y en la membrana citoplasmática. De hecho, puede unirse a los lipopolisacáridos y los fosfolípidos de la membrana y quela también los cationes de los mismos, provocando de este modo un daño a la membrana, de lo que deriva la lisis osmótica del microorganismo.
La colistina administrada por vía intravenosa está generalmente en su forma metano-sulfonato, que, sin embargo, han demostrado ser de 4 a 8 veces menos activa que la colistina pero en cualquier caso presenta actividad bactericida.
El documento WO 2007/117550 desvela una formulación liposomal de antiinfecciosos similares a colistina.
El contexto clínico mundial
Actualmente, en entornos hospitalarios por todo el mundo, se ha descubierto que las infecciones resultantes de 45 bacterias Gram-negativas han demostrado ser resistentes a la quimioterapia.
La más peligrosa de estas bacterias es Pseudomonas aeruginosa MDR (resistente a múltiples fármacos, Multi Drug Resistant) .
P. aeruginosa es resistentes intrínsecamente a muchos antibióticos, incluyendo los betalactámicos, las antiguas quinolonas, cloramfenicol (CAF) , tetraciclinas, macrólidos, sulfamidas y rifampicina, a pesar de que la rifampicina puede tener un efecto sinérgico si se asocia con las polimixinas.
Además, una permeabilidad reducida de la membrana externa y la presencia de numerosas bombas de eflujo 55 permiten la resistencia de P. aeruginosa a numerosos antibióticos (quinolonas, tetraciclinas, CAF, macrólidos, sulfamidas, aminoglucósidos, y muchos betalactámicos) . Si a estos mecanismos se les asocia las numerosas betalactamasas, entonces las herramientas terapéuticas contra estas bacterias se reducen a sólo unas pocas moléculas.
Las cepas "pan-resistentes" son más y se informan con más frecuencia, a pesar de que rara vez se informa de sensibilidad a polimixina.
En consecuencia, la colistina ha vuelto a adquirir una importancia considerable debido al desarrollo de cepas que 5 son resistentes a todos los antibióticos, excepto a polimixina.
A este respecto, la colistina ha demostrado ser un fármaco que puede estar asociado a diferentes moléculas con una eficacia bastante buena a pesar de que presenta efectos secundarios renales graves que limitan el uso de la misma.
La colistina puede asociarse también a antibióticos betalactámicos, en particular carbapenémicos, que tienen mecanismos de resistencia en la pared externa del microorganismo (es la diana de la colistina que actúa en la misma en forma de agente tensioactivo) .
La farmacocinética de la colistina se ve afectada por su hidrofilia, que no permite alcanzar suficientes concentraciones en ciertos tejidos; de hecho, no penetra muy lejos en el pulmón, en el hueso o en el SNC.
Descripción de la invención La descripción de la invención se entenderá más fácilmente con referencia a las láminas adjuntas de dibujos, en los que:
La figura 1A muestra la estructura química de la colistina, donde α y γ indican -NH2 en el enlace peptídico, Dab es ácido diaminobutírico, Leu es leucina, y Thr es treonina;
la figura 1B muestra la estructura química de un derivado de la misma, tal como colistimetato sódico; la figura 2 es un diagrama de bloques del procedimiento de preparación de la colistina en liposomas de acuerdo con la invención.
Por el término "colistina" en la presente invención se refiere a todas las formas salificadas y/o los derivados 30 conocidos de la colistina antibiótica, tal como el colistimetato sódico ilustrado en la figura 1B.
Se sabe que los vehículos coloidales, tales como los liposomas, son capaces de modificar la farmacocinética de los fármacos y su toxicidad. En general, la asociación a los liposomas no conduce a ninguna pérdida de la capacidad antimicrobiana.
De acuerdo con la presente invención, se prevé transportar la colistina a través de los liposomas para ponerla en altas concentraciones en los sitios tisulares de infección sin tener ningún efecto secundario a nivel renal.
Los liposomas son microesferas huecas formadas por una o más capas lipídicas dobles. Desde los setenta se han usado (de forma experimental) como vehículos de fármacos, y el entendimiento de su comportamiento in vivo ha permitido la realización de estudios dirigidos sobre el tratamiento específico de determinadas afecciones patológicas. Actualmente, varias firmas farmacéuticas implicadas en biotecnología trabajan exclusivamente con liposomas para el desarrollo de diferentes tratamientos: tratamientos antibióticos, tratamientos antitumorales, tratamientos de sensibilización alérgica, terapia génica, etc.
El interés de los liposomas considera su membrana (constituida por colesterol y fosfolípidos, tal como fosfatidil colina y diacetilfosfato) , la estructura, la composición, y cuyas proporciones son prácticamente idénticas a las de la membrana de las células huésped.
Los fosfolípidos son ésteres de glicerol con ácidos grasos en las posiciones 1 y 2 y con ácido fosfórico en la posición 3. A su vez, el último se une a bases amina de bajo peso molecular. Son componentes fundamentales de las membranas celulares y de los complejos de lipoproteínas implicados en la absorción y transporte de lípidos, y tienen una cola hidrófoba y una cabeza hidrófila que, mediante disolución en agua, se reorganizan de la siguiente manera: las colas hidrófobas se atraen entre sí, mientras que las cabezas hidrófilas se colocan en contacto con el exterior y
con el entorno acuoso interno (la disposición es similar a la de las micelas) . Como resultado, se forman capas lipídicas dobles, que se cierran para formar pequeñas vesículas similar a las células del microorganismo y a sus organelos.
Las esferas o liposomas que se han mencionado anteriormente constituyen pequeños depósitos que pueden contener un antígeno, un antibiótico, un alérgeno, un fármaco o un gen (terapia génica) y pueden introducirse en el organismo sin causar reacciones inmunes de rechazo.
Las características de los liposomas pueden modificarse de acuerdo con los diferentes fármacos transportados. Por
ejemplo, para reducir la velocidad de degradación del liposoma y ralentizar la liberación de su contenido, se modifican la composición y las dimensiones del mismo. Esto también es posible para aumentar la afinidad de los liposomas para un determinado tejido modificando su composición, la carga eléctrica (añadiendo estearilamina, se obtienen vesículas con carga positiva; con fosfato de diacetilo, se obtienen cargas negativas) o también añadiendo receptores o antígenos adhesivos, lo que aumenta la concentración del fármaco en el órgano diana.
Dado que los liposomas pueden encapsular fármacos, proteínas y enzimas, los sistemas pueden administrarse por vía intravenosa, oral o intramuscular.... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para la preparación de una composición de liposomas que contiene colistina para su uso terapéutico por vía intravenosa, oral y tópica, caracterizado porque prevé las siguientes etapas:
I) una etapa de dosificación, en la que una cantidad apropiada de fosfolípidos se disuelve en una mezcla de cloroformo y etanol, en un reactor de fondo redondo; II) una etapa de mezcla, en la que la solución obtenida se mezcla por agitación; III) una etapa de destilación, en la que dicha solución se procesa en un evaporador rotatorio, destilando el
disolvente para obtener una torta de fosfolípidos; IV) una etapa de secado, en la que la torta obtenida de esta manera se seca de las trazas residuales de disolvente por medio de destilación en condiciones de vacío a una temperatura no superior a 35 ºC para obtener un sustrato de fosfolípidos con una estructura de película; V) una etapa de homogeneización, en la que añadido a dicho sustrato de fosfolípidos se encuentra una solución fisiológica de colistina, para obtener una dispersión que se homogeneiza por agitación durante un tiempo suficiente para dispersar el soluto por completo; VI) una etapa de quimioadsorción de colistina en el sustrato de liposomas, en la que la dispersión homogeneizada se enfría a una temperatura mínima de 4 ºC y finalmente se centrifuga con una aceleración de al menos 20.000 g, durante un tiempo suficiente para expulsar todo el agua, con el fin de extraer de la centrífuga dicha colistina en el sustrato de liposomas en forma de polvo.
2. El procedimiento para la preparación de una composición de liposomas de acuerdo con la reivindicación 1, caracterizado porque los fosfolípidos que se disuelven en la mezcla de cloroformo y etanol tienen una proporción en peso de 5:1 con respecto a la colistina que se producirá y porque añadidos a dichos fosfolípidos se encuentran tensioactivos no iónicos según sea necesario.
3. El procedimiento para la preparación de una composición de liposomas de acuerdo con la reivindicación 1, caracterizado porque en la etapa de dosificación, la cantidad de disolvente, constituido por la mezcla de cloroformo y etanol, es al menos 20 veces en exceso con respecto a los fosfolípidos que se usarán.
4. El procedimiento para la preparación de una composición de liposomas de acuerdo con la reivindicación 1, caracterizado porque la duración de la etapa de mezcla es de al menos 2 horas.
5. El procedimiento para la preparación de una composición de liposomas de acuerdo con la
reivindicación 1, en el que el evaporador usado en la etapa de destilación es un evaporador rotatorio de película descendente y la temperatura operativa máxima se mantiene por debajo de 40 ºC.
6. El procedimiento para la preparación de una composición de liposomas de acuerdo con la reivindicación 1, en el
que la etapa de secado tiene una duración de aproximadamente 2-3 horas. 40
7. El procedimiento para la preparación de una composición de liposomas de acuerdo con la reivindicación 1, en el que la solución fisiológica de colistina que se añade en la etapa de homogeneización tiene una concentración de 10 mg/ml de agua desmineralizada.
8. Uso de una composición de liposomas obtenida mediante el procedimiento de acuerdo con la reivindicación 1 para la preparación de composiciones farmacéuticas en el tratamiento clínica contra bacterias multirresistentes (MDR) Gram-negativas, en una formulación intravenosa.
9. Uso de una composición de liposomas obtenida mediante el procedimiento de acuerdo con la 50 reivindicación 1, para la preparación de composiciones farmacéuticas en el tratamiento clínico contra bacterias multirresistentes (MDR) Gram-negativas, en una formulación oral.
10. Uso de una composición de liposomas obtenida mediante el procedimiento de acuerdo con la reivindicación 1, para la preparación de composiciones farmacéuticas en el tratamiento clínico contra bacterias 55 multirresistentes (MDR) Gram-negativas, en formulaciones tópicas.
11. Composición de liposomas obtenidas mediante el procedimiento de acuerdo con la reivindicación 1, para la preparación cremas o geles que pueden usarse en el tratamiento clínico para infecciones cutáneas.
12. Composición de liposomas obtenida mediante el procedimiento de acuerdo con la reivindicación 1, para la preparación de cremas o geles que pueden usarse en la profilaxis de infecciones en pacientes afectados por quemaduras.
Patentes similares o relacionadas:
Una formulación lista para su uso para la inyección de liposoma de sulfato de vincristina, del 1 de Julio de 2020, de SPECTRUM PHARMACEUTICALS, INC: Una composición de vincristina lista para su uso que comprende; una fase acuosa continua que comprende un primer tampón acuoso, una fase liposómica […]
Nuevo método de producción de lipoplejo para administración local y fármaco antitumoral que utiliza lipoplejo, del 24 de Junio de 2020, de Delta-Fly Pharma, Inc: Un método para producir un lipoplejo que comprende dioleilfosfatidiletanolamina (DOPE), fosfatidilcolina, un lípido catiónico y moléculas de ARNi, que comprende las etapas […]
Liposomas que encapsulan conjuntamente un bifosfonato y un agente anfipático, del 17 de Junio de 2020, de YISSUM RESEARCH DEVELOPMENT COMPANY OF THE HEBREW UNIVERSITY OF JERUSALEM LTD: Un liposoma que comprende una membrana y una fase de agua intraliposómica acuosa, comprendiendo la membrana al menos un lípido que forma un liposoma y […]
Composición que contiene ácido graso poliinsaturado, del 17 de Junio de 2020, de SUNSTAR INC.: Utilización externa de una composición que comprende un componente (A) y un componente (B) mostrados a continuación, dispersándose el componente […]
Estructura de oligonucleótidos de tipo nanopartícula mejorada que tiene alta eficiencia y método para preparar la misma, del 27 de Mayo de 2020, de Bioneer Corporation: Estructura de oligonucleótidos que tiene una estructura representada por la siguiente fórmula estructural o fórmula estructural . […]
Polimerosomas de gradiente de pH transmembrana y su uso en la eliminación del amoníaco y sus análogos metilados, del 27 de Mayo de 2020, de ETH ZURICH: Un polimerosoma que comprende (a) una membrana, que comprende un copolimero en bloque de poli(estireno) (PS) y poli(oxido de etileno) (PEO), en […]
Liposomas para el tratamiento de infecciones virales, del 13 de Mayo de 2020, de Combioxin SA: Una composición que comprende, preferiblemente que consiste en, (i) un único liposoma vacío, en donde dicho liposoma vacío único se selecciona de […]
Agente de direccionamiento para células cancerosas o fibroblastos asociados con cáncer, del 29 de Abril de 2020, de NITTO DENKO CORPORATION: Composición para su uso en el tratamiento de cáncer en el que están implicados fibroblastos asociados con cáncer, caracterizada porque la composición comprende un portador […]