COMPOSICION FARMACEUTICA UTIL PARA LA ADMINISTRACION ORAL DE FARMACOS Y VACUNAS A JABALIES Y SUS APLICACIONES.
Composición farmacéutica útil para la administración oral de fármacos y vacunas a jabalíes y sus aplicaciones.
En la presente invención se describe una composición farmacéutica sólida específica para la administración oral de fármacos y vacunas a jabalíes (Sus scrofa) como mecanismo de prevención y control de enfermedades de la fauna silvestre y de los animales relacionados con éstos
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200800798.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC) 50%
UNIVERSIDAD DE CASTILLA LA MANCHA 50%.
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: GORTAZAR SCHMIDT,CHRISTIAN, DE LA FUENTE GARCIA,JOSE , BALLESTEROS HURTADO,CRISTINA , CANALES GARCIA-MENOCAL,MARIO , VICENTE BAOS,JOAQUIN.
Fecha de Solicitud: 18 de Marzo de 2008.
Fecha de Publicación: .
Fecha de Concesión: 5 de Agosto de 2010.
Clasificación Internacional de Patentes:
- A23K1/18M1
- A61K9/00M18B
Clasificación PCT:
- A23K1/18
- A61K9/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales caracterizadas por un aspecto particular.
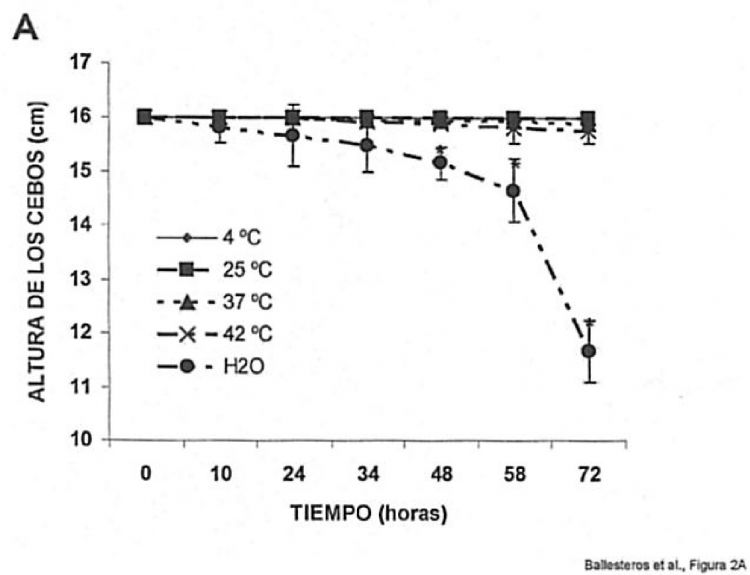
Fragmento de la descripción:
Composición farmacéutica útil para la administración oral de fármacos y vacunas a jabalíes y sus aplicaciones.
Sector de la técnica
La presente invención se refiere a una composición farmacéutica terapéutica en forma de cebo, útil para la administración oral de fármacos, vacunas y sustancias beneficiosas para la salud, a animales silvestres por ejemplo jabalíes (Sus scrofa), y por tanto, es un mecanismo de prevención y control de enfermedades en las que estos animales están afectados, así como para la demás fauna silvestre, no silvestre, animales domésticos y seres humanos relacionados con ellos, por lo que sus principales aplicaciones están en los sectores cinegético, agropecuario y veterinario.
Estado de la técnica
Se ha demostrado que la fauna silvestre y en particular los mamíferos terrestres son importantes hospedadores de patógenos que afectan a los seres humanos y a los animales domésticos (Ballesteros et al., 2007). En concreto, el jabalí europeo (Sus scrofa) es un reservorio importante de patógenos tales como aquellos pertenecientes al complejo Mycobacterium tuberculosis que afectan tanto a las personas como a los animales domésticos. El virus de la peste porcina clásica y el herpesvirus porcino (pseudorabia) se mantienen en la naturaleza debido a la transmisión entre jabalíes y cerdos. La erradicación de estas enfermedades requiere el desarrollo de estrategias de control que reduzcan la transmisión patogénica entre los animales.
El control y la erradicación de estas enfermedades en el jabalí requieren del tratamiento de crías de jabalí entre 2 y 4 meses de edad.
El control de enfermedades mediante vacunación de la fauna silvestre tiene numerosas ventajas sobre otras técnicas como, por ejemplo, el control poblacional y está más aceptado socialmente (Kaden et al., 2005; Cross et al., 2006).
El concepto de inmunización de fauna silvestre con vacunas orales fue propuesto por primera vez por los Centros para el Control y Prevención de Enfermedades (CDC, Atlanta, GA, USA) y ensayado con zorros en cautividad para controlar la rabia en la década de los 60 (Rupprecht et al., 2004). Cada vez son más innovadoras las técnicas y sistemas de administración utilizados en las vacunas orales contra la rabia en Europa, Canadá y Estados Unidos diseñados para el control de la enfermedad en la fauna silvestre (Rupprecht et al., 2004; Cross et al., 2006). Sin embargo, la vacunación efectiva de algunas especies de la fauna silvestre como el jabalí requiere el desarrollo de cebos específicos y efectivos para la administración oral de vacunas, estables y, preferiblemente, para la especie a tratar. Se ha comprobado (Brauer et al., 2006) que esta tarea es particularmente difícil cuando se trata de jabalíes jóvenes debido a que la inmunización oral de rayones a los 2-4 meses de vida es difícil debido a problemas fisiológicos asociados con el vacío inmunológico y el limitado consumo de alimento sólido de los animales a estas edades.
Existen sistemas de cebos orales para la vacunación de animales contra la rabia ya patentados. En la patente americana 4,014,991 (Baer et al., 1977) se describe un cebo compuesto por una salchicha con un tubo alargado de polietileno en su interior donde se introduce la vacuna. La especie a la que va dirigido este tipo de cebo son los zorros. Otro tipo de cebo destinado a vacunar zorros contra la rabia es el descrito por Johnston et al. (1987) en el que el cebo se compone de una esponja recubierta de un material compuesto por grasa de ternera y cera. Maki et al. (2005) describe un cebo fabricado con comida de pescado en cuyo interior se introduce un sobre de plástico donde va la vacuna. Este cebo está destinado a vacunar mofetas y mangostas frente a la rabia. Otro tipo de cebo es el descrito en la patente alemana 3611122 (Apr 3, 1986) y americana 4,861,586 de los inventores Lother and Irma Schneider titulada "Animal Bait" donde describen un cebo consistente en una matriz de grasa de pescado y una sustancia farmacéuticamente activa para vacunar conejos. Además de cebos con vacunas contra la rabia en su interior, también se han descrito patentes de cebos para vacunar zarigüeyas frente la tuberculosis bovina US2004234533 (Aldwell et al., 2004) y mamíferos frente a la enfermedad de Lyme US20067094391 (Barbour et al., 2006).
La vacunación efectiva de algunas especies de la fauna silvestre como el jabalí requiere el desarrollo de un sistema de cebos efectivo para la administración oral de vacunas, estables y, preferiblemente, específicos para la especie a tratar (Brauer et al., 2006; Ballesteros et al., 2007).
Actualmente, se ha desarrollado un tipo de cebo oral destinado a administrar tóxicos, anticonceptivos o vacunas a los cerdos no domésticos en Australia. El cebo diseñado se llama PIGOUT® y forma parte de un proyecto entre las Tecnologías de Control Animal de Australia (ACTA) y el Centro de Investigación de Control de Plagas de especies invasoras (PAC CRC). Dicho cebo ha demostrado ser específico para la especie a tratar. Se ha probado con éxito en Australia, América y Nueva Zelanda (Campbell et al., 2007). Sin embargo, este cebo no está destinado a vacunar crías de jabalí de 2-4 meses de edad (también denominados rayones).
El control y la erradicación de enfermedades como la tuberculosis bovina y el virus de la peste porcina clásica requerirá de la inmunización de crías de jabalí en algunas regiones (Kaden et al., 2000; 2005; Kaden and Lange, 2001; Ballesteros et al., 2007; Martín-Hernando et al., 2007; Naranjo et al., 2007). La inmunización oral de crías de jabalí (rayones) a los 2-4 meses de vida es difícil debido a problemas fisiológicos asociados con el vacío inmunológico (Kaden et al., 2002; 2003; 2005) y el limitado consumo de alimentos sólidos de los animales a estas edades (Brauer et al., 2006). Este problema se asociaba con la imposibilidad de suministrar alimento sólido a los jabalís jóvenes de esta edad ya que son amamantados por sus madres durante sus tres primeros meses de vida, tiempo en el que entran en contacto con alimento sólido (Brauer et al., 2006).
Bibliografía
- Aldwell, F. E., Buddle, B. M., Tucker, I. G.: US2004234533 (2004).
- Baer, G. M., Winkler, W. G.: US4014991 (1977).
- Ballesteros, C., Pérez de la Lastra, J. M., de la Fuente, J., 2007. Recent developments in oral bait vaccines for wildlife. Recent Patents Drug Deliv. Formul. 1, 230-235.
- Barbour, A. G., Luke, C. J.: US20067094391 (2006).
- Brauer, A., Lange, E., Kaden, V., 2006. Oral immunisation of wild boar against classical swine fever: uptake studies of new baits and investigations on the stability of lyophilised C - strain vaccine. Eur. J. Wildl. Res. 52, 271-276.
- Campbell, T. A., Long, D. B., 2007. Species-specific visitation and removal of baits for delivery of pharmaceuticals to feral swine. Journal of Wildlife Diseases. 43 (3), 485-491.
- Cross, M. L., Buddle, B. M., Aldwell, F. E., 2006. The potential of oral vaccines for disease control in wildlife species. Vet. J., in press (doi:10.1016/j.tvjl. 2006.10.005).
- Johnston, D., Lawson, K. F.: US4650673 (1987).
- Kaden, V., Lange, E., Fischer, U., Strebelow, G., 2000. Oral immunisation of wild boar against classical swine fever: evaluation of the first field study in Germany. Vet. Microbiol. 73, 239-252.
- Kaden, V., Lange, B., 2001. Oral immunisation against classical swine fever (CSF): onset and duration of immunity. Vet. Microbiol. 82, 301-310.
- Kaden, V., Heyne, H., Kiupel, H., Letz, W., Kern, B., Lemmer, U., Gossger, K., Rothe, A., Böhme, H., Tyrpe, P., 2002. Oral immunisation of wild boar against classical swine fever: concluding analysis of the recent field trials in Germany. Berl. Münch. Tierärztl. Wochenschr. 115, 179-185.
- Kaden, V., Renner, Ch., Rothe, A., Lange, E., Hänel, A., Gosser, K., 2003. Evaluation of the oral immunisation of wild boar against classical swine...
Reivindicaciones:
1. Composición farmacéutica terapéutica útil para la administración oral de fármacos, vacunas u otros principios activos a animales silvestres, preferentemente jabalíes y cerdos silvestres o, más preferentemente, rayones caracterizada porque comprende, al menos, los siguientes elementos:
a) una matriz alimenticia que comprende distintos elementos nutritivos, azúcar entre un 8 y un 45%, parafina entre un 8 y un 45%, y entre un 0.5 y un 10% de un aromatizante constituido por esencia de trufa y canela y,
b) una cápsula de polímero biocompatible que incluye el compuesto farmacéutico terapéutico activo.
2. Composición farmacéutica según la reivindicación 1 caracterizada porque el aromatizante está constituido por, al menos, un 1% de esencia de trufa y canela.
3. Composición farmacéutica según la reivindicación 1 caracterizada porque el aromatizante está constituido por, al menos, un 2% de esencia de trufa y canela.
4. Composición farmacéutica según la reivindicación 1 caracterizada porque la matriz alimenticia comprende elementos nutritivos preferentemente, entre un 7.4 y un 22.2% de cebada, entre un 6.4 y un 19.2% de trigo, entre un 2.1 y un 6.3% de harina de soja, entre un 1.2 y un 3.6% de guisantes, entre un 1 y un 3% de salvado de trigo, entre un 0.8 y un 2.4% de gluten de maíz, entre un 0.5 y un 1.4% de ácidos grasos, entre un 0.2 y un 0.7% de fosfato dicálcico, entre un 0.2 y un 0.7% de carbonato de calcio, entre un 0.1 y un 0.3% de minerales, vitaminas y aditivos (6,000-12,000 u vitamina A, 800-4,000 u vitamina D3, 7.5-25 mg cobre, 0.3-1% lisina), entre un 0.1 y 0.2% de cloruro de sodio, entre un 10 y un 30% de harina de trigo.
5. Composición farmacéutica según la reivindicación 1 caracterizada porque el polímero biocompatible se selecciona del siguiente grupo: polipropileno y polietileno, preferentemente, polietileno.
6. Composición farmacéutica según la reivindicación 1 caracterizada porque la parafina escogida para la composición de la matriz tiene un punto de fusión de 51-53ºC.
7. Composición farmacéutica según la reivindicación 1 caracterizada porque comprende un 44% de pienso de jabalí (37% cebada, 32% trigo, 10.5% harina de soja, 6% guisantes, 5% salvado de trigo, 4% gluten de maíz, 2.3% ácidos grasos, 1.2% fosfato dicálcico, 1.1% carbonato de calcio, 0.5% minerales, vitaminas y aditivos (9,000 u vitamina A, 1,800 u vitamina D3, 15 mg cobre, 0.7% lisina), 0.4% cloruro de sodio), 22% harina de trigo, 16.5% parafina (punto de fusión 51-53ºC), 16.5% azúcar, y 1% aromatizante de trufa y canela.
8. Composición farmacéutica según la reivindicación 1 caracterizada porque el principio activo contenido en la misma pertenece a: un fármaco veterinario, una vitamina, un nutriente, una vacuna, uno o varios microorganismos, o combinaciones de los mismos.
9. Uso de aroma de trufa y canela en la elaboración de un medicamento o composición farmacéutica útil para el tratamiento o prevención de enfermedades de animales silvestres, preferentemente, jabalíes y, más preferentemente, rayones.
10. Procedimiento de elaboración de la composición según las reivindicaciones 1 a la 8 caracterizado porque comprende las siguientes etapas:
i.- una vez fundida la parafina se añaden el azúcar y el resto de elementos nutritivos lentamente y con agitación constante,
ii.- una vez que la matriz de i) alcance la temperatura de, aproximadamente, 45ºC, se añade el aromatizante de trufa y canela, y
iii.- se embebe la cápsula de polímero biocompatible con el fármaco o vacuna terapéuticamente activa en la matriz de ii), la cual es introducida en moldes donde se deja enfriar hasta, aproximadamente, los 25ºC.
11. Uso de la composición farmacéutica según las reivindicaciones 1 a la 8 en un procedimiento de aporte nutritivo o en un procedimiento terapéutico o preventivo de animales silvestres, preferentemente, jabalíes, y más preferentemente, rayones.
Patentes similares o relacionadas:
CÁPSULAS BLANDAS MASTICABLES QUE CONTIENEN ALMIDÓN NO GELATINIZADO, del 16 de Enero de 2012, de R.P. SCHERER TECHNOLOGIES, LLC: Una cápsula de gelatina terminada lista para empaque, que incluye una cubierta de cápsula formada de una película de cápsula; en donde la cubierta de cápsula […]
FORMA FARMACÉUTICA HINCHABLE QUE COMPRENDE GOMA GELLAN, del 22 de Diciembre de 2011, de Egalet Ltd: Forma farmacéutica en forma particulada para la administración oral de uno o más principios activos, comprendiendo la forma farmacéutica un vehículo en forma particulada que […]
PASTILLA DE NICOTINA MEJORADA, del 24 de Noviembre de 2011, de MCNEIL AB: SE DESCRIBE UN METODO PARA DEJA DE FUMAR QUE UTILIZA UNA PASTILLA DE NICOTINA MEJORADA PARA SATISFACER EL DESEO PASAJERO.LA PASTILLA CONTIENE,UN ENDULZANTE NO NUTRITIVO […]
FORMAS FARMACÉUTICAS SÓLIDAS DE DESINTEGRACIÓN RÁPIDA QUE NO SON FRIABLES Y QUE COMPRENDEN PULULANO, del 20 de Septiembre de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una forma farmacéutica sólida que comprende: (a) al menos un agente tensioactivo que tiene un tamaño de partículas promedio eficaz, antes de la inclusión en la […]
COMPOSICIONES DE SULFOALQUILÉTER CICLODEXTRINA Y MÉTODOS DE PREPARACIÓN DE LAS MISMAS, del 5 de Septiembre de 2011, de CYDEX PHARMACEUTICALS, INC: Una composición que comprende una composición de sulfoalquiléter ciclodextrina, en donde la composición de sulfoalquiléter ciclodextrina tiene: […]
ELASTÓMEROS DE POLIURETANO, del 12 de Agosto de 2011, de CONTROLLED THERAPEUTICS (SCOTLAND) LTD: Una composición de liberación controlada, que comprende un polímero lineal que puede obtenerse haciendo reaccionar juntos (a) un polietilenglicol o polipropilenglicol; […]
PELÍCULA MONOCAPA DE DESINTEGRACIÓN RÁPIDA PARA LA ADMINISTRACIÓN BUCAL DE SUSTANCIAS ACTIVAS, del 2 de Agosto de 2011, de PIERRE FABRE MEDICAMENT: Película monocapa de desintegración rápida para la administración bucal de sustancias activas, que comprende un soporte hidrosoluble que contiene por lo menos una […]
COMPOSICIONES ACUOSAS ESTABLES AL ALMACENAMIENTO, QUE COMPRENDEN UN COMPUESTO DE MAGNESIO Y L-CARNITINA, del 15 de Junio de 2011, de VERLA-PHARM ARZNEIMITTELFABRIK APOTHEKER H.J. VON EHRLICH GMBH & CO. KG: Composición acuosa o, respectivamente, gelatinosa, que comprende el compuesto complejo de magnesio hidrocloruro de L-aspartato de magnesio con un […]