Composición farmacéutica sólida de cilostazol.
Composición farmacéutica sólida de cilostazol. - La presente invención se refiere a una composición farmacéutica sólida de cilostazol que comprende cilostazol como principio activo,
un agente aglutinante que contiene una mezcla de un alcohol de azúcar y talco, y, opcionalmente, un agente disgregante. Dicha combinación de excipientes confiere una solubilidad apropiada al principio activo. También se refiere al uso de dicha composición para la preparación de formas farmacéuticas de cilostazol para su administración por vía oral. La invención se refiere también a comprimidos preparados con la composición de la invención, que presentan unas propiedades apropiadas en cuanto a la solubilidad y a la biodisponibilidad del cilostazol.
También se refiere a procedimientos para preparar la composición y comprimidos de cilostazol, así como a su uso como medicamentos.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201230213.
Solicitante: LABORATORIOS NORMON, S. A.
Nacionalidad solicitante: España.
Inventor/es: FERNANDEZ AIJON,ANTONIO, GOVANTES ESTESO,CARLOS, GRANDIO TIERNO,JESUS, BUENO SÁNCHEZ,María de los Angeles.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4709 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Quinoleínas no condensadas conteniendo otros heterociclos.
- A61K47/04 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › No-metales; Sus compuestos.
- A61K47/26 A61K 47/00 […] › Hidratos de carbono, p. ej. alcoholes de azúcares, amino azúcares, ácidos nucleicos, mono-, di- u oligo-sacáridos; Sus derivados, p. ej. polisorbatos, ésteres de ácidos grasos sorbitano o glicirricina.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
- A61P7/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Agentes antitrombóticos; Anticoagulantes; Inhibidores de la agregación plaquetaria.
Fragmento de la descripción:
Composición farmacéutica sólida de cilostazol
Campo de la técnica La presente invención se refiere a composiciones farmacéuticas sólidas de cilostazol que presentan una solubilidad apropiada del principio activo, y que se pueden emplear para preparar formas farmacéuticas de cilostazol para su administración por vía oral.
Estado de la técnica anterior
El cilostazol es la D.C.I. del compuesto químico 6-[4- (1-ciclohexil-1H-tetrazol-5-il) butoxi-3, 4-dihidro-2 (1H) quinolinona, que responde a la siguiente fórmula:
H
N
El cilostazol fue descrito por primera vez en 1979 por la compañía Otsuka en la patente belga BE878548.
El cilostazol es un inhibidor de la enzima fosfodiesterasa III (PDE III) y se emplea en medicina como antitrombótico para mejorar la distancia máxima y exenta de dolor que pueden caminar pacientes que padecen de claudicación intermitente, que no padecen de dolor en estado de reposo y que no presentan indicios de necrosis tisular
periférica (estadio II de la clasificación de Fontaine de enfermedad arterial periférica) .
El cilostazol es un principio activo prácticamente insoluble en agua, y se considera que su biodisponibilidad a partir de composiciones farmacéuticas está limitada por la velocidad de disolución.
En la solicitud de patente norteamericana US-A-2005/0255155 se describe que en el Biopharmaceutics Classification System el cilostazol está clasificado como fármaco de Clase II, caracterizado por una baja solubilidad y
una elevada permeabilidad. También se describe que la absorción oral del cilostazol es rápida y completa, y que los perfiles cinéticos de cilostazol muestran que, cuando la disolución in vivo es completa, no hay limitación a la absorción.
Por ello en el estado de la técnica se encuentran diferentes aproximaciones dirigidas a solucionar el problema de la solubilidad del cilostazol, mejorando la velocidad de disolución y, en consecuencia, su biodisponibilidad.
En la ficha técnica del medicamento Pletal® se describe un comprimido que comprende 100 mg de cilostazol como principio activo y como excipientes: almidón de maíz, celulosa microcristalina, carmelosa cálcica, hipromelosa y estearato magnésico.
En la solicitud de patente internacional WO-A-00/57881 se describen composiciones que comprenden cilostazol como principio activo y que presentan una dispersabilidad y/o solubilidad mejorada del principio activo. En dichas composiciones el cilostazol, con un tamaño de partícula de 10 µm o menos, se incorpora a un agente solubilizante y/o dispersante seleccionado de entre el grupo formado por un polímero hidrosoluble, un tensioactivo, o mezcla de los mismos. De acuerdo con la descripción y los ejemplos que figuran en la misma el agente solubilizante preferido es el laurilsulfato sódico, solo o en combinación con polímeros hidrosolubles como, por ejemplo, la hidroxipropilcelulosa, o la hidroxipropilmetilcelulosa.
En el marco del desarrollo de nuevas formas polimórficas de cilostazol, en la Formulación 3 de la solicitud de patente WO-A-03/002121 se describen comprimidos de cilostazol que comprenden como excipientes: almidón, celulosa microcristalina, polivinilpirrolidona, carboximetilalmidón sódico, estearato magnésico y talco. Según el procedimiento descrito, los tres últimos componentes se añaden a la fase extragranular antes de efectuar la compresión.
En la solicitud de patente internacional WO-A-2005/023225 se describe una solución técnica para mejorar la velocidad de disolución del cilostazol mediante la formación de un adsorbato del mismo sobre un soporte inerte como, por ejemplo, manitol, polivinilpirrolidona o polietilenglicol. El procedimiento para la preparación del adsorbato comprende disolver el principio activo en cloruro de metileno, añadir el soporte inerte para formar una suspensión y evaporar el disolvente.
La solicitud de patente internacional WO-A-2006/030301 está dirigida al desarrollo de composiciones de cilostazol bioequivalentes a las composiciones comerciales del mismo. En dicho documento se describe una composición farmacéutica en forma de comprimidos que comprende cilostazol, con un tamaño medio de partícula específico de modo que el 90% de las partículas presentan un tamaño inferior a 50 µm, y como excipientes: almidón, hidroxipropilmetilcelulosa, carboximetilcelulosa cálcica, celulosa microcristalina, y estearato magnésico.
En la solicitud de patente internacional WO-A-2008/030209 se describen composiciones nanoparticuladas de cilostazol que incluyen un agente estabilizante de superficie, de modo que se mejora la baja biodisponibilidad del principio activo y se evita tener que tomarlo durante las comidas. También se describe que los agentes estabilizantes de superficie pueden ser polímeros, oligómeros de bajo peso molecular, productos naturales y tensioactivos, y se cita a un número considerable de ejemplos. También se describen composiciones de cilostazol en forma de comprimidos que comprenden como excipientes: hipromelosa, docusato sódico, sacarosa, lauril sulfato sódico, lactosa monohidrato, celulosa microcristalina silicificada, crospovidona y estearato magnésico.
Existe pues la necesidad de disponer de composiciones sólidas de cilostazol alternativas que sean bioequivalentes a las composiciones comerciales existentes, fáciles de preparar, y que, al mismo tiempo, presenten un perfil de disolución reproducible.
Objeto de la invención El objeto de la invención es una composición farmacéutica sólida que comprende cilostazol como principio activo.
También es objeto de la invención un comprimido que comprende dicha composición.
Forma parte también del objeto de la invención la utilización de dicha composición para la preparación de formas sólidas de cilostazol para su administración por vía oral.
También forma parte del objeto de la invención un procedimiento para la preparación de dicha composición y dicho comprimido.
Forma parte también del objeto de la invención la utilización de dicha composición para la preparación de un medicamento para mejorar la distancia máxima y exenta de dolor que pueden caminar pacientes que padecen de claudicación intermitente, que no padecen de dolor en estado de reposo y que no presentan indicios de necrosis tisular periférica (estadio II de la clasificación de Fontaine de enfermedad arterial periférica) .
También forma parte del objeto de la invención la utilización de dicho comprimido para la preparación de un medicamento para mejorar la distancia máxima y exenta de dolor que pueden caminar pacientes que padecen de claudicación intermitente, que no padecen de dolor en estado de reposo y que no presentan indicios de necrosis tisular periférica (estadio II de la clasificación de Fontaine de enfermedad arterial periférica) .
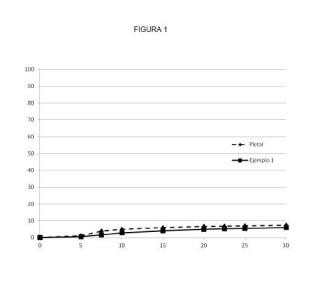
Figuras En la Figura 1 se representa el perfil de disolución de los comprimidos obtenidos en el Ejemplo 1 y del medicamento comercial Pletal® empleando como medio de disolución ácido clorhídrico 0, 1 N. En ordenadas se representa el porcentaje de principio activo disuelto y en abscisas se representa el tiempo en minutos.
En la Figura 2 se representa el perfil de disolución de los comprimidos obtenidos en el Ejemplo 1 y del medicamento comercial Pletal® empleando como medio de disolución tampón de acetato sódico 0, 05 M (pH=4, 5) . En ordenadas se representa el porcentaje de principio activo disuelto y en abscisas se representa el tiempo en minutos.
En la Figura 3 se representa el perfil de disolución de los comprimidos obtenidos en el Ejemplo 1 y del medicamento comercial Pletal® empleando como medio de disolución tampón de fosfato potásico 0, 05 M (pH=6, 8) . En ordenadas se representa el porcentaje de principio activo disuelto y en abscisas se representa el tiempo en minutos.
En la Figura 4 se representa el perfil de disolución de los comprimidos obtenidos en el Ejemplo 1 y del medicamento comercial Pletal® empleando como medio de disolución tampón de fosfato potásico 0, 05 M (pH=6, 8) que contiene laurilsulfato sódico al 0, 5%. En ordenadas se representa el porcentaje de principio activo disuelto y en abscisas se representa el tiempo en minutos.
En la Figura 5 se representa el perfil de disolución de los comprimidos obtenidos en el Ejemplo 1 y del medicamento comercial Pletal® empleando como medio de disolución agua con laurilsulfato sódico al 0, 3 %. En ordenadas se representa el porcentaje de principio activo disuelto y en abscisas se representa el tiempo en minutos. En estas condiciones se consigue un grado de liberación del principio activo próximo al 80%, que permite efectuar una buena comparación...
Reivindicaciones:
1. Composición farmacéutica sólida caracterizada porque comprende:
a) una cantidad farmacéuticamente efectiva de cilostazol o una sal farmacéuticamente aceptable, solvato o hidrato del mismo, b) un agente aglutinante que consiste esencialmente de una mezcla de un alcohol de azúcar y talco, y
c) opcionalmente un agente disgregante.
2. Composición según la reivindicación 1, caracterizada porque el cilostazol se emplea en forma micronizada de manera que al menos el 50% de las partículas presentan un tamaño medio de partícula no superior a 10 micras.
3. Composición según la reivindicación 1 ó 2, caracterizada porque el cilostazol representa entre el 35% y el
90% en peso sobre el peso total de la composición. 4. Composición según cualquiera de las reivindicaciones 1 a 3, caracterizada porque el alcohol de azúcar se selecciona de entre el grupo formado por sorbitol, manitol, xilitol, isomalt, maltitol y lactitol.
5. Composición según la reivindicación 4, caracterizada porque el alcohol azúcar se selecciona entre sorbitol, isomalt, manitol, o maltitol.
6. Composición según la reivindicación 5, caracterizada porque el alcohol azúcar es sorbitol. 7. Composición según cualquiera de las reivindicaciones 1 a 6, caracterizada porque el alcohol de azúcar representa entre el 10% y el 45% en peso sobre el peso total de la composición.
8. Composición según cualquiera de las reivindicaciones 1 a 7, caracterizada porque el talco representa entre el
0, 1% y el 5% en peso sobre el peso total de la composición. 9. Composición según cualquiera de las reivindicaciones 1 a 8, caracterizada porque comprende un agente disgregante.
10. Composición según la reivindicación 9, caracterizada porque el agente disgregante se selecciona de entre el grupo formado por almidón de maíz, almidón de patata, almidón glicolato sódico, almidón pregelatinizado, celulosa microcristalina, carboximetilcelulosa cálcica, crospovidona, dióxido de silicio coloidal, fosfato cálcico dibásico, fosfato cálcico tribásico, y mezclas de los mismos.
11. Composición según la reivindicación 10, caracterizada porque el agente disgregante se selecciona de entre carboximetilcelulosa cálcica, celulosa microcristalina, crospovidona, dióxido de silicio coloidal, y mezclas de los mismos.
12. Composición según la reivindicación 11, caracterizada porque el agente disgregante se selecciona de entre
carboximetilcelulosa cálcica, crospovidona, y mezclas de los mismos. 13. Composición según cualquiera de las reivindicaciones 9 a 12, caracterizada porque el agente disgregante representa entre el 2% y el 20% en peso sobre el peso total de la composición.
14. Procedimiento para preparar la composición según cualquiera de las reivindicaciones 1 a 13, caracterizado porque comprende: a) disolver el alcohol de azúcar en agua, un disolvente orgánico, o mezclas de los mismos, b) dispersar el talco en la solución obtenida en la etapa a) , c) amasar el cilostazol y, opcionalmente, el agente disgregante con la dispersión obtenida en la etapa b) , y d) granular y secar hasta obtener una humedad inferior al 10%..
15. Comprimido de cilostazol caracterizado porque comprende: a) una cantidad de la composición según cualquiera de las reivindicaciones 1 a 13 que sea suficiente como para proporcionar una dosis unitaria efectiva de cilostazol, y
b) al menos un agente auxiliar.
16. Comprimido según la reivindicación 15, caracterizado porque consiste en entre un 35% y un 90% en peso de la composición según cualquiera de las reivindicaciones 1 a 12, y entre un 10% y un 65% en peso de al menos un agente auxiliar.
17. Comprimido según la reivindicación 15 ó 16, caracterizado porque contiene una dosis unitaria de cilostazol
comprendida entre los 50 mg y los 150 mg. 18. Comprimido según la reivindicación 17, caracterizado porque contiene una dosis unitaria de cilostazol de 100 mg.
19. Comprimido según cualquiera de las reivindicaciones 15 a 18, caracterizado porque el agente auxiliar se selecciona de entre el grupo formado por diluyentes, disgregantes, lubrificantes, antiadherentes, edulcorantes, saborizantes, aromatizantes, y/o mezclas de los mismos.
20. Comprimido según cualquiera de las reivindicaciones 15 a 19, caracterizado porque comprende entre un 20% y un 80% en peso de cilostazol; entre un 10% y un 30% en peso de alcohol de azúcar; entre el 10% y el 30% en peso de un diluyente; entre un 2% y un 25% en peso de un agente disgregante; entre 0, 1% y 5% en peso de talco; y entre 0, 5% y 6% de lubrificante extragranular, de modo que la suma de los porcentajes en peso de los componentes sobre el total de la composición es igual al 100%.
21. Comprimido según la reivindicación 20, caracterizado porque el alcohol de azúcar es seleccionado entre sorbitol, maltitol, manitol e isomalt; el diluyente es celulosa microcristalina; el agente disgregante se selecciona de carboximetilcelulosa cálcica, crospovidona y sus mezclas; y el lubrificante extragranular se selecciona de entre el grupo formado por estearato magnésico, ácido esteárico, sílice coloidal y sus mezclas.
22. Comprimido según la reivindicación 13, caracterizado porque comprende:
a) entre 50 mg y 150 mg de cilostazol,
b) entre 20 mg y 60 mg de un alcohol de azúcar seleccionado entre sorbitol, isomalt, manitol, o malti
tol,
c) entre 20 mg y 60 mg de celulosa microcristalina,
d) entre 9 mg y 27 mg de carboximetilcelulosa cálcica,
e) entre 8 mg y 24 mg de crospovidona,
f) entre 1 mg y 4 mg de talco,
g) entre 2 mg y 8 mg de estearato magnésico,
h) entre 0, 8 mg y 2, 4 mg de sílice coloidal, y
i) entre 1, 2 mg y 3, 6 mg de ácido esteárico.
23. Comprimido según la reivindicación 22, caracterizado porque el alcohol de azúcar es sorbitol.
24. Comprimido según la reivindicación 22, caracterizado porque comprende:
a) 100 mg de cilostazol
b) 40 mg de sorbitol
c) 45 mg de celulosa microcristalina d) 18 mg de carboximetilcelulosa cálcica e) 16 mg de crospovidona f) 2 mg de talco,
g) 4 mg de estearato magnésico,
h) 1, 6 mg de sílice coloidal, y
i) 2, 4 mg de ácido esteárico.
25. Procedimiento para preparar un comprimido según cualquiera de las reivindicaciones 15 a 24 que comprende:
a) disolver el alcohol de azúcar en agua, un disolvente orgánico, o mezclas de los mismos,
b) dispersar el talco en la solución obtenida en la etapa a) , c) amasar el cilostazol y, opcionalmente, el agente disgregante con la dispersión obtenida en la etapa b) ,
d) granular y secar hasta obtener una humedad inferior al 10%,
e) añadir al menos un agente auxiliar, mezclar y comprimir.
26. Utilización de una composición de cualquiera de las reivindicaciones 1 a 13 para preparar formas farmacéu5 ticas sólidas de cilostazol para su administración por vía oral.
27. Utilización según la reivindicación 26, caracterizada porque la forma farmacéutica sólida de cilostazol es un comprimido.
28. Utilización de la composición según cualquiera de las reivindicaciones 1 a 13 para la preparación de un medicamento para mejorar la distancia máxima y exenta de dolor que pueden caminar pacientes que padecen de 10 claudicación intermitente, que no padecen de dolor en estado de reposo y que no presentan indicios de necrosis tisular periférica (estadio II de la clasificación de Fontaine de enfermedad arterial periférica) .
29. Utilización del comprimido según cualquiera de las reivindicaciones 15 a 24 para la preparación de un medicamento para mejorar la distancia máxima y exenta de dolor que pueden caminar pacientes que padecen de claudicación intermitente, que no padecen de dolor en estado de reposo y que no presentan indicios de necrosis tisular periférica (estadio II de la clasificación de Fontaine de enfermedad arterial periférica) .
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Formulación de vitamina D de liberación modificada estabilizada y método de administración de la misma, del 22 de Julio de 2020, de EirGen Pharma Ltd: Una formulacion oral de liberacion controlada de un compuesto de vitamina D que comprende uno o ambos de 25- hidroxivitamina D2 y 25-hidroxivitamina D3, la formulacion […]
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Composiciones y métodos para tratar el virus de la hepatitis C, del 15 de Julio de 2020, de Gilead Pharmasset LLC: Una composición farmacéutica que comprende: a) de aproximadamente el 25% a aproximadamente el 35% p/p de GS-7977 cristalino que tiene la estructura **(Ver […]
Macrogols para aplicación a la mucosa, y sus usos terapéuticos, del 15 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Composición farmacéutica en forma sólida que comprende, por unidad de dosificación, entre 5 y 400 mg de un PEG con un grado de 3000 o más, para uso en el tratamiento […]
Composición farmacéutica novedosa, del 1 de Julio de 2020, de NOVARTIS AG: Un comprimido farmaceutico que comprende: a) un farmaco que es el solvato con sulfoxido de dimetilo de N-{3-[3-ciclopropil-5-(2-fluoro-4-5 yodofenilamino)-6,8- dimetil-2,4,7-trioxo-3,4,6,7-tetrahidro-2H-pirido[4,3-d]pirimidin-1-il]fenil}acetamida […]
Preparación para el control del peso corporal a base de quitosano y celulosa, del 1 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Una composición oral sólida que contiene una combinación de quitosano de hongos o levaduras, celulosa amorfa en polvo y opcionalmente excipientes.