Composición farmacéutica de un potente inhibidor de HCV para su administración oral.
Una composición farmacéutica líquida que comprende:
(a) menos de o igual a 4,
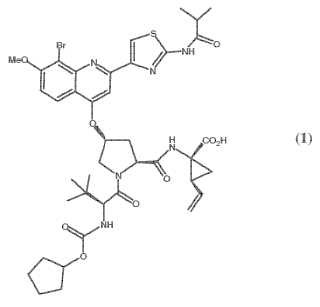
6% en peso de Compuesto (1), o una sal farmacéuticamente aceptable del mismo:**Fórmula**
(b) al menos un 10% a 30% en peso de tensioactivo; y
(c) al menos un 60% a 90% en peso de un disolvente farmacéuticamente aceptable;
en donde la relación en peso de tensioactivo a Compuesto (1) o sal farmacéuticamente aceptable del mismo esmayor que o igual a 2,7;
y en donde la composición está sustancialmente libre de lípidos,
y en donde la composición forma una dispersión clara que tiene un tamaño medio de partículas menor que 1 μm trasla dilución en fluido gástrico simulado.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2009/064908.
Solicitante: BOEHRINGER INGELHEIM INTERNATIONAL GMBH.
Nacionalidad solicitante: Alemania.
Dirección: BINGER STRASSE 173 55216 INGELHEIM ALEMANIA.
Inventor/es: CHEN,Feng-Jing, GEL,JUAN FRANCISCO, VILLAGRA,MARIA FERNANDA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piridinas no condensadas; Sus derivados hidrogenados.
- A61K47/10 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K47/14 A61K 47/00 […] › Esteres de ácidos carboxílicos, p. ej. monoglicéridos de ácidos grasos, triglicéridos de cadenas medianas, parabenos o ésteres de ácidos grasos y de polietilenglicol (PEG).
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
- A61K9/10 A61K 9/00 […] › Dispersiones; Emulsiones.
PDF original: ES-2445516_T3.pdf
Fragmento de la descripción:
Composición farmacéutica de un potente inhibidor de HCV para su administración oral 5 ANTECEDENTES DE LA INVENCIÓN
1. CAMPO TÉCNICO
La invención se refiere a una composición farmacéutica de un potente inhibidor viral de la hepatitis C (HCV) para su 10 administración oral.
2. INFORMACIÓN ANTECEDENTE El compuesto (1) siguiente:
S
O
Br
NH
MeO
N
N
O
H CO2H
N
N
O
O
NH
O
O
(1)
se conoce como un potente y selectivo inhibidor de la serina proteasa NS3 de HCV. El Compuesto (1) es un compuesto zwitteriónico y está dentro del alcance de las series de péptidos acíclicos de inhibidores de HCV 20 descritos en las patentes de EE.UU. 6.323.180, 7.514.557 y 7.585.845. El Compuesto (1) se describe específicamente como el Compuesto Nº 1055 en la patente de EE.UU. 7.585.845, y como el Compuesto Nº 1008 en la patente de EE.UU. 7.514.557. El Compuesto (1) puede prepararse de acuerdo con los procedimientos generales encontrados en las anteriormente citadas referencias, que se incorporan en este documento como referencia. Formas preferidas del Compuesto (1) incluyen las formas cristalinas, en particular la forma de la sal sódica cristalina,
que se puede preparar tal como se describe en la sección de ejemplos del presente documento.
El Compuesto (1) puede ser conocido también por la siguiente descripción alternativa de su estructura química, que es equivalente a la estructura antes descrita:
R2
O
N
H en donde B es ; L0 es MeO-; L1 es Br; y R2 es .
La patente de EE.UU. 6.531.139 y la correspondiente solicitud internacional publicada WO9906024 describe una composición farmacéutica que comprende un agente lipofílico, farmacéuticamente activo, un lípido que es una mezcla de mono- y di-glicéridos, un disolvente y un tensioactivo. Se mencionan varios disolventes farmacéuticamente aceptables, incluyendo polietilenglicol, aunque se establece que el propilenglicol es el disolvente preferido. Se mencionan varios tensioactivos farmacéuticamente aceptables, siendo preferidos Cremophor RH40® o Cremophor EL®. La Vitamina E TPGS no está incluida en el listado de tensioactivos farmacéuticamente aceptables. Estas referencias citadas indican que la composición descrita en ésta, que es un líquido, puede usarse para rellenar cápsulas para su administración oral, y que también puede estar en la forma de una solución líquida para su aplicación oral, parenteral, rectal o tópica.
Las descripciones de la patente de EE.UU. 6.121.313 y la correspondiente solicitud internacional publicada WO9906043 son esencialmente la misma que la de la patente de EE.UU. 6.531.139 y la correspondiente solicitud internacional publicada WO9906024 descrita anteriormente, pero el agente farmacéuticamente activo está limitado a ciertas piranonas.
La patente de EE.UU. 6.231.887 y la correspondiente solicitud internacional publicada WO9906044 describe una composición farmacéutica que comprende una piranona como agente farmacéuticamente activo, una amina básica, un disolvente y un tensioactivo, y opcionalmente un lípido que es una mezcla de mono- y di-glicéridos. Se mencionan varios disolventes farmacéuticamente aceptables, incluyendo polietilenglicol, aunque se establece que el propilenglicol es el disolvente preferido. Se mencionan varios tensioactivos farmacéuticamente aceptables, siendo preferidos Cremophor RH40® o Cremophor EL®. La Vitamina E TPGS no está incluida en el listado de tensioactivos farmacéuticamente aceptables. Se indica que la composición así descrita, que es un líquido, puede usarse para rellenar cápsulas para su administración oral, y que también puede estar en la forma de una solución líquida para su aplicación oral, parenteral, rectal o tópica.
La patente de EE.UU. 6.555.558 y la correspondiente solicitud internacional publicada WO0236110 describe una composición farmacéutica que comprende un inhibidor de piranona proteasa (incluyendo específicamente, aunque sin limitación, tipranavir) , un tensioactivo, un disolvente de polietilenglicol, un lípido que es una mezcla de mono- y di-glicéridos y, opcionalmente, una amina básica. La composición está sustancialmente libre de etanol y propilenglicol. Se mencionan varios tensioactivos farmacéuticamente aceptables, siendo preferido el Cremophor EL®. La Vitamina E TPGS no está incluida en el listado de tensioactivos farmacéuticamente aceptables. Se indica que la composición así descrita, que es un líquido, es particularmente adecuada para rellenar cápsulas de gelatina blandas pretendidas para su administración oral.
La vitamina E-TPGS (succinato de d-alfa tocoferil-polietilenglicol 1000) es una forma soluble en agua de la vitamina E y se reconoce como excipiente para promover la emulsificación de sustancias lipofílicas, que actúan como tensioactivo no iónico, y en la mejora de la biodisponibilidad de ciertos fármacos.
Por ejemplo, en The Lancet, 1991. 338, 212-214 Sokol R. J. et al muestran que la coadministración de la Vitamina E-TPGS con ciclosporina mejora la biodisponibilidad de la ciclosporina.
La patente de EE.UU. 6193985 y la correspondiente solicitud internacional publicada WO9531217 describe el uso de tocoferoles como disolventes y/o tensioactivos de fármacos que son sustancialmente insolubles en agua, en particular para la preparación de formulaciones tópicas. El uso de la Vitamina E-TPGS se menciona específicamente en las páginas 7-8 y 12 como tensioactivo para uso en formulaciones que contienen altos niveles de alfa-tocoferol como capa lipídica. Los ejemplos de formulaciones para administración tópica descritas que contienen Vitamina E-TPGS, tales como los ejemplos de 1 a 5, comprenden típicamente una capa lipídica (un alfa-tocoferol) , el fármaco y la Vitamina E-TPGS, en cantidades de menos de 25% p/p de la formulación, como tensioactivo.
El documento WO96/36316 muestra que la Vitamina E-TPGS puede usarse para la administración potenciada de compuestos lipofílicos como una formulación preconcentrada auto-emulsionante que comprende a) un fármaco lipofílico (una ciclosporina se ilustra específicamente) , b) la vitamina E-TPGS y c) una fase lipofílica. Los ejemplos típicos de formulaciones descritas, tales como los ejemplos 2 y 4, contienen menos del 14% p/p de Vitamina E-TPGS como tensioactivo, una capa lipídica y el fármaco. No hay referencias con respecto a la formulación de inhibidores de proteasa de HIV.
Finamente, la patente de EE.UU. 6.730.679, la correspondiente solicitud internacional publicada WO9735587 y Yu et al., Pharm Res.; diciembre de 1999; 16 (12) :1812-7 describe composiciones farmacéuticas que contienen amprenavir, un inhibidor de proteasa del HIV, y Vitamina E-TPGS.
Se piensa que todavía no hay ninguna formulación del Compuesto (1) que sea particularmente adecuada para su administración oral en la forma de un líquido no encapsulado. Tal formulación sería particularmente adecuada para pacientes pediátricos y también para adultos que tengan dificultad en tragar sólidos.
Así, el objeto de la presente invención es proporcionar dicha formulación líquida del Compuesto (1) .
BREVE COMPENDIO DE LA INVENCIÓN
La presente invención proporciona una formulación oral farmacéuticamente aceptable del Compuesto (1) , o su sal farmacéuticamente aceptable, en la forma de una solución para su administración oral de acuerdo con las reivindicaciones 1 y 9.
Según las características fisicoquímicas de la sustancia farmacéutica, el alcance para el desarrollo era formular una solución con la capacidad de formar una emulsión, microemulsión o solución micelar bajo el contacto con un medio acuoso. La formulación comprende al menos un disolvente para potenciar la solubilidad del fármaco y al menos un tensioactivo con un equilibrio hidrófilo/lipófilo (HLB) > 10 añadido para mantener la sustancia farmacéutica en un estado disuelto en la dilución en fluidos del GI simulados. La formulación de la invención puede contener además agua como co-disolvente y componentes enmascarantes del sabor, tales como edulcorantes y aromatizantes. Puede añadirse un antioxidante para prevenir la oxidación de la sustancia farmacéutica. Dos ejemplos de composición de esta formulación, en dos diferentes fuerzas, se muestran en la Tabla I.
Tabla I. Formulación de la solución oral NA del Compuesto (1) (F330 y 335)
Ingrediente F330 % p/p F335 % p/p Función
sal de sodio del Compuesto (1) 2, 2 4, 4 Sustancia farmacéutica
Polietilenglicol 400 36, 5 34, 3 Disolvente
Propilenglicol 5, 4 5, 4 Disolvente... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica líquida que comprende:
(a) menos de o igual a 4, 6% en peso de Compuesto (1) , o una sal farmacéuticamente aceptable del mismo:
S
O
Br
NH
MeO
N
N
O
H CO2H
N
N
O
O
NH
O
O
(1)
;
(b) al menos un 10% a 30% en peso de tensioactivo; y
(c) al menos un 60% a 90% en peso de un disolvente farmacéuticamente aceptable; en donde la relación en peso de tensioactivo a Compuesto (1) o sal farmacéuticamente aceptable del mismo es mayor que o igual a 2, 7;
y en donde la composición está sustancialmente libre de lípidos, y en donde la composición forma una dispersión clara que tiene un tamaño medio de partículas menor que 1 !m tras la dilución en fluido gástrico simulado.
2. Una composición farmacéutica de acuerdo con la reivindicación 1, en la que el tensioactivo tiene un 15 equilibrio hidrófilo/lipófilo mayor que 10.
3. Una composición farmacéutica de acuerdo con la reivindicación 1, en la que el tensioactivo es la Vitamina E TPGS, un aceite de ricino polietoxilado, un aceite de ricino hidrogenado de polioxilo, un éster graso de polioxietilensorbitan, un macrogolglicérido de caprilocaproilo o una mezcla de los mismos.
4. Una composición farmacéutica de acuerdo con la reivindicación 1, en la que el disolvente farmacéuticamente aceptable es propilenglicol, polipropilenglicol, polietilenglicol, glicerol, etanol, triacetin, dimetil isosorbida, glicofurol, carbonato de propileno, agua, dimetil-acetamida o sus mezclas.
5. Una composición farmacéutica de acuerdo con la reivindicación 1, en la que el disolvente es una mezcla de agua, teniendo el polietilenglicol un peso molecular promedio mayor que 300 pero menor que 600 y propilenglicol.
6. Una composición farmacéutica de acuerdo con la reivindicación 1, en la que la composición farmacéutica no contiene ningún lípido.
7. Una composición farmacéutica de acuerdo con la reivindicación 1, en la que la composición farmacéutica está sustancialmente libre de propilenglicol.
8. Una composición farmacéutica de acuerdo con la reivindicación 1, en la que la composición farmacéutica 35 está sustancialmente libre de una amina.
9. Una composición farmacéutica líquida que comprende:
(a) menos de o igual a 6, 3% en peso de Compuesto (1) , o una sal farmacéuticamente aceptable del mismo:
S
O
Br
NH
MeO
N
N
O
H CO2H
N
N
O
O
NH
O
O
(1)
;
(b) al menos un 10% a 30% en peso de tensioactivo; y
(c) al menos un 60% a 90% en peso de un disolvente farmacéuticamente aceptable; en donde la relación en peso de tensioactivo a Compuesto (1) o sal farmacéuticamente aceptable del mismo es
mayor que o igual a 4, 3; y en donde la composición está sustancialmente libre de lípidos, y en donde la composición forma una dispersión clara que tiene un tamaño medio de partículas menor que 1 !m tras la dilución en fluido gástrico simulado.
10. Una composición farmacéutica de acuerdo con la reivindicación 9, en la que el tensioactivo tiene un equilibrio hidrófilo/lipófilo mayor que 10.
11. Una composición farmacéutica de acuerdo con la reivindicación 9, en la que el tensioactivo es Vitamina E
TPGS, un aceite de ricino polietoxilado, un aceite de ricino hidrogenado de polioxilo, un éster graso de polioxietilen15 sorbitan, un macrogolglicérido de caprilocaproilo o una mezcla de los mismos.
12. Una composición farmacéutica de acuerdo con la reivindicación 9, en la que el disolvente farmacéuticamente aceptable es propilenglicol, polipropilenglicol, polietilenglicol, glicerol, etanol, triacetin, dimetil isosorbida, glicofurol, carbonato de propileno, agua, dimetil-acetamida o sus mezclas.
13. Una composición farmacéutica de acuerdo con la reivindicación 9, en la que el disolvente es una mezcla de agua, polietilenglicol que tiene un peso molecular promedio mayor de 300 pero menor de 600 y propilenglicol.
14. Una composición farmacéutica de acuerdo con la reivindicación 9, en la que la composición farmacéutica no contiene lípido alguno.
15. Una composición farmacéutica de acuerdo con la reivindicación 9, en la que la composición farmacéutica está sustancialmente exenta de propilenglicol.
16. Una composición farmacéutica de acuerdo con la reivindicación 9, en la que la composición farmacéutica está sustancialmente exenta de una amina.
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Procedimiento de compuestos antifúngicos, del 22 de Julio de 2020, de NQP 1598, Ltd: Procedimiento para preparar un compuesto de fórmula 5 ó 5*, o una mezcla de los mismos: **(Ver fórmula)** comprendiendo el método: (a) hacer reaccionar un compuesto […]
Productos terapéuticos basados en la lantionina sintetasa 2 tipo C, del 15 de Julio de 2020, de LANDOS BIOPHARMA, INC: Un compuesto de la fórmula: **(Ver fórmula)** o una sal o éster farmacéuticamente aceptable de este, en donde: Q es piperazina-1,4-diilo; […]
Derivados de piperidina en calidad de inhibidores de HDAC1/2, del 8 de Julio de 2020, de Regenacy Pharmaceuticals, Inc: Un compuesto de Fórmula IIIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde R1 se selecciona del grupo que consiste […]
Compuestos orgánicos, del 17 de Junio de 2020, de INTRA-CELLULAR THERAPIES, INC: Un compuesto de Fórmula I: **(Ver fórmula)** en forma libre o de sal, donde: R1 y R2 son independientemente H o alquilo C1-4 (por ejemplo, metilo o […]
Compuestos ahorradores de PPAR para el tratamiento de enfermedades metabólicas, del 3 de Junio de 2020, de Metabolic Solutions Development Company LLC (100.0%): Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: cada uno de R1 y R2 se selecciona independientemente entre […]
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Nuevos usos terapéuticos de derivados de la bencilidenguanidina para el tratamiento de proteopatías, del 20 de Mayo de 2020, de InFlectis BioScience: Compuesto de la fórmula (I), o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** o un tautómero de los mismos donde: […]