COMPOSICIÓN FARMACÉUTICA QUE COMPRENDE SNS-595 Y SUS USOS.
A composición farmacéutica que comprende ácido (+)-1,4-dihidro-7-[(3S,
4S)-3-metoxi-4-(metilamino)-1-pirrolidinil]-4oxo-1-(2-tiazolil)-1,8-naftiridina-3-carboxílico y un ácido orgánico en una solución acuosa, en la que el pH de la composición es 2 a 3,5
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/008346.
Solicitante: Dainippon Sumitomo Pharma Co., Ltd.
Sunesis Pharmaceuticals, Inc.
Nacionalidad solicitante: Japón.
Dirección: 6-8, DOSHO-MACHI 2-CHOME CHUO-KU OSAKA-SHI OSAKA 541-8524 JAPON.
Inventor/es: HIGAKI,Masaru, NAKAO Satoshi.
Fecha de Publicación: .
Fecha Solicitud PCT: 14 de Marzo de 2005.
Clasificación Internacional de Patentes:
- A61K31/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piridinas no condensadas; Sus derivados hidrogenados.
- A61K38/18B
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K9/00M5
Clasificación PCT:
- A61K31/44 A61K 31/00 […] › Piridinas no condensadas; Sus derivados hidrogenados.
- A61K38/18 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- A61P35/02 A61P […] › A61P 35/00 Agentes antineoplásicos. › específicos para la leucemia.
Clasificación antigua:
- A61K31/44 A61K 31/00 […] › Piridinas no condensadas; Sus derivados hidrogenados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania.
PDF original: ES-2358267_T3.pdf
Fragmento de la descripción:
SNS-595 es un nuevo agente citotóxico de naftiridina que anteriormente era conocido como AG-7352 (véase, por ejem-plo, Tsuzuki et al., Tetrahedron-Asymmetry 12: 1793-1799 (2001) y la patente de EE.UU. Nº 5.817.669). El nombre químico de SNS-595 es ácido (+)-1,4-dihidro-7-[(3S,4S)-3-metoxi-4-(metilamino)-1-pirrolidinil]-4-oxo-1-(2-tiazolil)-1,8-naftiridina-3-carboxílico y tiene la estructura mostrada a continuación. 5
La presente invención se refiere a composiciones que comprenden SNS-595 y a sus usos para tratar el cáncer.
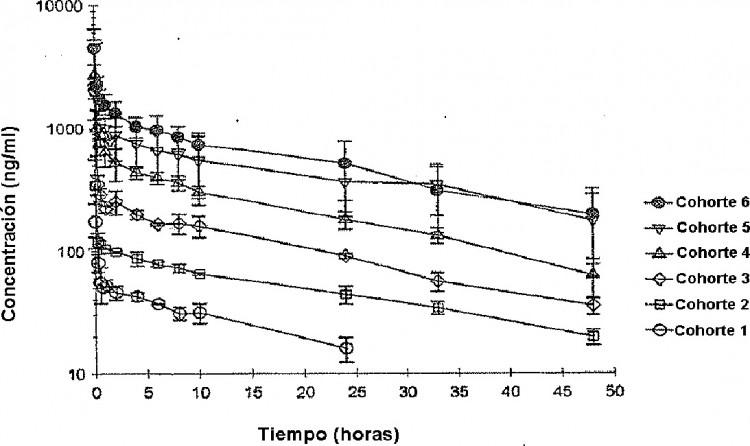
La Figura 1 representa las concentraciones en el plasma de SNS-595 con relación al tiempo entre los diversos cohortes de pacientes.
En un aspecto de la presente invención, se proporciona una composición farmacéutica que comprende: 10
a) SNS-595 y
b) un ácido orgánico
en una solución acuosa en la que el pH de la solución es 2-3,5. Como se utiliza en la presente memoria, un intervalo numérico considera ambos extremos incluidos. Por ejemplo, el intervalo de pH 2-3,5 incluye tanto pH 2 como pH 3,5. En una realización, el pH de la composición es 2-3. En otra realización, el pH de la composición es 2,3-2,7. Como se utiliza 15 en la presente memoria, una solución acuosa es un líquido que comprende agua.
Ejemplos adecuados de ácidos orgánicos incluyen ácido acético, ácido ascórbico, ácido bencenosulfónico, ácido etano-sulfónico, ácido glicólico, ácido hidroxietanosulfónico, ácido láctico, ácido maleico, ácido metanosulfónico, ácido propio-nico, ácido succínico, ácido trifluoroacético y ácido toluenosulfónico. En una realización, el ácido orgánico es ácido me-tanosulfónico o ácido láctico. En otra realización, el ácido orgánico es ácido metanosulfónico. 20
En otra realización, la composición farmacéutica comprende además un agente de tonicidad. Ejemplos adecuados de un agente de tonicidad incluye aminoácidos (por ejemplo, alanina y glicina), electrolitos (por ejemplo, cloruro de sodio y cloruro de potasio), monosacáridos (por ejemplo, glucosa o galactosa), disacáridos (por ejemplo, sacarosa) y alcoholes hexavalentes (por ejemplo, manitol y sorbitol). En otra realización, el agente de tonicidad es cloruro de sodio, glucosa, manitol o sorbitol. En otra realización, el agente de tonicidad es un alcohol hexavalente. En otra realización, el agente de 25 tonicidad es sorbitol.
El SNS-595 es un agente citotóxico para el tratamiento del cáncer. Los tipos de cánceres que pueden ser tratados utili-zando los usos de la invención incluyen, aunque sin estar limitados a ellos: cáncer de vejiga, cáncer de mama, cáncer de cuello uterino, cáncer de colon, (incluyendo cáncer colo-rectal), cáncer de esófago, cáncer de cabeza y cuello, leu-cemia, cáncer de hígado, cáncer de pulmón (tanto de células pequeñas como de células no pequeñas), linfoma, mela-30 noma, mieloma, neuroblastoma, cáncer de ovario, cáncer de páncreas, cáncer de próstata, cáncer de riñón, sarcoma (incluyendo osteosarcoma), cáncer de piel (incluyendo carcinoma escamoso), cáncer de estómago, cáncer de testícu-los, cáncer de tiroides y cáncer de útero.
En otro aspecto de la invención, la composición farmacéutica de la invención sirve para tratar un cáncer humano. SNS-595 puede administrarse a un paciente basándose en su superficie corporal (abreviadamente BSA por la expresión 35 inglesa body surface area), a una dosis de 10 mg/m2-150 mg/m2 de SNS-595. Los cálculos de la superficie corporal pueden realizarse, por ejemplo, con la fórmula de Mosteller, en la que:
BSA (m2) = raíz cuadrada de [altura (en cm) x peso (kg)/3600].
En otra realización, la dosis es 10 mg/m2 – 100 mg/m2. En otra realización, la dosis es 30 mg/m2-75 mg/m2. En otra realización, la dosis es 40 mg/m2-80 mg/m2. En otra realización, la dosis es 50 mg/m2-90 mg/m2. 40
En otra realización, la dosis es 20 mg/m2-30 mg/m2. En otra realización, la dosis es 25 mg/m2-35 mg/m2. En otra realiza-ción, la dosis es 40 mg/m2-50 mg/m2. En otra realización, la dosis es 45 mg/m2-55 mg/m2. En otra realización, la dosis es 50 mg/m2-60 mg/m2. En otra realización, la dosis es 55 mg/m2-65 mg/m2. En otra realización, la dosis es 60 mg/m2-70 mg/m2. En otra realización, la dosis es 65 mg/m2-75 mg/m2. En otra realización, la dosis es 70 mg/m2-80 mg/m2. En otra realización, la dosis es 75 mg/m2- 85 mg/m2. En otra realización, la dosis es 80 mg/m2-90 mg/m2. En otra realización, la 45 dosis es 85 mg/m2-95 mg/m2. En otra realización, la dosis es 90 mg/m2-100 mg/m2.
En otra realización, la dosis es 95 mg/m2-105 mg/m2. En otra realización, la dosis es 100 mg/m2-110 mg/m2. En otra realización, la dosis es 105 mg/m2-115 mg/m2. En otra realización, la dosis es 110 mg/m2-120 mg/m2. En otra realiza-ción, la dosis es 115 mg/m2- 125 mg/m2. En otra realización, la dosis es 120 mg/m2-130 mg/m2. En otra realización, la dosis es 125 mg/m2-135 mg/m2. En otra realización, la dosis es 130 mg/m2-140 mg/m2. En otra realización, la dosis es 135 mg/m2-145 mg/m2. En otra realización, la dosis es 140 mg/m2-150 mg/m2. 5
La dosis administrada de SNS-595 puede ser suministrada simultáneamente (por ejemplo, una sola inyección en bolo) o durante un período de 24 horas (por ejemplo, infusión continua a lo largo del tiempo) y se repite hasta que el paciente experimente enfermedad estable o regresión o hasta que el paciente experimente progreso de la enfermedad o toxici-dad inaceptable. Por ejemplo, la enfermedad estable para tumores sólidos significa generalmente que el diámetro per-pendicular de las lesiones medibles no aumenta el 25% o más desde la última medida. Véase por ejemplo, Response 10 Evaluation Criteria in Solid Tumors (RECIST) Guidelines, Journal of the National Cancer Institute 92(3): 205-216 (2000). La enfermedad estable o su ausencia se determina por métodos conocidos en la técnica, tal como la evaluación de los síntomas del paciente, el examen físico, la visualización del tumor que ha sido sometido a técnicas de imagen usando rayos X, escaneo por CAT, PET o MRI u otras modalidades de evaluación comúnmente aceptadas.
La dosis administrada de SNS-595 puede expresarse en unidades distintas de mg/m2. Por ejemplo, las dosis pueden 15 ser expresadas como mg/kg. Un experto en la técnica sabría fácilmente como convertir dosis expresadas en mg/m2 en dosis expresadas en mg/kg para la altura o el peso, o ambos, de un sujeto (véase, por ejemplo, http://www.fda.gov/cder/cancer/animalframe.htm). Por ejemplo, una dosis de 10 mg/m2-150 mg/m2 para un ser humano de 65 kg es aproximadamente igual a 0,26 mg/kg-3,95 mg/kg.
El SNS-595 se puede administrar siguiendo un calendario de administración, que puede comprender: 20
i) administrar a un paciente una dosis de 10 mg/m2-150 mg/m2 de SNS-595;
ii) esperar un periodo de al menos un día durante el cual no se le administra al paciente SNS-595;
iii) administrar al paciente otra dosis de 10 mg/m2-150 mg/m2 de SNS-595; y,
repetir las etapas ii)-iii) varias veces.
Por ejemplo, si el periodo de espera fuera de 6 días, entonces la dosis inicial de SNS-595 se administra el Día 1 (etapa 25 i); el periodo de espera es de seis días (etapa ii); y la siguiente dosis de SNS-595 se administra el Día 8 (etapa iii). Otros periodos de tiempo ilustrativos incluyen 2 días, 3 días, 13 días, 20 días y 27 días. En otra realización, el periodo de espera es al menos de 2 días y las etapas ii) a iii) se repiten al menos tres veces. En otra realización, el periodo de espera es al menos de 3 días y las etapas ii) a iii) se repiten al menos cinco veces. En otra realización, el periodo de espera es al menos de 3 días y las etapas ii) a iii) se repiten al menos tres veces. En otra realización, el periodo de 30 espera es al menos de 3 días y las etapas ii) a iii) se repiten al menos cinco veces. En otra realización, el periodo de espera es al menos de 6 días y las etapas ii) a iii) se repiten al menos tres veces. En otra realización, el periodo de espera es al menos de 6 días y las etapas ii) a iii) se repiten al menos cinco veces. En otra realización, el periodo de espera es al menos de 20 días y las etapas ii) a iii) se repiten al menos tres veces. En otra realización, el periodo de espera es al menos de 20 días y las etapas ii) a iii) se repiten al menos cinco veces, En otra realización, el periodo de 35 espera es al menos de 27 días y las etapas ii) a iii)... [Seguir leyendo]
Reivindicaciones:
1. A composición farmacéutica que comprende ácido (+)-1,4-dihidro-7-[(3S,4S)-3-metoxi-4-(metilamino)-1-pirrolidinil]-4-oxo-1-(2-tiazolil)-1,8-naftiridina-3-carboxílico y un ácido orgánico en una solución acuosa, en la que el pH de la composición es 2 a 3,5
2. La composición farmacéutica de la reivindicación 1, en la que el pH de la composición es 2 a 3. 5
3. La composición farmacéutica de la reivindicación 1, en la que el pH de la composición es 2,3 a 2,7.
4. La composición farmacéutica de la reivindicación 3, en la que el ácido orgánico se selecciona de ácido acético, ácido ascórbico, ácido bencenosulfónico, ácido etanosulfónico, ácido glicólico, ácido hidroxietanosulfónico, ácido láctico, ácido maleico, ácido metanosulfónico, ácido propionico, ácido succínico, ácido trifluoroacético y ácido toluenosulfónico.
5. La composición farmacéutica de la reivindicación 1, en la que el ácido orgánico es ácido metanosulfónico. 10
6. La composición farmacéutica de la reivindicación 1, que comprende además un agente de tonicidad.
7. La composición farmacéutica de la reivindicación 6, en la que el agente de tonicidad se selecciona de aminoácidos, electrolitos, monosacáridos, disacáridos y alcoholes hexavalentes.
8. La composición farmacéutica de la reivindicación 6, en la que el agente de tonicidad es sorbitol.
9. La composición farmacéutica de la reivindicación 1, en la que el ácido (+)-1,4-dihidro-7-[(3S,4S)-3-metoxi-4-15 (metilamino)-1-pirrolidinil]-4-oxo-1-(2-tiazolil)-1,8-naftiridina-3-carboxílico está presente en una cantidad de 10 mg/mL, en la que el sorbitol está presente en una cantidad de 4,5% con relación al volumen total de la composición y está presente suficiente ácido metanosulfónico para que el pH de la composición sea 2,5.
10. La composición farmacéutica de la reivindicación 1, en la que la composición comprende 100 mg de ácido (+)-1,4-dihidro-7-[(3S,4S)-3-metoxi-4-(metilamino)-1-pirrolidinil]-4-oxo-1-(2-tiazolil)-1,8-naftiridina-3-carboxílico y 450 mg de 20 sorbitol por 10 mL de la composición y suficiente ácido metanosulfónico para que el pH de la composición sea 2,5.
11. La composición farmacéutica de la reivindicación 9 o 10, que está formulada para inyección o infusión intravenosa.
12. Una forma liofilizada de la composición farmacéutica de cualquiera de las reivindicaciones 1 a 11.
13. La forma liofilizada de la reivindicación 12, en la que dicha forma liofilizada es adecuada para su reconstitución con agua estéril obteniendo una solución con un pH de 2 a 3,5. 25
14. La composición farmacéutica de cualquiera de las reivindicaciones 1 a 13, para uso en el tratamiento del cáncer.
15. La composición farmacéutica de la reivindicación 14, para uso en el tratamiento de cáncer de ovario, cáncer de mama o leucemia.
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Procedimiento de compuestos antifúngicos, del 22 de Julio de 2020, de NQP 1598, Ltd: Procedimiento para preparar un compuesto de fórmula 5 ó 5*, o una mezcla de los mismos: **(Ver fórmula)** comprendiendo el método: (a) hacer reaccionar un compuesto […]
Productos terapéuticos basados en la lantionina sintetasa 2 tipo C, del 15 de Julio de 2020, de LANDOS BIOPHARMA, INC: Un compuesto de la fórmula: **(Ver fórmula)** o una sal o éster farmacéuticamente aceptable de este, en donde: Q es piperazina-1,4-diilo; […]
Derivados de piperidina en calidad de inhibidores de HDAC1/2, del 8 de Julio de 2020, de Regenacy Pharmaceuticals, Inc: Un compuesto de Fórmula IIIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde R1 se selecciona del grupo que consiste […]
Compuestos orgánicos, del 17 de Junio de 2020, de INTRA-CELLULAR THERAPIES, INC: Un compuesto de Fórmula I: **(Ver fórmula)** en forma libre o de sal, donde: R1 y R2 son independientemente H o alquilo C1-4 (por ejemplo, metilo o […]
Compuestos ahorradores de PPAR para el tratamiento de enfermedades metabólicas, del 3 de Junio de 2020, de Metabolic Solutions Development Company LLC (100.0%): Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: cada uno de R1 y R2 se selecciona independientemente entre […]
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Nuevos usos terapéuticos de derivados de la bencilidenguanidina para el tratamiento de proteopatías, del 20 de Mayo de 2020, de InFlectis BioScience: Compuesto de la fórmula (I), o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** o un tautómero de los mismos donde: […]