Composición de raloxifeno.
Un comprimido farmacéutico, que comprende:
(a) una cantidad eficaz de raloxifeno no micronizado o una sal farmacéuticamente aceptable del mismo,
teniendoel tamaño de partícula un d90 igual o superior a 50 micrómetros y/o un d50 igual o superior a 25 micrómetros.
(b) al menos un 25 % en peso de lactosa, preferentemente del 40 al 60 % en peso de dicho comprimido.
(c) del 5 al 25 % en peso de celulosa microcristalina, preferentemente del 10 al 20 % en peso de dicho comprimido;
(d) opcionalmente un aglutinante; y
(e) opcionalmente un disgregante.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2010/004125.
Solicitante: SYNTHON B.V..
Nacionalidad solicitante: Países Bajos.
Dirección: MICROWEG 22 6545 CM NIJMEGEN PAISES BAJOS.
Inventor/es: ABUKHALIL,ASAD.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4535 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo un heterociclo con el azufre como heteroátomo del ciclo, p. ej. pizotifeno.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
PDF original: ES-2437916_T3.pdf
Fragmento de la descripción:
Composición de raloxifeno Antecedentes de la invención El raloxifeno, o (6-hidroxi-2- (4-hidroxi-fenil) benzo[b]tien-3-il) - (4- (2- (1-piperidinil) etoxi) fenil) metanona de la fórmula es un compuesto farmacéuticamente activo indicado para el tratamiento y/o prevención de la osteoporosis en mujeres. En formulaciones farmacéuticas se usa en forma de una sal clorhidrato. Las formulaciones farmacéuticas que comprenden clorhidrato de raloxifeno están comercializadas con, por ejemplo, la marca Evista® de Eli Lilly.
La formulación comercializada es un comprimido recubierto con película que comprende 60 mg de clorhidrato de raloxifeno. Los excipientes en la composición incluyen povidona (polivinilpirrolidona) , polisorbato 80, lactosa anhidra, lactosa monohidrato, crospovidona, estearato de magnesio, hipromelosa, macrogol 400 (polietilenglicol) , cera carnauba, glaseado farmacéutico modificado y propilenglicol.
El compuesto de raloxifeno, así como el compuesto de clorhidrato de raloxifeno, se han divulgado en, por ejemplo, el documento US 4418068. Los esquemas sintéticos adicionales, así como el clorhidrato de raloxifeno cristalino, se han divulgado en el documento WO 96/09045 (US 5731327) . El uso de raloxifeno en el tratamiento de la pérdida de hueso y composiciones del mismo se han descrito en el documento US 5393763 y el documento US 5478847. El clorhidrato de raloxifeno es muy ligeramente soluble en cada uno de agua (627 μg/ml) , fluido gástrico y fluido intestinal. Debido en parte a la baja solubilidad en agua, la biodisponibilidad del clorhidrato de raloxifeno normalmente es baja. De acuerdo con lo anterior se han propuesto varios abordajes para aumentar la biodisponibilidad del clorhidrato de raloxifeno en formulaciones farmacéuticas.
El documento EP 670162 B1 (US 5811120, US 5972383) divulgó una formulación farmacéutica administrada por vía oral que comprende raloxifeno o una sal farmacéuticamente aceptable del mismo (preferentemente clorhidrato) en combinación con (i) un tensioactivo, (ii) un diluyente hidrosoluble y (iii) opcionalmente un aglutinante hidrófilo tal como polivinilpirrolidona. De acuerdo con los poseedores de la patente, el tensioactivo y el diluyente hidrosoluble potencian la biodisponibilidad del clorhidrato de raloxifeno. El tensioactivo es, preferentemente, un éster de ácido graso de polioxietilensorbitano tal como polisorbato 80 y el diluyente hidrosoluble es, preferentemente, un azúcar, especialmente lactosa. Aunque se divulga como “opcional”, el aglutinante hidrófilo está, en todo caso, preferentemente presente y, más preferentemente, es polivinilpirrolidona. De forma correspondiente, cada reivindicación de los documentos EP 670162 B1, US 5811120 y US 5972383 requiere la presencia de polivinilpirrolidona en la formulación farmacéutica.
Posteriormente, el documento WO 97/35571 (US 6458811, US 6797719, y US 6894064) divulgó la micronización del clorhidrato de raloxifeno con el fin de aumentar la biodisponibilidad. El clorhidrato de raloxifeno particulado tiene una mediana del tamaño de partícula de 25 micrómetros o menor, preferentemente de 5 a 20 micrómetros. Generalmente, las partículas tienen una distribución del tamaño tal que al menos el 90 % tiene un tamaño de partícula de menos de 50 micrómetros, preferentemente menos de 35 micrómetros. Las reivindicaciones en los documentos US 6797719 y US 6894064 indican que el uso de un tensioactivo y un diluyente hidrosoluble (como antes en la composición del documento EP 670162 B1 tratada anteriormente) se usan, preferentemente, en combinación con el clorhidrato de raloxifeno micronizado.
Como alternativa, el documento EP 826682 B1 ha divulgado que el clorhidrato de raloxifeno amorfo tiene mejor solubilidad y biodisponibilidad. La forma amoría generalmente se estabiliza para prevenir la conversión en forma cristalina mediante el uso de povidona, PEG u otros materiales estabilizantes conocidos.
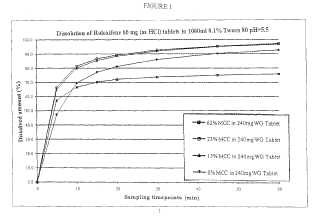
El documento WO 2006/052254 A2 divulgó una formulación farmacéutica comprimida que comprende clorhidrato de raloxifeno y almidón en una cantidad superior a aproximadamente 25 %, preferentemente a 45-75 %. Se pretende que el uso de cantidades tan grandes de almidón permita el uso de clorhidrato de raloxifeno no micronizado (es decir, partículas grandes) al tiempo que se consiguen tasas de disolución satisfactorias y biodisponibilidad. Preferentemente, los comprimidos se fabrican mediante un procedimiento de compresión doble en húmedo. Los ejemplos comparan una composición a base de lactosa/celulosa microcristalina y una composición con un contenido bajo en almidón con varias composiciones con un contenido elevado en almidón (almidón 60-75 %) . Las composiciones con un contenido elevado en almidón, que no contenían un diluyente hidrosoluble tal como lactosa, tenían la mejor disolución.
El documento WO 2009/049643 A1 divulgó otra composición de raloxifeno. Se pretende que un súper disgregante tal como glicolato de almidón sódico (Primojel) potencie la biodisponibilidad y que incremente la liberación de fármaco. Normalmente, la composición se prepara mediante granulación en húmedo y generalmente contiene un tensioactivo tal como poloxámero 407. Se puede añadir a la composición un agente de ajuste de pH tal como ácido cítrico y se menciona un pH de 6, 0. El uso de ácido cítrico monohidrato en una cantidad de 2 % se muestra en dos de los ejemplos. Los otros excipientes, tales como aglutinante, diluyente etc., no se describen como limitados específicamente pero los ejemplos muestran el uso de fosfato cálcico dibásico (un diluyente insoluble en agua) y celulosa microcristalina. El tamaño de las partículas de clorhidrato de raloxifeno no se describe ni aborda.
El documento US 2005/0249814 ha divulgado composiciones farmacéuticas que tienen mejor solubilidad, que comprenden un fármaco hidrófobo y un compuesto que tiene al menos un resto de ácido carboxílico en una proporción de 1:0, 1 a 25, respectivamente. La divulgación está dirigida principalmente a ziprasidona HCl pero también se menciona que son adecuados varios fármacos que incluyen raloxifeno. El compuesto que tiene el resto de ácido carboxílico incluye varios ácidos, siendo el más preferido el ácido cítrico. Los ejemplos muestran que la cantidad de ácido necesaria para ser significativamente eficaz (al menos en el caso de la ziprasidona) es bastante grande en porcentaje de la composición de la cápsula, por ejemplo del 36 % al 53 % de ácido cítrico en los ejemplos 5 y 6.
El documento US 2002/0031548 divulgó varias combinaciones excipientes para raloxifeno HCl, es decir, los ejemplos 7-9. Estas recetas incluyen lactosa, celulosa microcristalina, almidón y un tensioactivo. También se incluye ácido ascórbico o ascorbato sódico como antioxidante en cantidades de 1, 5 a 10 %. No obstante, no se proporciona la cantidad relativa de raloxifeno y, por tanto, los porcentajes citados no corresponden a los porcentajes del peso del comprimido. No se proporcionan datos sobre disolución o biodisponibilidad con respecto a estas formulaciones de raloxifeno y no se exponen discusiones sobre información del tamaño de partícula ni de la disolución asociados con las mismas.
Aunque se han expuesto varios abordajes para proporcionar raloxifeno con una disolución y/o biodisponibilidad adecuados sería deseable proporcionar una formulación basada en un diluyente hidrosoluble que no requiera raloxifeno micronizado.
Sumario de la invención La presente invención se refiere a comprimidos de raloxifeno y a procedimientos para fabricar los mismos. De acuerdo con esto, un primer aspecto de la invención se refiere a un comprimido farmacéutico, que comprende: (a) una cantidad eficaz de raloxifeno no micronizado o una sal farmacéuticamente aceptable del mismo; (b) al menos un 25 % en peso de lactosa; (c) de 5 a 25 % en peso de celulosa microcristalina; opcionalmente (d) un aglutinante; y opcionalmente (e) un disgregante. La combinación de celulosa microcristalina con lactosa puede proporcionar, sorprendentemente, una liberación mejorada de raloxifeno no micronizado (definido a continuación en el presente documento) . En una realización preferida, el comprimido exhibe un perfil de disolución de modo tal que al menos el 85 % y preferentemente el 90 % del raloxifeno se libere en 30 minutos y, preferentemente, al menos un 95 % de la liberación de raloxifeno en 60 minutos en condiciones de disolución adecuadas, tal como un aparato USP de tipo II, en 1 litro de una solución acuosa que contiene 0, 1 % de polisorbato 80 con una velocidad de la paleta de 50 rpm. Dicha disolución se puede alcanzar sin la inclusión de un tensioactivo en el comprimido, aunque el uso del mismo no se excluye. En una realización ventajosa,... [Seguir leyendo]
Reivindicaciones:
1. Un comprimido farmacéutico, que comprende:
(a) una cantidad eficaz de raloxifeno no micronizado o una sal farmacéuticamente aceptable del mismo, teniendo el tamaño de partícula un d90 igual o superior a 50 micrómetros y/o un d50 igual o superior a 25 micrómetros.
(b) al menos un 25 % en peso de lactosa, preferentemente del 40 al 60 % en peso de dicho comprimido.
(c) del 5 al 25 % en peso de celulosa microcristalina, preferentemente del 10 al 20 % en peso de dicho comprimido;
(d) opcionalmente un aglutinante; y
(e) opcionalmente un disgregante.
2. El comprimido de acuerdo con la reivindicación 1, que contiene del 1 al 10 % en peso de dicho aglutinante y, preferentemente, dicho aglutinante es una polivinilpirrolidona.
3. El comprimido de acuerdo con la reivindicación 1 o 2, que contiene el 1-10 % en peso de dicho disgregante y, preferentemente, dicho disgregante es una crospovidona.
4. El comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 3, que además comprende del 0, 1 al 5, 0 % en peso de un ácido orgánico.
5. El comprimido de acuerdo con la reivindicación 4, en el que dicho ácido orgánico es ácido cítrico y, preferentemente, dicho ácido cítrico está contenido en una cantidad del 0, 1-1, 0 % en peso.
6. El comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en el que la proporción en peso de celulosa microcristalina a lactosa está dentro del intervalo de 1:1-12 (partes : partes) , preferentemente 1:1, 5-10, más preferentemente 1:2-5 respectivamente.
7. El comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que dicho raloxifeno es clorhidrato de raloxifeno.
8. El comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 7, en el que dicho raloxifeno tiene un d90 de 51 a 75 micrómetros.
9. El comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 8, en el que dicho raloxifeno tiene un d50 de 26 a 40 micrómetros.
10. El comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en el que dicho raloxifeno comprendel 10 al 30 % en peso de dicho comprimido.
11. El comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 10, en donde dicho comprimido exhibe al menos un 85 % de liberación de raloxifeno en 30 minutos usando un aparato USO de tipo II en 1 litro de solución acuosa que contiene un 0, 1 % de polisorbato 80 a una velocidad de la paleta de 50 rpm.
12. Un procedimiento para fabricar un comprimido, que comprende:
(1) mezclar raloxifeno no micronizado, o una sal farmacéuticamente aceptable del mismo, que tiene un tamaño de partícula promedio de al menos 25 micrómetros y/o un d90 de al menos 50 micrómetros; celulosa microcristalina; un disgregante y opcionalmente un aglutinante para formar una mezcla;
(2) granular en húmedo dicha mezcla con agua para formar gránulos;
(3) mezclar dichos gránulos con al menos lactosa para formar una mezcla de comprimidos; y
(4) formar comprimidos con dicha mezcla para comprimidos mediante compresión para formar al menos un comprimido;
en el que la lactosa comprende al menos un 25 % en peso, y preferentemente del 40 al 60 % en peso de dicho comprimido y dicha celulosa microcristalina comprende del 5 al 25 % en peso de dicho comprimido.
13. El procedimiento de acuerdo con la reivindicación 12, en la que dicha agua usada en dicha etapa de granulación contiene un ácido orgánico.
14. Un procedimiento para fabricar un comprimido sin ayuda de agua, que comprende:
(1) mezclar en una o más etapas al menos raloxifeno no micronizado, o una sal farmacéuticamente aceptable del mismo, que tiene un tamaño de partícula promedio de al menos 25 micrómetros y/o un d90 de al menos 50 micrómetros; celulosa microcristalina; lactosa; un aglutinante y un disgregante, para formar una mezcla de comprimido; y
(2) formar comprimidos con dicha mezcla para comprimidos mediante compresión para formar al menos un comprimido;
en el que la lactosa comprende al menos un 25 % en peso, y preferentemente del 40 al 60 % en peso de dicho comprimido y dicha celulosa microcristalina comprende del 5 al 25 % en peso de dicho comprimido.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Formulación de vitamina D de liberación modificada estabilizada y método de administración de la misma, del 22 de Julio de 2020, de EirGen Pharma Ltd: Una formulacion oral de liberacion controlada de un compuesto de vitamina D que comprende uno o ambos de 25- hidroxivitamina D2 y 25-hidroxivitamina D3, la formulacion […]
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Composiciones y métodos para tratar el virus de la hepatitis C, del 15 de Julio de 2020, de Gilead Pharmasset LLC: Una composición farmacéutica que comprende: a) de aproximadamente el 25% a aproximadamente el 35% p/p de GS-7977 cristalino que tiene la estructura **(Ver […]
Macrogols para aplicación a la mucosa, y sus usos terapéuticos, del 15 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Composición farmacéutica en forma sólida que comprende, por unidad de dosificación, entre 5 y 400 mg de un PEG con un grado de 3000 o más, para uso en el tratamiento […]
Granulados secos de polvos de sílice mesoporosa, del 1 de Julio de 2020, de FORMAC PHARMACEUTICALS N.V: Un granulado seco que comprende desde el 50% al 100% p/p de sílice mesoporosa ordenada que tiene una organización bidimensional hexagonalmente […]
Composición farmacéutica novedosa, del 1 de Julio de 2020, de NOVARTIS AG: Un comprimido farmaceutico que comprende: a) un farmaco que es el solvato con sulfoxido de dimetilo de N-{3-[3-ciclopropil-5-(2-fluoro-4-5 yodofenilamino)-6,8- dimetil-2,4,7-trioxo-3,4,6,7-tetrahidro-2H-pirido[4,3-d]pirimidin-1-il]fenil}acetamida […]