COMPOSICION QUE CONTIENE LIPASA NO FUNGICA, RETICULADA Y METODOS DE USO.
Una composición que comprende:
(a)un cristal de lipasa no fúngica reticulado con un agente reticulante multifuncional;
(b)una proteasa; y
(c)una amilasa, en forma amorfa
en la que el cristal de lipasa es activo a un pH de 2,0 a 9,0
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US01/06074.
Solicitante: ALTUS BIOLOGICS INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 645 PUTNAM AVENUE,CAMBRIDGE, MA 02139-4807.
Inventor/es: MARGOLIN,ALEX, SHENOY,BHAMI.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K38/46 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hidrolasas (3).
- A61K38/47 A61K 38/00 […] › que actúan sobre compuestos glicosílicos (3.2), p. ej. celulosas, lactasas.
- A61K38/48 A61K 38/00 […] › que actúan sobre enlaces peptídicos (3.4).
- A61K38/48L
- C12N9/20 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Escisión de triglicéridos, p. ej. por medio de lipasa.
- C12N9/96 C12N 9/00 […] › Estabilización de una enzima por formación de un aducto o de una composición; Formación de conjugaciones de enzimas.
Clasificación PCT:
- A61K38/46 A61K 38/00 […] › Hidrolasas (3).
- A61K38/47 A61K 38/00 […] › que actúan sobre compuestos glicosílicos (3.2), p. ej. celulosas, lactasas.
- A61K38/48 A61K 38/00 […] › que actúan sobre enlaces peptídicos (3.4).
- A61P1/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del tracto alimentario o del aparato digestivo.
- A61P3/00 A61P […] › Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00).
Clasificación antigua:
- A61K38/46 A61K 38/00 […] › Hidrolasas (3).
- A61K38/47 A61K 38/00 […] › que actúan sobre compuestos glicosílicos (3.2), p. ej. celulosas, lactasas.
- A61K38/48 A61K 38/00 […] › que actúan sobre enlaces peptídicos (3.4).
- A61P1/00 A61P […] › Medicamentos para el tratamiento de trastornos del tracto alimentario o del aparato digestivo.
- A61P3/00 A61P […] › Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00).
- C12N9/96 C12N 9/00 […] › Estabilización de una enzima por formación de un aducto o de una composición; Formación de conjugaciones de enzimas.
Fragmento de la descripción:
Composición que contiene lipasa no fúngica, reticulada y métodos de uso.
Campo de la invención
Esta invención se refiere en general a composiciones que contienen enzimas y, más concretamente, a composiciones que contienen lipasa para el tratamiento de trastornos caracterizados por una baja secreción de lipasas.
Antecedentes de la invención
Las enfermedades metabólicas o gastrointestinales a menudo son el resultado de la ausencia de una enzima eficaz cuya función es necesaria en un punto determinado de la vía bioquímica. Por ejemplo, puede determinarse que unos niveles inapropiados de lipasa conducen a una diversidad de trastornos digestivos, incluyendo la malabsorción de grasas. La malabsorción de grasas se desarrolla a menudo en pacientes que padecen fibrosis quística, pancreatitis crónica y otras enfermedades del páncreas, cuando la secreción de lipasa pancreática disminuye por debajo del 5-10% de los niveles normales. Las consecuencias de la malabsorción de grasas que habitualmente se observan incluyen molestias abdominales, esteatorrea (deposiciones grasas), deficiencia en ácidos grasos esenciales (EFA), deficiencia en vitaminas liposolubles (por ejemplo, A, D, E y K), y una incapacidad generalizada para desarrollarse.
Un método reconocido para tratar enfermedades o trastornos asociados con una insuficiencia en lipasa es la terapia de sustitución oral. Este régimen de tratamiento incluye la administración oral de enzimas lipasas al individuo afectado para aumentar la digestión y la posterior absorción de los nutrientes. Las preparaciones disponibles en el mercado de lipasa pueden no tratar completamente los síntomas asociados con la insuficiencia en lipasa. Por ejemplo, la lipasa porciona disponible en el mercado puede no eliminar la esteatorrea pancreática provocada por la pancreatitis crónica o por la fibrosis quística. Los factores responsables de las dificultades en el tratamiento de la esteatorrea pueden incluir la destrucción de la lipasa sustituida por el jugo gástrico, la destrucción de la lipasa sustituida por las proteasas intraluminales, y el vaciado gástrico asincrónico del suplemento enzimático y los nutrientes de los alimentos.
Las lipasas que se emplean habitualmente en la terapia de sustitución son más activas a un pH alcalino, y muestran una pérdida significativa de actividad cuando el pH es menor que 5. Se ha indicado que la lipasa pancreática, por ejemplo, se desnaturaliza de forma irreversible a pH 4 o menor. Debido a esta inestabilidad, las terapias de sustitución basadas en lipasas pueden incluir administraciones repetidas de lipasas y/o la administración de altas dosis de las enzimas a los individuos afectados. Unas altas dosis de enzimas pueden estar asociadas con unos efectos secundarios indeseables.
Sumario de la invención
La invención se basa, en parte, en el descubrimiento de composiciones que incluyen lipasas en una forma cristalina reticulada que es muy resistente a la degradación proteolítica y ácida. Debido a que la lipasa cristalina reticulada muestra una alta estabilidad frente a proteasas y a ácidos, la composición puede administrarse en dosis bajas a pacientes que padecen trastornos gastrointestinales. En un aspecto, la invención proporciona una composición que incluye un cristal de lipasa reticulado, una proteasa, y una amilasa en forma amorfa. El cristal de lipasa en la composición se reticula con un agente reticulante multifuncional y es preferiblemente estable a pH 1-9. La enzima es activa a un pH de aproximadamente 2,0 a 9,0. Más preferiblemente, la enzima es activa a pH 4-7.
Una composición preferida incluye un cristal de enzima reticulado de Burkholderia cepacia ("BC"), una proteasa fúngica o vegetal, y una amilasa fúngica o bacteriana. Preferiblemente, la proteasa es bromelaína.
Preferiblemente, el cristal de lipasa es activo tras la exposición del cristal de lipasa durante periodos extensos de tiempo a proteasas, condiciones ácidas, temperaturas elevadas, o una combinación de éstas.
La invención también proporciona un método para tratar o prevenir la malabsorción de grasas en un mamífero, por ejemplo, un ser humano, que padece, o está en riesgo de padecer, un trastorno caracterizado por una baja actividad lipasa. El método incluye administrar al sujeto una composición que incluye un cristal reticulado de una lipasa, una proteasa y una amilasa, en una cantidad suficiente para prevenir o inhibir una baja actividad lipasa, o para reducir o prevenir los síntomas asociados con una baja actividad lipasa.
Las lipasas muy estables descritas en la presente son estables tras su administración a un sujeto. Por tanto, pueden administrarse sin preparaciones de microesferas con revestimiento entérico. Las lipasas descritas en la presente también pueden administrarse en dosis más bajas a un sujeto.
A menos que se defina de otra forma, todos los términos técnicos y científicos utilizados en la presente tienen el mismo significado que entienden habitualmente los expertos en la técnica a la cual pertenece esta invención. Aunque pueden utilizarse métodos y materiales similares o equivalentes a los descritos en la presente en la práctica o el ensayo de la presente invención, a continuación se describen métodos y materiales adecuados. En caso de conflicto, la presente solicitud, incluyendo las definiciones, dominará. Además, los materiales, los métodos y los ejemplos son sólo ilustrativos y no pretenden ser limitantes.
Otras características y ventajas de la invención serán evidentes a partir de la siguiente descripción detallada y a partir de las reivindicaciones.
Breve descripción de los dibujos
La Figura 1 es un histograma que muestra el efecto de diversas dosis de complejo de enzima reticulada de Burkholderia cepacia ("CLEC-BC") sobre el coeficiente medio de la absorción de grasas ("CFA").
La Figura 2 es un histograma que muestra el efecto de diversas dosis de CLEC-BC sobre la grasa media en las deposiciones.
La Figura 3 es un histograma que muestra el efecto de diversas dosis de CLEC-BC sobre el coeficiente medio de la absorción de grasas ("CPA").
La Figura 4 es un histograma que muestra el efecto de diversas dosis de una partícula que contiene CLEC-BC, amilasa, y una proteasa, sobre el coeficiente medio de la absorción de grasas ("CFA").
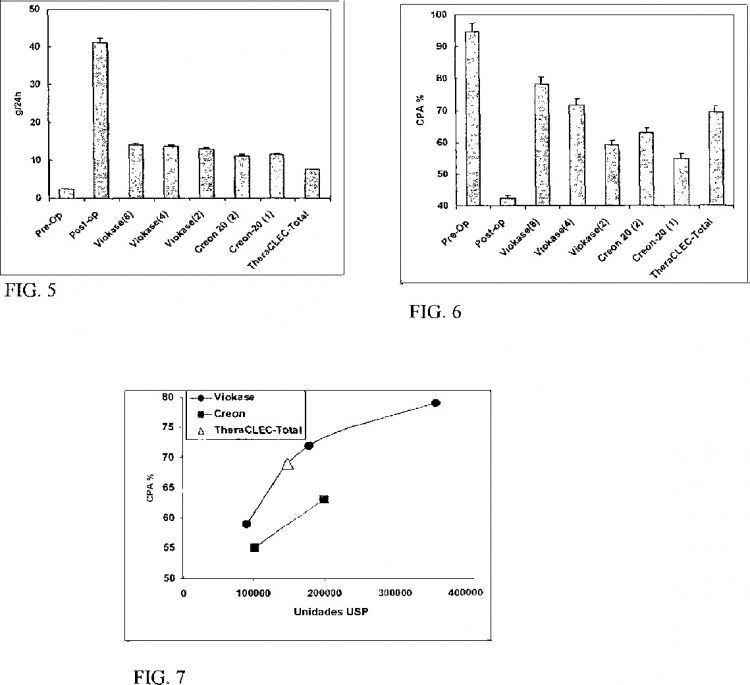
La Figura 5 es un histograma que muestra el efecto de diversas dosis de una partícula que contiene CLEC-BC, una amilasa y una proteasa, sobre la grasa media en las deposiciones.
La Figura 6 es un histograma que muestra el efecto de diversas dosis de una composición que contiene CLEC-BC, una amilasa y una proteasa, sobre el coeficiente medio de la absorción de proteínas ("CPA").
La Figura 7 es una gráfica que muestra el efecto de diversas lipasas terapéuticas sobre el CPA medio.
Descripción detallada de la invención
La invención proporciona composiciones que incluyen cristales de lipasa reticulados que son inesperadamente activos tras su exposición a condiciones rigurosas asociadas con el tracto gastrointestinal superior. Estas condiciones incluyen el entorno ácido (es decir, el pH bajo) del estómago y los altos niveles de proteasas presentes en el tracto gastrointestinal. En realizaciones preferidas, las composiciones se proporcionan en composiciones duraderas que pasan a través del entorno gástrico muy ácido del estómago y permiten el transporte de las enzimas en la composición al intestino de un sujeto.
Los componentes de proteasas pueden proporcionarse en forma cristalina o amorfa, no cristalina. Estas últimas enzimas degradan los carbohidratos y las proteínas presentes en las regiones intestinales.
Debido a la mayor estabilidad de los cristales de lipasa reticulados, las composiciones farmacéuticas de la invención tienen unas mayores actividades específicas en el tracto gastrointestinal. Como resultado, pueden administrarse en menores cantidades por dosis, y pueden administrarse menos veces a lo largo del régimen de tratamiento, a menos dosis, y en menos administraciones.
Composiciones que contienen cristales de lipasa reticulados estabilizados
La invención proporciona una composición que incluye un cristal de lipasa no fúngico, una proteasa y una amilasa en forma amorfa. El cristal de lipasa está presente en la composición como un cristal reticulado.
En general, puede utilizarse cualquier lipasa en la composición, con la condición de que pueda proporcionarse en una...
Reivindicaciones:
1. Una composición que comprende:
en la que el cristal de lipasa es activo a un pH de 2,0 a 9,0.
2. La composición según la reivindicación 1, en la que el cristal de lipasa es activo tras su exposición durante al menos una hora a un entorno que tiene un pH de 1,0 a 4,0.
3. La composición según la reivindicación 1, en la que el cristal de lipasa es activo tras su exposición durante al menos dos horas a un entorno que tiene un pH de 1,0 a 4,0.
4. La composición según la reivindicación 1, en la que el cristal de lipasa es activo tras su exposición durante al menos cinco horas a un entorno que tiene un pH de 1,0 a 4,0.
5. La composición según la reivindicación 1, en la que el agente reticulante multifuncional es bis(succinimidil)suberato.
6. La composición según la reivindicación 1, en la que la lipasa se deriva de una lipasa bacteriana.
7. La composición según la reivindicación 6, en la que la lipasa bacteriana es una lipasa de Pseudomonas.
8. La composición según la reivindicación 7, en la que la lipasa de Pseudomonas es la lipasa de Burkholderia cepacia.
9. La composición según la reivindicación 1, en la que la amilasa se selecciona del grupo que consiste en una amilasa de Bacillus y una amilasa de Aspergillus.
10. La composición según la reivindicación 1, en la que la proteasa es una proteasa fúngica.
11. La composición según la reivindicación 1, en la que la proteasa es un cristal de proteasa.
12. La composición según la reivindicación 11, en la que el cristal de proteasa es un cristal de proteasa reticulado.
13. La composición según la reivindicación 1, en la que la proteasa está en una forma no cristalina.
14. La composición según la reivindicación 1, en la que la composición está en forma de polvo.
15. La composición según la reivindicación 1, en la que la composición es una suspensión acuosa.
16. La composición según la reivindicación 1, en la que la composición está en forma de cápsula o de comprimido.
17. La composición según la reivindicación 1, en la que el cristal de lipasa muestra una actividad específica frente al aceite de oliva mayor que 500, 1000, 4000, 5000, 6000, 7000, 8000, 9000 o más unidades por mg de lipasa.
18. La composición según la reivindicación 1, que comprende además un vehículo farmacéuticamente aceptable.
19. La composición según la reivindicación 1, en la que la composición es una composición farmacéutica.
20. La composición según una cualquiera de las reivindicaciones 1, 18 ó 19, en la que la composición está presente en una formulación adecuada para la administración oral a un sujeto.
21. La composición según la reivindicación 18, en la que el vehículo farmacéutico se selecciona del grupo que consiste en un diluyente, un excipiente y un adyuvante.
22. La composición según la reivindicación 18, en la que el vehículo es un vehículo polimérico.
23. La composición según la reivindicación 22, en la que el vehículo polimérico es un polímero biodegradable.
24. La composición según la reivindicación 22, en la que la composición está encapsulada dentro de una matriz del vehículo polimérico.
25. La composición según la reivindicación 24, en la que al menos 50% de la composición permanece encapsulada dentro de la matriz tras la exposición del vehículo polimérico a un entorno que tiene un pH de 1,0 a 3,0 durante al menos una hora.
26. El uso de la composición según la reivindicación 1 para la preparación de una composición farmacéutica para tratar o prevenir un trastorno gastrointestinal en un mamífero.
27. El uso según la reivindicación 26, en el que la composición se administra por vía oral.
28. El uso según la reivindicación 26, en el que el mamífero es un ser humano.
29. El uso según la reivindicación 26, en el que el trastorno gastrointestinal se selecciona del grupo que consiste en pancreatitis e insuficiencia pancreática.
30. El uso según la reivindicación 26, en el que el sujeto padece o está en riesgo de padecer fibrosis quística.
31. El uso de la composición según la reivindicación 1 para la preparación de una composición farmacéutica para tratar o prevenir la malabsorción de grasas en un mamífero que padece o que está en riesgo de padecer un trastorno que se caracteriza por una baja secreción de lipasas.
32. El uso según la reivindicación 31, en el que la composición se administra por vía oral al mamífero.
33. El uso según la reivindicación 31, en el que el mamífero es un ser humano.
34. El uso según la reivindicación 31, en el que la composición se administra de modo preprandial al sujeto.
35. El uso según la reivindicación 31, en el que la composición se administra de modo prandial al sujeto.
36. El uso según la reivindicación 31, en el que la composición se administra de modo postprandial al sujeto.
37. El uso según la reivindicación 31, en el que la composición se administra al mamífero en una cantidad suficiente para aumentar el coeficiente de absorción de grasas en el mamífero hasta más del 60%.
38. El uso según la reivindicación 31, en el que la composición se administra al mamífero en una cantidad suficiente para aumentar el coeficiente de absorción de grasas en el mamífero hasta más del 80%.
39. El uso según la reivindicación 26, en el que la composición se administra al mamífero en una cantidad suficiente para aumentar el coeficiente de absorción de proteínas en el mamífero hasta más del 60%.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Compuestos para el tratamiento de Trastornos Neuropsiquiátricos, del 24 de Junio de 2020, de Curemark LLC: Una composición que comprende enzimas digestivas para uso en el tratamiento del Trastorno Esquizofreniforme, en donde las enzimas digestivas comprenden amilasa, lipasa […]
Tratamiento de glucogenosis de tipo II, del 20 de Mayo de 2020, de DUKE UNIVERSITY: α-Glucosidasa ácida (GAA) humana recombinante producida en un cultivo de células de ovario de hámster chino para uso en un método de tratamiento de glucogenosis […]
Reticuladores químicos, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: Un método de realización de un péptido de direccionamiento lisosomal modificado que comprende: a. poner en contacto el factor de crecimiento similar […]
Regímenes de dosificación para el tratamiento de la enfermedad de Fabry, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: 1-desoxigalactonojirimicina para su uso en el tratamiento de enfermedad de Fabry, en donde el tratamiento comprende administrar a un paciente desde aproximadamente 50 mg hasta […]
Proteína, del 18 de Diciembre de 2019, de Dupont Nutrition Biosciences ApS: Un polipéptido aislado que presenta actividad de xilanasa, seleccionado del grupo que consiste en: (a) un polipéptido que comprende una secuencia de aminoácido que tiene […]
Composiciones de alfa-galactosidasa, del 18 de Diciembre de 2019, de PROTALIX LTD. (100.0%): Una proteína α-galactosidasa humana que comprende una glicina como el resto N-terminal en donde dicha proteína α-galactosidasa humana se fusiona traduccionalmente […]