Composición conteniendo quitosan y fosfato de poliol o un fosfato de azúcar.
Una composición de suministro de medicamento nasal u ocular en forma de una solución acuosa osuspensión para suministro de un agente terapéutico por una superficie mucosal ocular o nasal en lacirculación sistematica que comprende:
(i) quitosan, una sal del mismo o derivado del mismo que ha sido formado por unión de grupos aciloo alquiol con grupos hidroxilo del quitosan o una sal de un derivado tal del mismo;
(ii) un sal de fosfato de poliol o fosfato de azúcar;
(iii) citrato de trietilo como un plastificante; y
(iv) un agente terapéutico que actúa sistémicamente.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2005/000592.
Solicitante: ARCHIMEDES DEVELOPMENT LIMITED.
Inventor/es: ILLUM, LISBETH, DYER, ANN, MARGARET, PASTOR,PATRICIA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/485 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Derivados del morfinano, p. ej. morfina, codeína.
- A61K47/36 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Polisacáridos; Sus derivados, p. ej. gomas o resinas, almidón, alginato, dextrina, ácido hialurónico, quitosano, inulina, agar o pectina.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
PDF original: ES-2420356_T3.pdf
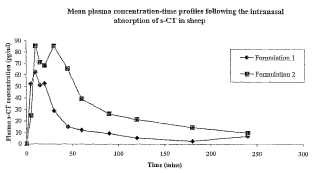
Fragmento de la descripción:
Esta invención se refiere a composiciones farmacéuticas que aseguran la captación de agentes terapéuticos por superficies mucosas. [0002] Los medicamentos polares, incluyendo medicamentos de bajo peso molecular, péptidos de alto peso molecular, proteínas y polisacáridos, no son normalmente absorbidos eficazmente por las membranas mucosas, tales como el tracto gastrointestinal, la mucosa oral, el ojo, la vagina, la cavidad nasal o el recto. [0003] El uso de "mejorantes de absorbción" tales como tensioactivos no iónicos, ciclodextrinas, fosfolípidos y sales biliares para mejorar la absorbción de moléculas polares por membranas mucosas ha sido descrito previamente (Para una revisión ver Davis et al (eds.) , Deliver y Systems for Peptide Drugs, Plenum Press, New York, 1987; y Lee (ed.) , Peptide and Protein Deliver y , Marcel Dekker Inc., New York, 1991) . [0004] Quitosan es un biopolímero catiónico que comprende glucosamina y glucosamina N-acetil que tiene propiedades bioadhesivas y se ha mostrado que mejora la biodisponibilidad sistematica de ciertos compuestos de medicamentos por superficies mucosales tal como la cavidad nasal (ver IIlum, Drug Discover y Today, 7, 1184-1189, 2002) . [0005] Soluciones neutras inyectables de quitosan que forman geles biodegradables in situ se describen en la literatura (A. Chenite et aL, Biomaterials 21: 2155-2161 (2000) ; E. Ruel-Gariepi et aL, Int. J. Farm. 203: 89-98 (2000) ; A. Chenite et aL, Carboidrate Polimers 46: 39-47 (2001) ) Y la literatura de patentes (W001/36000, W099/07416 y US-B-6344488) . La formación de gel in-situ es facilitada por la adición de una sal aniónica poliol-fosfato a la solución de quitosan, se informa que esto resulta en la neutralización de quitosan cargado positivamente y la solución F. Cuando inyectadas in vivo las fórmulas líquidas son covertidas en implantes de gel in-situ y pueden ser usadas para suministrar moléculas biológicamente activas y como matrices encapsulantes para aplicaciones de ingeniería de tejidos (A. Chenite et a!., Carboidrate Polimers 46: 39-47 (2001) ) . [0006] US 9422116 revela una composición oftálmica de liberación sostenida de líquido acuoso que comprende quitosan. [0007] Es un objeto de la presente invención proporcionar una composición adecuada para suministro de agentes terapéuticos por la superficie mucosa!. En particular, la presente invención se preocupa de la provisión de una solución que gelifica a temperatura fisiológica, prolongando de ese modo el tiempo de residencia del agente terapéutico sobre la superficie mucosa!. [0008] Más particularmente, a la vista de las ventajas conocidas del uso del quitosan en composiciones para el transpote de medicamentos por membranas mucosales, tal como la cavidad nasal, sería particularmente ventajoso proporcionar composiciones de quitosan que inicialmente tienen baja viscosidad pero forman un gel a temperatura fisiológica de forma un gel se forma poco después de la aplicación a una superficie mucosa!. Esto no ha sido posible previamente a causa de que las composiciones que comprenden quitosan en concentración relativamente alta tienden a tener alta viscosidad y puede, por tanto, ser difíciles de suministrar, usando por ejemplo un dispositivo de spray nasal. Adicionalmente, el comienzo de la gelificación usando composiciones de la técnica anterior pueden ser prolongado. [0009] La presente invención, por tanto, proporciona una composición de acuerdo a la Reivindicación 1. [0010] Las composiciones de la invención puede estar en cualquier forma adecuada. Como la persona de normal conocimiento en la materia apreciará, formas adecuadas dependerán del método pretendido de administración. Las composiciones de la invención están en la forma de una solución acuosa o una composición acuosa en la cual el agente terapéutico se suspende. [0011] Por el término "quitosan" incluimos los derivados de quitina, o poli-N-acetil-D-glucosamina, incluyendo todas las poliglucosaminas y oligómeros de materiales de glucosamina de diferentes pesos moleculares, en que la mayor proporción de los grupo N acetil ha sido eliminada a traves de hidrólisis (desacetilación) . De acuerdo con la presente invención, el grado de desacetilación, que representa la proporción de grupos N acetil que han sido eliminados por desacetilación, debería ser preferiblemente mayor que 40 %, por ejemplo de 40 a 97%, más preferiblemente de 50 a 98%, más preferiblemente de 60 a 95% y más preferiblemente de 70 a 90%. [0012] El quitosan, derivado o sal de quitosan usado en la presente invención deberia tener preferiblemente un peso molecular de 4000 Daltons (Da) o mayor, más preferiblemente de 10, 000 a 2, 000, 000 Da, más preferiblemente de 25, 000 a 1, 000, 000 Da y más preferiblemente de 50, 000 a 300, 000 Da. [0013] Las sales de quitosan son adecuadas para usar en la presente invención. Sales con varios ácidos orgánicos y no orgánicos son adecuados. Tales sales adecuadas incluyen, pero no están limitadas al nitrato, fosfato, glutamato, lactato, sulfato, citrato, hidrocloruro y sales de acetato. Preferiblemente, se usa la sal de glutamato o hidrocloruro. [0014] Derivados de quitosan y sus sales son también adecuados para el uso de la invención. Derivados de quitosan adecuados son derivados formados por unión de grupos acilo y/o alquilo con grupos hidroxilo, pero no los grupos amino de quitosan. Ejemplos incluyen éteres O-alquil de quitosan, ésteres O-acil de quitosan, trimetil quitosan y derivados similares. Quitosanos modificados, tales como los conjugados a polietilenglicol pueden ser usados en la presente invención. Conjugados de quitosan y polietilenglicol son descritos en W099/01498. [0015] Quitosanos adecuados para uso en la presente invención pueden ser obtenidos de varias fuentes, incluyendo Primex, Haugesund, Noruega; NovaMatrix, Drammen, Noruega; Seigagaku America Inc., MD, USA; Meron (India) Pvt, Ud., India; Vanson Ud, VA, USA; Y AMS Biotechnology Ud., UK. Derivados adecuados incluyen aquellos que son revelados en Roberts, Quitina Chemistr y , MacMillan Press Ud., London (1992) . [0016] Particularmente compuestos preferidos de quitosan que pueden ser mencionados incluyen glutamato de quitosan (disponible como Protasan UPG213 de NovaMatrix, Drammen, Noruega) y otros compuestos de quitosan de viscosidad media (por ejemplo grados UPG113, UPCL213 y UPCL 113 también disponibles de NovaMatrix, Drammen, Noruega) . [0017] Como se apreciará, la cantidad de quitosan, una salo derivado del mismo o sal de un derivado del mismo presente en las composiciones de la presente invención dependerá, al menos hasta cierto punto, de factores tales como otros componantes presentes, su concentración y el modo pretendido de administración. Si la composición de la invención es en forma de una solución acuosa o suspensión, el quitosan, sal o derivado del mismo o sal de un derivado del mismo está preferiblemente presente en una cantidad de desde 0.25 a 3.0 %p/v, más preferiblemente de 0.35 a 2.5 %p/v, por ejemplo de 0.35 a 2.0 %p/v, desde 0.5 to 2.5 %p/v, desde 0.75 a 2.0 %p/v o desde 0.4 a 1 %p/v y más preferiblemente desde 0.45 a 1.5 %p/v expresado como base de quitosan. [0018] Preferiblemente, el quitosan usado en la presente invención tiene una carga positiva en solucion. [0019] El quitosan, salo derivado del mismo o sal de un derivado del mismo usado en la presente invención es preferentemente soluble en agua. Por el término "soluble en agua", queremos decir que el quitosan, salo derivados del mismo o sal de un derivado del mismo tiene una solubilidad de al menos 1 mg/ml y preferiblemente de al menos 10 mg/ml en agua a termperatura ambiente. [0020] Las composiciones de la presente invención comprenden un fosfato de poliol o fosfato de azúcar. Estos términos y los términos alternativos de sales de monofosfato dibásico de un poliol o un azúcar serán bien entendido por los expertos en la materia e incluyen, pero no están limitados a, todas las sales o derivados de fosfato de glicerol, sorbitol, xilitol, manitol, fructosa, glucosa, galactosa, ribosa, xilosa-, trehalosa, sacarosa o mezclas de los mismos. Preferiblemente, se usa una sal o derivado de glicerol, sorbitol, fructosa o glucosa. Más preferiblemente, se usa una salo derivado de glicerol. [0021] Preferiblemente, el fosfato de poliol es l3-glicerofosfato o glicerol-2-fosfato y más preferiblemente glicerofosfato disódico 13 es usado en la presente invención. [0022] Como se apreciará, la cantidad de sal fosfato de poliol o fosfato de azúcar presente en las composicions de la presente invención dependerá, al menos hasta un punto, de factores tales como los otros componantes presentes, su concentración y el modo pretendido de administración. Si la composición final de la invención es en forma de una solución acuosa o suspensión, preferiblemente contiene desde 0.25 hasta 3.0 % p/v, más... [Seguir leyendo]
Reivindicaciones:
1. Una composición de suministro de medicamento nasal u ocular en forma de una solución acuosa o suspensión para suministro de un agente terapéutico por una superficie mucosal ocular o nasal en la circulación sistematica que comprende:
(i) quitosan, una sal del mismo o derivado del mismo que ha sido formado por unión de grupos acilo
(ii) un sal de fosfato de poliol o fosfato de azúcar;
(iii) citrato de trietilo como un plastificante; y
(iv) un agente terapéutico que actúa sistémicamente.
2. Una composición de acuerdo a la Reivindicación 1 para suministro nasal.
3. Una composición de acuerdo a la Reivindicación 1 o 2, donde la sal fosfato de poliol es 13 glicerofosfato disódico.
4. Una composición de acuerdo a cualquiera de las Reivindicaciones precedentes, en donde el quitosan, sal del mismo o derivado del mismo o una sal de un derivado del mismo tiene un peso molecular de 4000 Dalton o mayor.
5. Una composición de acuerdo a la Reivindicación 4, en donde el quitosan, sal del mismo o derivado del mismo o sal de un derivado del mismo, tiene un peso molecular de desde 50, 000 hasta 300, 000 Dalton.
6. Una composición de acuerdo a cualquiera de las Reivindicaciones precedentes, que comprende base de quitosan o una sal nitrato, fosfato, sulfato, citrato, hidrocloruro, glutamato, lactato o acetato de quitosan.
7. Una composición de acuerdo a cualquiera de las Reivindicaciones precedentes, en donde el quitosan tiene un grado de desacetilación del 40% o mayor.
8. Una composición de acuerdo a la Reivindicación 7, en donde el grado de desacetilación es desde 70 a 90%.
9. Una composición de acuerdo a las Reivindicaciónes precedentes que comprende desde 0.25 a 3.0% p/v de quitosan, una salo un derivado del mismo o una sal de un derivado del mismo expresado como base de quitosan.
10. Una composición de acuerdo a la Reivindicación 9 que comprende desde 0.45 a 1.5 %p/v de quitosan, una salo un derivado del mismo o una sal de un derivado del mismo expresado como base de quitosan.
11. Una composición de acuerdo a cualquiera ge las Reivindicaciones precendentes, en donde la sal fosfato de poliol o fosfato de azúcar está presente en una cantidad desde 0.25 a 3.0 % p/v.
12. Una composición de acuerdo a la Reivindicación 11, en donde la sal fosfato de poliol o fosfato de azúcar está presente en una cantidad desde 0.75 a 2.0 % p/v.
13. Una composición de acuerdo a cualquiera de las Reivindicaciónes precedentes que comprende desde
0.05 a 5.0 % p/v de citrato de tietrilo.
14. Una composición como reivindicado en la Reivindicación 13 que comprende desde 0.2 hasta 1.0 % p/v de citrato de tietrilo.
15. Una composición de acuerdo a cualquiera de las Reivindicaciónes precedentes que comprende adicionalmente ácido ascórbico. .
16. Una composición de acuerdo a la Reivindicación 15 que comprende desde 0.01 a 0.2 % p/v de ácido ascórbico.
17. Una composición de acuerdo a cualquiera de las Reivindicaciones precedentes, en donde el agente terapéutico es un medicamento polar, un gen o un constructo de gen.
18. Una composición de acuerdo a la Reivindicación 17, en donde el agente terapéutico es insulina, calcitonina, leuprolida, hormona liberadora de hormona luteinizante, hormona de crecimiento o una hormona liberadora de hormona de crecimiento, naratriptan, sumatriptan, zolmitriptan, rizatriptan, eletriptan, frovatriptan, alnitidan, avitriptan, almotriptan, apomorfine, sildenafil, alprostadil, diamorfine, hidromorfona, buprenorfina, fentanil, oxicodona, codeína, morfina o morfina-6-glucuronida.
19. Un dispositivo de suministro de medicamento adecuado para suministro por medio de uno o más de las vias nasales u oculares o un cartucho de dosis para usar con tal dispositivo cargado con una composición como se defina en cualquiera de las Reivindicaciones precedentes.
20. Un proceso para la preparación de la composición como se defina en cualquiera de las Reivindicaciónes 1 a 18, cuyo proceso comprendel mezclar una solución que comprende quitosan o una sal del mismo o derivado del mismo o una sal de un derivado del mismo con una solución que comprende una sal fosfato de poliol o fosfato de azúcar.
21. El uso de la combinación de quitosan o una sal del mismo o derivado del mismo que ha sido formado
por unión de grupos acilo o alquilo con los grupos hidroxilo del quitosan o una sal de tal derivado del mismo, una sal fosfato de poliol o fosfato de azúcar y citrato de trietilo como un plastificante en la fabricación de un medicamento para suministro nasal u ocular de un agente terapéutico actuando sistémicamente.
8..,
'"
~
..... ~
m
-•:1 -:J
E E
.... ....
t2 t2
+ +
-.
J;
•A 8.
.....
e
-..... ..
2 '. RS 1: .Rll~+el
Q--.... .~....II
Patentes similares o relacionadas:
Regímenes de dosificación de buprenorfina, del 1 de Julio de 2020, de Indivior UK Limited: Buprenorfina para su uso en un método para tratar el trastorno por uso de opioides en un ser humano que lo necesite, que comprende las etapas […]
 Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Pulverizador de buprenorfina sublingual, del 22 de Abril de 2020, de Fresh Cut Development, LLC: Una formulación de pulverización sublingual que comprende una cantidad efectiva de buprenorfina, o una sal farmacéuticamente aceptable de la misma, […]
Dispositivos de administración transdérmica resistentes al abuso y composiciones que comprenden un agonista de opioides y un derivado N-óxido no administrado por vía transdérmica de un antagonista de opioide para el tratamiento del dolor, del 22 de Abril de 2020, de EURO-CELTIQUE S.A.: Un dispositivo de administración transdérmica que comprende una composición farmacéutica, en el que dicha composición comprende un derivado […]
Formulación farmacéutica a base de ibuprofeno y codeína que tiene estabilidad mejorada, del 15 de Abril de 2020, de FARMASIERRA MANUFACTURING S.L: Formulación farmacéutica a base de ibuprofeno y codeínade estabilidad mejorada. La invención consiste en una nueva formulación farmacéuticaen forma […]
Parche transdérmico de oximorfona, del 8 de Abril de 2020, de Buzzz Pharmaceuticals Limited: Un parche transdérmico que tiene una capa que contiene el fármaco que comprende oximorfona o una sal farmacéuticamente aceptable de la misma, […]
Composiciones de buprenorfina y antagonistas del receptor de opioides mu, del 1 de Abril de 2020, de Alkermes Pharma Ireland Limited: Una composición que comprende buprenorfina y un antagonista del receptor opioide μ, en donde la composición está caracterizada por un Índice […]