COMBINACION ANALGESICA DE ANALGESICO OPIOIDE E INHIBIDOR DE LA CICLOOXIGENASA-2.
Composición farmacéutica que comprende una combinación analgésicamente eficaz,
la cual comprende
a) por lo menos un inhibidor de la COX-2 y/o una sal del mismo farmacéuticamente aceptable y
b) por lo menos un analgésico opioide y/o una sal del mismo farmacéuticamente aceptable,
en la que dicho inhibidor de la COX-2 se selecciona del grupo consistente en celecoxib, 5-bromo-2-(4-fluorofenil)-3-[4-(metilsufonil)fenil] tiofeno, flosulida, meloxicam, rofecoxib, ácido 6-metoxi-2 naftilacético, nimesulida, N-[2-(ciclohexiloxi)-4-nitrofenil] metanosulfonamida, 1-fluoro-4-[2-[4-(metilsufonil)fenil]-1-ciclopenten-1-il] benceno, 5-(4-fluorofenil)-1-[4-(metilsufonil)fenil]-3-trifluorometil 1H-pirazol, N-[3-(formilamino)-4-oxo-6-fenoxi-4H-1-benzopiran-7-il] metanosulfonamida, mezclas de los mismos, y sales de los mismos farmacéuticamente aceptables, y
en donde dicho analgésico opioide se selecciona del grupo consistente en alfentanilo, alilprodina, alfaprodina, anileridina, bencilmorfina, becitramida, buprenorfina, butorfanol, clonitaceno, ciclazocina, desomorfina, dextromoramida, dezocina, diampromida, diamorfona, dihidrocodeína, dihidromorfina, dimenoxadol, dimefeptanol, dimetiltiambuteno, butirato de dioxafetilo, dipipanona, eptazocina, etoheptacina, etilmetiltiambuteno, etilmorfina, etonitaceno, fentanilo, heroína, hidromorfona, hidroxipetidina, isometadona, cetobemidona, levalorfano, levorfanol, levofenacilmorfano, lofentanilo, meperidina, meptacinol, metazocina, metadona, metopón, morfina, mirofina, nalbufina, narceína, nicomorfina, norlevorfanol, normetadona, nalorfina, normorfina, norpipanona, opio, oxicodona, oximorfona, papaveretum, pentazocina, fenadoxona, fenomorfano, fenazocina, fenoperidina, piminodina, piritramida, proheptacina, promedol, properidina, propiram, propoxifeno, sufentanilo, tilidina, tramadol, sales de los mismos; complejos de los mismos; y mezclas de cualquiera de los anteriores
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E04027114.
Solicitante: EURO-CELTIQUE S.A..
Nacionalidad solicitante: Luxemburgo.
Dirección: 122 BOULEVARD DE LA PETRUSSE,2330 LUXEMBOURG.
Inventor/es: GOLDENHEIM, PAUL, D., BURCH, RONALD, M., SACKLER, RICHARD, S..
Fecha de Publicación: .
Fecha Solicitud PCT: 17 de Septiembre de 1998.
Fecha Concesión Europea: 31 de Marzo de 2010.
Clasificación Internacional de Patentes:
- A61K31/485 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Derivados del morfinano, p. ej. morfina, codeína.
- A61K31/54 A61K 31/00 […] › que tienen ciclos con seis eslabones con al menos un nitrógeno y al menos un azufre como heteroátomos de un ciclo, p. ej. sultiam.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
Clasificación PCT:
- A61K31/485 A61K 31/00 […] › Derivados del morfinano, p. ej. morfina, codeína.
- A61K45/06 A61K 45/00 […] › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61P25/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del sistema nervioso.
Clasificación antigua:
- A61K31/485 A61K 31/00 […] › Derivados del morfinano, p. ej. morfina, codeína.
- A61P25/00 A61P […] › Medicamentos para el tratamiento de trastornos del sistema nervioso.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
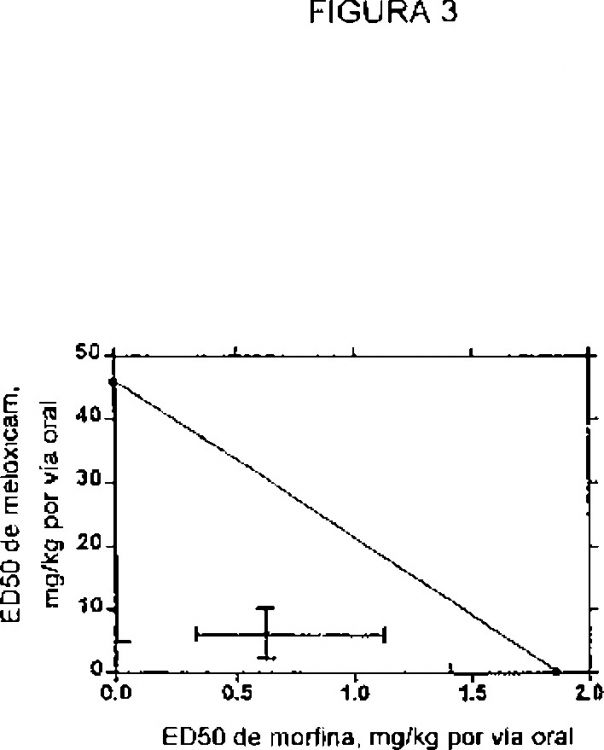
Fragmento de la descripción:
Combinación analgésica de analgésico opioide e inhibidor de la ciclooxigenasa-2.
Campo de la invención
La presente invención se refiere a composiciones farmacéuticas analgésicas que contienen un analgésico opioide y un inhibidor de la ciclooxigenasa-2 (COX-2). La memoria descriptiva expone también un tratamiento del dolor que comprende administrar dichas composiciones farmacéuticas a pacientes humanos.
Antecedentes de la invención
Existe una necesidad continuada de medicaciones analgésicas capaces de proporcionar un alivio del dolor altamente eficaz y que al mismo tiempo reduzcan la posibilidad de efectos no deseables. Los fármacos antiinflamatorios no esteroideos ("AINE"), entre los que se incluyen compuestos tales como ibuprofeno, ketoprofeno y diclofenaco, presentan acciones antiinflamatorias y son eficaces sobre el dolor asociado a la liberación de prostaglandinas y otros mediadores de la inflamación. Por ejemplo, se considera que el diclofenaco es extremadamente potente y eficaz como analgésico y agente antiinflamatorio. El diclofenaco está aprobado en los Estados Unidos para el tratamiento sintomático a largo plazo de artritis reumatoide, osteoartritis y espondilitis anquilosante. También se considera que es útil para el tratamiento a corto plazo de lesiones musculoesqueléticas agudas, dolor agudo de hombro, dolor postoperatorio y dismenorrea. No obstante, los AINE tales como el diclofenaco producen efectos secundarios en aproximadamente el 20% de pacientes que requieren la interrupción de la medicación. Los efectos secundarios incluyen, por ejemplo, hemorragia gastrointestinal y la elevación anormal de las enzimas hepáticas.
Los opioides son un grupo de fármacos, tanto naturales como sintéticos, que se utilizan principalmente como analgésicos de acción central y en cuanto a sus propiedades son del tipo morfina u opio (Gilman et al., 1980, GOODMAN AND GILMAN'S. THE PHARMACOLOGICAL BASIS OF THERAPEUTICS, Capítulo 24:494-534, Pub. Pergamon Press; incorporada a la presente a título de referencia). Los opioides incluyen morfina y homólogos de tipo morfina, incluyendo, por ejemplo, los derivados semisintéticos codeína (metilmorfina) e hidrocodona (dihidrocodeinona) entre muchos otros derivados de este tipo. La morfina y los opioides relacionados presentan una actividad agonista en los receptores opioides µ (mu) del sistema nervioso central o SNC (en referencia al cerebro y al cordón espinal) al mismo tiempo que muestran afinidad por los receptores opioides d y ?, para producir una gama de efectos que incluyen analgesia, somnolencia, cambios de humor y turbación mental. Además de los potentes efectos analgésicos, los opioides relacionados con la morfina también pueden provocar una serie de efectos no deseables, entre los que se incluyen, por ejemplo, depresión respiratoria, náusea, vómito, mareo, turbación mental, disforia, prurito, estreñimiento, aumento de la presión en las vías biliares, retención urinaria e hipotensión. El desarrollo de tolerancia a los fármacos opioides y el riesgo de dependencia química y de abuso de estos fármacos es otro de los efectos no deseables.
La morfina, que ha sido considerada el analgésico opioide prototípico, ha estado disponible en muchas formas de dosificación, incluyendo formas de dosificación oral de liberación inmediata, y más recientemente, se ha formulado en formulaciones de liberación controlada de 12 horas (por ejemplo, comprimidos MS Contin®, disponibles comercialmente en Purdue Frederick Company). Otros analgésicos opioides han estado disponibles como formas de dosificación oral de liberación inmediata, tales como hidromorfona (por ejemplo, Dilaudid®, disponible comercialmente en Knoll Pharmaceuticals). Más recientemente, ha resultado disponible otro analgésico opioide de liberación controlada, la oxicodona (OxyContin®, disponible comercialmente en Purdue Pharma). Evidentemente, existen muchas otras formulaciones orales de opioides de liberación inmediata y de liberación sostenida que están disponibles comercialmente en todo el mundo.
Publicaciones anteriores informan que el poder analgésico se puede mejorar, al mismo tiempo que se reducen los efectos no deseables, mediante la combinación de un opioide con un AINE o un analgésico tal como ácido acetilsalicílico o acetaminofén, de tal manera que se obtiene un efecto analgésico sinérgico que permite una reducción de la dosis total tanto del AINE como del analgésico. Por ejemplo, la patente U.S. número 4.569.937, concedida a Baker et al. el 11 de Febrero de 1986, describe una combinación de oxicodona con ibuprofeno en una relación de oxicodona/ibuprofeno de entre 1:6 y aproximadamente 1:400. La patente U.S. número 4.690.927, concedida a Voss et al. el 1 de Septiembre de 1987, describe una combinación del AINE diclofenaco y codeína en una relación de pesos del diclofenaco con respecto a la codeína de entre aproximadamente 1:1 y aproximadamente 3:1. La patente U.S. número 5.190.947, concedida a Riess et al. el 2 de Marzo de 1993, describe una sal de diclofenaco-codeína (ácido [2-[2,6-diclorofenil)-amino]-fenil]-acético). La patente U.S. número 4.844.907, concedida a Elger et al. el 4 de Julio de 1989, describe un comprimido de múltiples fases que combina una fase analgésica narcótica y una fase AINE en capas separadas. La patente U.S. número 4.587.252, concedida a Arnold et al. el 6 de Mayo de 1986, describe un proceso para el tratamiento del dolor usando una combinación de hidrocodona e ibuprofeno.
Los fármacos antiinflamatorios no esteroideos (AINE) ejercen la mayor parte de su actividad antiinflamatoria, analgésica y antipirética e inhiben las contracciones uterinas inducidas por hormonas y ciertos tipos de crecimiento de cáncer a través de la inhibición de la prostaglandina G/H sintasa, conocida también como ciclooxigenasa.
La ciclooxigenasa (COX) de ácido graso se describió como la fuente de las prostaglandinas, tromboxanos, y una variedad de otros metabolitos hidroxilados biológicamente activos derivados del ácido araquidónico y ácidos grasos no saturados superiores. Comenzando a finales de los años 60, B. Sammuelsson, S. Bergstrom y sus colegas descubrieron la actividad biológica y dilucidaron las estructuras de los productos de la ciclooxigenasa. A finales de los 60 y a principios de los 70, J. Vane descubrió que la aspirina y otros AINE ejercen sus principales actividades biológicas mediante la inhibición de la ciclooxigenasa. La COX es responsable directamente de la formación de PGG y PGH y éstas sirven como los intermediarios en las síntesis del PGD, PGE, PGF, PGI y TXA. A finales de los 70 y a principios de los 80, se observó que muchas hormonas y otros agentes biológicamente activos podían regular la actividad celular de la COX. Al principio, se consideró que la inducción de la COX era simplemente el resultado de la inactivación oxidativa de la COX, lo cual ocurre después de solamente unos pocos reemplazos de substratos. Esta situación es habitual entre enzimas que incorporan oxígeno molecular a sus substratos - el oxígeno degrada rápidamente la enzima. A dichas enzimas se les hace referencia ocasionalmente como enzimas suicidas. En respuesta a la rápida (en segundos) inactivación de la ciclooxigenasa, su mensaje es transcrito, y la enzima es inducida rápidamente a sustituir dicha pérdida debido a la catálisis. Varios grupos observaron que la ciclooxigenasa era inducida en un grado mucho mayor que el necesario para sustituir la enzima perdida. Usando un oligonucleótido dirigido a la enzima COX-1 clonada, se identificó, en transferencias Northern (Northern blots), una segunda banda en condiciones de baja rigurosidad. Este gen se clonó y se identificó como una segunda enzima COX, denominada COX-2, y se observó que estaba en gran medida ausente de muchas células en condiciones basales aunque era inducida rápidamente por varias citoquinas y neurotransmisores. Se observó que la expresión de esta enzima era en gran medida responsable de la actividad COX en exceso observada previamente en células activadas. Los genes para la COX-1 y la COX-2 son distintos, siendo el gen para la COX-1 22 kb y el tamaño del mensaje 2,8 kb mientras que el gen para la COX-2 es 8,3 kb y el tamaño del mensaje 4,1 kb. Mientras que el promotor de la COX-1 no contiene sitios de unión de factores de transcripción reconocidos, el promotor de la COX-2 contiene sitios para el NF-?B, AP-2, NF-IL-6 y glucocorticoides (H.R. Herschman, Canc. Metas. Rev. 13:256, 1994). Existen algunas diferencias en los sitios activos de las enzimas. La aspirina inhibe la actividad ciclooxigenasa de la COX-1 aunque deja intacta su actividad...
Reivindicaciones:
1. Composición farmacéutica que comprende una combinación analgésicamente eficaz, la cual comprende
en la que dicho inhibidor de la COX-2 se selecciona del grupo consistente en celecoxib, 5-bromo-2-(4-fluorofenil)-3-[4-(metilsufonil)fenil] tiofeno, flosulida, meloxicam, rofecoxib, ácido 6-metoxi-2 naftilacético, nimesulida, N-[2-(ciclohexiloxi)-4-nitrofenil] metanosulfonamida, 1-fluoro-4-[2-[4-(metilsufonil)fenil]-1-ciclopenten-1-il] benceno, 5-(4-fluorofenil)-1-[4-(metilsufonil)fenil]-3-trifluorometil 1H-pirazol, N-[3-(formilamino)-4-oxo-6-fenoxi-4H-1-benzopiran-7-il] metanosulfonamida, mezclas de los mismos, y sales de los mismos farmacéuticamente aceptables, y
en donde dicho analgésico opioide se selecciona del grupo consistente en alfentanilo, alilprodina, alfaprodina, anileridina, bencilmorfina, becitramida, buprenorfina, butorfanol, clonitaceno, ciclazocina, desomorfina, dextromoramida, dezocina, diampromida, diamorfona, dihidrocodeína, dihidromorfina, dimenoxadol, dimefeptanol, dimetiltiambuteno, butirato de dioxafetilo, dipipanona, eptazocina, etoheptacina, etilmetiltiambuteno, etilmorfina, etonitaceno, fentanilo, heroína, hidromorfona, hidroxipetidina, isometadona, cetobemidona, levalorfano, levorfanol, levofenacilmorfano, lofentanilo, meperidina, meptacinol, metazocina, metadona, metopón, morfina, mirofina, nalbufina, narceína, nicomorfina, norlevorfanol, normetadona, nalorfina, normorfina, norpipanona, opio, oxicodona, oximorfona, papaveretum, pentazocina, fenadoxona, fenomorfano, fenazocina, fenoperidina, piminodina, piritramida, proheptacina, promedol, properidina, propiram, propoxifeno, sufentanilo, tilidina, tramadol, sales de los mismos; complejos de los mismos; y mezclas de cualquiera de los anteriores.
2. Composición farmacéutica según la reivindicación 1, en la que se logra un efecto analgésico que es por lo menos aproximadamente 5 veces mayor que el obtenido con la dosis de dicho analgésico opioide solo.
3. Composición farmacéutica según las reivindicaciones 1 ó 2, en la que la dosis de dicho analgésico opioide no estaría en una cantidad eficaz para proporcionar un efecto analgésico, si se administrase sin dicho inhibidor de la COX-2.
4. Composición farmacéutica según cualquiera de las reivindicaciones 1 a 3, en la que dicho analgésico opioide y dicho inhibidor de la COX-2 se administran oralmente, vía implante, parenteralmente, sublingualmente, rectalmente, vía tópica, o vía inhalación.
5. Composición farmacéutica según cualquiera de las reivindicaciones 1 a 4, en la que dicho analgésico opioide se selecciona del grupo consistente en agonistas mu, agonistas kappa, antagonistas/agonistas mu mezclados, combinaciones antagonistas mu, sales de los mismos; complejos de los mismos; y mezclas de los mismos.
6. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, en forma de un comprimido; una formulación multipartícula para administración oral; una solución, suspensión o elixir para administración oral; una formulación inyectable; un dispositivo implantable; una preparación tópica; un supositorio; un comprimido bucal; o una formulación de inhalación.
7. Composición farmacéutica según cualquiera de las reivindicaciones 1 a 3 y 5, que es una forma de dosificación oral, sólida, formulada como un comprimido o una cápsula.
8. Composición farmacéutica según la reivindicación 1, 2, y 4 a 7, que comprende dicho inhibidor de la COX-2 en una cantidad suficiente para proporcionar un efecto terapéutico junto con una dosis de codeína que es analgésica si se administra sin el inhibidor de la COX-2.
9. Composición farmacéutica según la reivindicación 8, en la que la dosis de codeína está entre 30 y 400 mg.
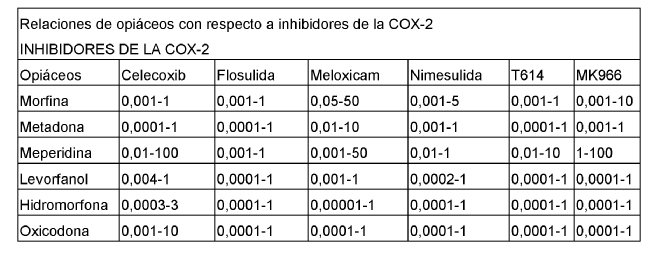
10. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, en la que dicho analgésico opioide se selecciona del grupo consistente en morfina, metadona, mepiredina, levorfanol, hidromorfona, oxicodona, hidrocodona, codeína, y sales de los mismos farmacéuticamente aceptables, y dicho inhibidor de la COX-2 se selecciona del grupo consistente en celecoxib, flosulida, meloxicam, nimesulida, N-[3-formilamino)-4-oxo-6-fenoxi-4H-1-benzopiran-7-il] metanosulfonamida, rofecoxib, y sales de los mismos farmacéuticamente aceptables, en las relaciones y/o cantidades equivalentes de las sales de los mismos farmacéuticamente aceptables, según se expone en la Tabla I:
11. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, en la que la dosis de dicho inhibidor de la COX-2 potencia de forma sinérgica el efecto de dicho analgésico opioide, aunque la dosis de analgésico opioide no parece potenciar significativamente el efecto del inhibidor de la COX-2.
12. Composición farmacéutica según la reivindicación 7, en la que la forma de dosificación oral, sólida, incluye un vehículo de liberación sostenida.
13. Uso de una combinación analgésicamente eficaz en la elaboración de una preparación farmacéutica para el tratamiento del dolor, comprendiendo dicha combinación
en la que dicho inhibidor de la COX-2 se selecciona del grupo consistente en celecoxib, 5-bromo-2-(4-fluorofenil)-3-[4-(metilsufonil)fenil] tiofeno, flosulida, meloxicam, rofecoxib, ácido 6-metoxi-2 naftilacético, nimesulida, N-[2-(ciclohexiloxi)-4-nitrofenil] metanosulfonamida, 1-fluoro-4-[2-[4-(metilsufonil)fenil]-1-ciclopenten-1-il] benceno, 5-(4-fluorofenil)-1-[4-(metilsufonil)fenil]-3-trifluorometil 1H-pirazol, N-[3-(formilamino)-4-oxo-6-fenoxi-4H-1-benzopiran-7-il] metanosulfonamida, mezclas de los mismos, y sales de los mismos farmacéuticamente aceptables, y
en donde dicho analgésico opioide se selecciona del grupo consistente en alfentanilo, alilprodina, alfaprodina, anileridina, bencilmorfina, becitramida, buprenorfina, butorfanol, clonitaceno, ciclazocina, desomorfina, dextromoramida, dezocina, diampromida, diamorfona, dihidrocodeína, dihidromorfina, dimenoxadol, dimefeptanol, dimetiltiambuteno, butirato de dioxafetilo, dipipanona, eptazocina, etoheptacina, etilmetiltiambuteno, etilmorfina, etonitaceno, fentanilo, heroína, hidromorfona, hidroxipetidina, isometadona, cetobemidona, levalorfano, levorfanol, levofenacilmorfano, lofentanilo, meperidina, meptacinol, metazocina, metadona, metopón, morfina, mirofina, nalbufina, narceína, nicomorfina, norlevorfanol, normetadona, nalorfina, normorfina, norpipanona, opio, oxicodona, oximorfona, papaveretum, pentazocina, fenadoxona, fenomorfano, fenazocina, fenoperidina, piminodina, piritramida, proheptacina, promedol, properidina, propiram, propoxifeno, sufentanilo, tilidina, tramadol, sales de los mismos; complejos de los mismos; y mezclas de cualquiera de los anteriores.
14. Uso según la reivindicación 13, en el que dicha combinación proporciona un efecto analgésico que es por lo menos aproximadamente 5 veces mayor que el obtenido con la dosis de dicho analgésico opioide solo.
15. Uso según la reivindicación 13 ó 14, en el que dicha preparación farmacéutica se proporciona para ser administrada oralmente.
16. Uso según cualquiera de las reivindicaciones 13 a 15, en el que dicha preparación farmacéutica se administra en una forma de dosificación oral individual.
17. Uso según la reivindicación 16, en el que dicha forma individual de dosificación oral incluye un vehículo de liberación sostenida.
18. Uso según cualquiera de las reivindicaciones 13 a 17, en el que la dosis de dicho analgésico opioide no estaría en una cantidad eficaz para proporcionar un efecto analgésico si se administrase sin la dosis de dicho inhibidor de la COX-2.
19. Uso según cualquiera de las reivindicaciones 13 a 17, en el que la dosis de dicho analgésico opioide es eficaz para proporcionar analgesia por sí solo, aunque la dosis de opioide proporciona por lo menos un efecto analgésico cinco veces mayor que el obtenido con la dosis de opioide solo.
20. Uso según cualquiera de las reivindicaciones 13 a 19, en el que dicho inhibidor de la COX-2 se administra antes de, simultáneamente con, o después de la administración de dicho analgésico opioide, de tal manera que el intervalo de dosificación del inhibidor de la COX-2 se solapa con el intervalo de dosificación del analgésico opioide.
21. Uso según cualquiera de las reivindicaciones 13 a 19, en el que se reduce la cantidad de opioide requerida para tratar un paciente afectado con dolor, que comprende administrar conjuntamente con dicho analgésico opioide una cantidad eficaz de un inhibidor de la COX-2, para aumentar la analgesia atribuible a dicho analgésico opioide durante por lo menos una parte del intervalo de dosificación de dicho analgésico opioide.
22. Uso según cualquiera de las reivindicaciones 13 a 19, en el que se reduce la cantidad de un inhibidor de la COX-2 requerida para tratar un paciente afectado con dolor, que comprende administrar conjuntamente con dicho inhibidor de la COX-2 una cantidad eficaz de un analgésico opioide, para aumentar la analgesia atribuible a dicho inhibidor de la COX-2 durante por lo menos una parte del intervalo de dosificación de dicho inhibidor de la COX-2.
Patentes similares o relacionadas:
Regímenes de dosificación de buprenorfina, del 1 de Julio de 2020, de Indivior UK Limited: Buprenorfina para su uso en un método para tratar el trastorno por uso de opioides en un ser humano que lo necesite, que comprende las etapas […]
 Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Pulverizador de buprenorfina sublingual, del 22 de Abril de 2020, de Fresh Cut Development, LLC: Una formulación de pulverización sublingual que comprende una cantidad efectiva de buprenorfina, o una sal farmacéuticamente aceptable de la misma, […]
Dispositivos de administración transdérmica resistentes al abuso y composiciones que comprenden un agonista de opioides y un derivado N-óxido no administrado por vía transdérmica de un antagonista de opioide para el tratamiento del dolor, del 22 de Abril de 2020, de EURO-CELTIQUE S.A.: Un dispositivo de administración transdérmica que comprende una composición farmacéutica, en el que dicha composición comprende un derivado […]
Formulación farmacéutica a base de ibuprofeno y codeína que tiene estabilidad mejorada, del 15 de Abril de 2020, de FARMASIERRA MANUFACTURING S.L: Formulación farmacéutica a base de ibuprofeno y codeínade estabilidad mejorada. La invención consiste en una nueva formulación farmacéuticaen forma […]
Parche transdérmico de oximorfona, del 8 de Abril de 2020, de Buzzz Pharmaceuticals Limited: Un parche transdérmico que tiene una capa que contiene el fármaco que comprende oximorfona o una sal farmacéuticamente aceptable de la misma, […]
Composiciones de buprenorfina y antagonistas del receptor de opioides mu, del 1 de Abril de 2020, de Alkermes Pharma Ireland Limited: Una composición que comprende buprenorfina y un antagonista del receptor opioide μ, en donde la composición está caracterizada por un Índice […]