Celda de batería electroquímica.
Procedimiento para la fabricación de una celda de batería electroquímica,
que presenta en una carcasa unelectrodo positivo y un electrodo negativo, que comprende una etapa de procedimiento en la que la carcasa se llenacon una solución electrolítica basada en SO2 con una sal conductora, comprendiendo el llenado con la soluciónelectrolítica las siguientes etapas parciales:
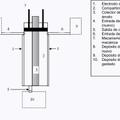
- El espacio interior de la carcasa se llena con SO2 gaseoso;
- un orificio de llenado de la carcasa se conecta de forma estanca a los gases con un recipiente, que contiene lasolución electrolítica con una parte de SO2, que está calculada de tal modo que el SO2 gaseoso se disuelva conavidez en la solución electrolítica; y
- la solución electrolítica se deja fluir en la carcasa, impulsada por la depresión que resulta por el proceso dedisolución.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10009875.
Solicitante: FORTU INTELLECTUAL PROPERTY AG.
Nacionalidad solicitante: Suiza.
Dirección: Hofstrasse 4 6060 Sarnen SUIZA.
Inventor/es: HAMBITZER, GUNTHER, BIOLLAZ,Heide, BORCK,Markus, RIPP,Christiane, ZINCK,Laurent.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- H01M10/0525 ELECTRICIDAD. › H01 ELEMENTOS ELECTRICOS BASICOS. › H01M PROCEDIMIENTOS O MEDIOS, p. ej. BATERÍAS, PARA LA CONVERSION DIRECTA DE LA ENERGIA QUIMICA EN ENERGIA ELECTRICA. › H01M 10/00 Células secundarias; Su fabricación. › Baterías de tipo "rocking-chair", es decir, baterías de inserción o intercalación de litio en ambos electrodos; Baterías de ión de litio.
- H01M10/056 H01M 10/00 […] › caracterizado por los materiales utilizados como electrolitos, p. ej. electrolitos mixtos inorgánico/orgánico.
- H01M10/0563 H01M 10/00 […] › Materiales líquidos, p. ej. para células de Li-SOCl 2.
- H01M2/36
PDF original: ES-2398345_T3.pdf
Fragmento de la descripción:
Celda de batería electroquímica La invención se refiere a un procedimiento para la fabricación de una celda de batería electroquímica con un electrodo negativo (cátodo) , un electrolito que contiene una sal conductora y un electrodo positivo (ánodo) . En particular, la invención se refiere a celdas de metal alcalino, en las que la masa activa es un metal alcalino, que durante la carga de la celda queda acumulado en el interior y/o en el exterior del electrodo negativo. No obstante, la masa activa también puede ser otro metal, en particular un metal alcalinotérreo, o un metal del segundo grupo del sistema periódico. La sal conductora del electrolito está formada por cationes del metal que forma la masa activa y aniones adecuados. En el caso de celdas de metal alcalino, como sal conductora se usa preferiblemente un tetrahaloaluminato de metal alcalino, por ejemplo LiAlCl4.
A continuación, a título de ejemplo, se hará referencia sobre todo a celdas de metal alcalino, en particular celdas de litio. No obstante, esto no ha de entenderse como limitación de la aplicabilidad general de la invención.
Lo típico de las celdas de este tipo es una estructura de varias capas dispuestas unas encima de las otras, cuyas medidas de superficie son mucho más grandes que su espesor. Tienen unas medidas de superficie aproximadamente iguales y están dispuestas en la celda a modo de sándwich unas encima de las otras. Son habituales celdas prismáticas con una carcasa que por regla general presenta una forma de paralelepípedo y capas rectas, así como celdas cilíndricas, en cuyo interior las capas están arrolladas en forma de rollos.
Las celdas habituales tienen al menos tres capas, es decir, el electrodo negativo, el electrodo positivo y un separador, que separa los electrodos eléctrica y mecánicamente. Debe cumplir objetivos difíciles:
- Debe asegurar la separación eléctrica entre el electrodo positivo y negativo, sin la que no es posible el servicio de una celda de batería.
- Debe contribuir a garantizar una distribución homogénea del electrolito líquido entre los electrodos.
- Debe garantizar una separación mecánica del compartimento anódico y catódico, aunque debe garantizar, por otro lado, tanto el transporte necesario de electrolito como un transporte de gas entre los dos compartimentos parciales de la celda.
- Debe impedir de forma fiable cortocircuitos entre los electrodos. Resulta un problema especial, cuando durante la carga de la celda el metal activo se precipita en la superficie de la misma.
El problema indicado en último lugar es especialmente crítico cuando la masa activa, en particular después de varios ciclos de carga y descarga, no se precipita como capa lisa con una superficie plana, sino como estructura en parte filiforme. En particular en el caso de celdas de metal alcalino, en particular de celdas de litio, se forman durante la carga de la celda hilos no ramificados (para una celda determinada con un electrolito determinado) con un diámetro sustancialmente igual, que crecen formando madejas y se denominan whisker. La formación de los whisker se debe a que en la superficie del metal activo reactivo se forma una capa de cubrición fina debido a una reacción de descarga espontánea, que no es completamente homogénea. Por lo tanto, el metal activo depositado por precipitación electrolítica crece preferiblemente en los puntos más finos atravesando la capa de cubrición y sigue creciendo posteriormente respectivamente en el extremo del hilo.
Gracias a la formación de estructuras filiformes, el separador se somete a una fuerte carga mecánica. Por otro lado, está limitada la elección de materiales adecuados por otros requisitos:
- El material separador debe ser inerte en la celda;
- debe ser lo más fino posible, para permitir una alta densidad de energía;
- los datos de potencia de la celda y su vida útil dependen entre otras cosas de la permeabilidad del separador para los iones del electrolito.
- los costes del separador deben ser razonables.
En las celdas de iones de litio y en las celdas de polímero de litio es especialmente importante un separador que funcione perfectamente. Si allí se precipita litio metálicamente en la superficie del electrodo negativo, el metal altamente reactivo no debe entrar bajo ningún concepto en contacto con el electrodo positivo, porque el cortocircuito que resultaría de un contacto de este tipo conduciría inmediatamente a una secuencia de reacciones fuera de control, que se denomina “thermal runaway”. La solución electrolítica orgánica de estas celdas se quemaría sin control o incluso haría explosión. Por estos riesgos, dichos tipos de celdas se fabrican por lo general sólo en formas constructivas relativamente pequeñas. Además, se toman medidas de seguridad adicionales, sobre todo de tipo electrónico.
En dichos tipos de celdas, el electrodo negativo está realizado habitualmente como el denominado “electrodo de inserción”. Este concepto se refiere en general a electrodos que contienen el metal activo de tal modo en su interior que está dispuesto a un intercambio con el electrolito durante la carga y descarga de la celda. En el caso de celdas de iones de litio y de las de polímero de litio, el electrodo negativo es un electrodo de inserción basado en grafito, en cuyo interior se absorben iones metálicos de la sal conductora durante la carga de la celda. A ser posible, la celda debe hacerse funcionar de tal modo que se eviten estados de servicio en los que se precipita metal activo en la superficie del electrodo. No obstante, en la práctica esto sólo se consigue con medidas electrónicas costosas, mediante las cuales se evita fiablemente una sobrecarga de la celda, así como una carga con intensidades de corriente relativamente elevadas (por encima de un valor límite válido para la celda correspondiente) . La electrónica debe ser extremadamente precisa (tensión de desconexión por ejemplo de 4, 2 V + 0, 01 V) y extremadamente fiable (como máximo un error por 100 millones de unidades) . Debido a medidas de este tipo, los costes aumentan sustancialmente. A pesar de ello, sigue habiendo determinados riesgos.
En el caso de celdas de batería electroquímicas recargables, en particular celdas de metal alcalino y sobre todo celdas de litio, debe conseguirse con el menor esfuerzo posible un estándar de seguridad lo más elevado posible, manteniéndose por completo las propiedades ventajosas del tipo de celda correspondiente (en el caso de las celdas de litio, en particular su elevada densidad de energía no superada) o incluso mejorándose estas propiedades.
Ante este panorama, la invención propone un procedimiento simple y efectivo para la fabricación de una celda de batería electroquímica con las características de la reivindicación 1.
En el documento DE 19911800 C1 está descrito un procedimiento y un dispositivo para el llenado de una celda electroquímica, con el que deben superarse los problemas especiales que van unidos, por ejemplo, a los electrolitos basados en SO2. Los electrolitos de este tipo representan sales solvatizadas, cuyo disolvente (SO2) es gaseoso a temperatura ambiente. Para superar los problemas especiales que van unidos a ello se propone un conjunto de aparatos complicado, en el que una cánula debe ir pasando por el orificio de entrada de la batería hasta los electrodos apilados. Debido a ello existe el peligro de que el extremo de cánula dañe los electrodos apilados y produzca un cortocircuito interno. Además una cánula fina de este tipo puede obstruirse fácilmente por sal conductora cristalizada. Para el llenado, se evacua el aire de la celda y después de conmutar una válvula, la solución electrolítica se aspira al interior de la celda. En este caso es un inconveniente la gran diferencia de presión entre la solución electrolítica y el interior de la celda. El disolvente (SO2) se evapora al principio de la solución electrolítica. De este modo aumenta adicionalmente el peligro de la cristalización de la sal conductora y, por lo tanto, de una obstrucción del dispositivo de llenado.
En comparación con esto, en el marco de la invención se propone un procedimiento sustancialmente más sencillo. El llenado de la solución electrolítica comprende aquí las siguientes etapas parciales:
- El espacio interior de la carcasa se llena con SO2 gaseoso;
- un orificio de llenado de la carcasa se conecta de forma estanca a gas con un recipiente, que contiene la solución electrolítica con una parte de SO2 que está calculada de tal modo que el SO2 gaseoso se disuelva con avidez en la solución electrolítica; y
- la solución electrolítica se deja fluir en la carcasa, impulsada... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la fabricación de una celda de batería electroquímica, que presenta en una carcasa un electrodo positivo y un electrodo negativo, que comprende una etapa de procedimiento en la que la carcasa se llena con una solución electrolítica basada en SO2 con una sal conductora, comprendiendo el llenado con la solución electrolítica las siguientes etapas parciales:
- El espacio interior de la carcasa se llena con SO2 gaseoso;
- un orificio de llenado de la carcasa se conecta de forma estanca a los gases con un recipiente, que contiene la solución electrolítica con una parte de SO2, que está calculada de tal modo que el SO2 gaseoso se disuelva con avidez en la solución electrolítica; y
- la solución electrolítica se deja fluir en la carcasa, impulsada por la depresión que resulta por el proceso de disolución.
2. Procedimiento según la reivindicación 1, en el que la sal conductora es LiAlCl4 y la parte de SO2 de la solución electrolítica corresponde como máximo a LiAlCl4 x 3, 5 SO2.
3. Procedimiento según una de las reivindicaciones anteriores, caracterizado porque una cantidad parcial de la sal conductora ya se encuentra en la celda cuando la solución electrolítica se introduce en la celda.
4. Procedimiento según una de las reivindicaciones anteriores, en el que, para una optimización de un electrodo se eliminan iones de hidróxido de su superficie, poniéndose en contacto un producto de limpieza, que contiene un primer componente de limpieza que reacciona con iones de hidróxido, de tal modo con el electrodo que los iones de hidróxido ligados al mismo se disuelven de la superficie del electrodo por reacción con el primer componente de limpieza y los componentes del producto de limpieza o los productos de limpieza que podrían destruir el funcionamiento de la celda son eliminados del electrodo.
5. Procedimiento según la reivindicación 4, en el que el primer componente de limpieza es un ácido de Lewis sin protones.
6. Procedimiento según la reivindicación 5, en el que el ácido de Lewis sin protones se elige del grupo formado por AIF3, BF3, CO2, CS2 y GaCl3.
7. Procedimiento según una de las reivindicaciones 4 a 6, en el que el electrodo es un electrodo de inserción, en particular un electrodo de intercalación.
8. Procedimiento según la reivindicación 7, en el que un producto de limpieza, que contiene un segundo componente de limpieza que reacciona con iones H+ se pone de tal modo en contacto con el electrodo de inserción que los iones H+ ligados en el mismo se extraen del electrodo gracias a la reacción con el componente.
9. Procedimiento según la reivindicación 8, en el que el segundo componente de limpieza es una sal que realiza una reacción de intercambio iónico con los iones H+ ligados al electrodo de inserción.
10. Procedimiento según la reivindicación 9, en el que la sal es un halogenuro, en particular un fluoruro de un metal alcalino, de un metal alcalinotérreo o de un elemento del tercer grupo principal del sistema periódico, en particular LiCl o LiF.
11. Procedimiento según una de las reivindicaciones anteriores, en el que el metal activo se elige del grupo formado por los metales alcalinos, los metales alcalinotérreos y los metales del segundo subgrupo del sistema periódico.
12. Procedimiento según la reivindicación 11, caracterizado porque el metal activo es litio, sodio, calcio, cinc o aluminio.
13. Procedimiento según una de las reivindicaciones anteriores, en el que el electrodo positivo contiene un óxido de metal.
14. Procedimiento según una de las reivindicaciones anteriores, en el que el electrodo positivo contiene un compuesto de intercalación.
15. Procedimiento según la reivindicación 14, en el que el electrodo positivo contiene un compuesto de intercalación con CoO2.
Patentes similares o relacionadas:
Batería híbrida y electrolizador, del 28 de Agosto de 2019, de TECHNISCHE UNIVERSITEIT DELFT: Un aparato de energia que tiene una funcionalidad de almacenamiento de energia electrica y una funcionalidad de electrolisis, comprendiendo el sistema una unidad […]
Junta de poste colector de corriente para celdas de iones de litio de alta durabilidad, del 16 de Enero de 2019, de Chang, Chun-Chieh: Conjunto de cubierta para un recipiente de una batería de iones de litio, que comprende: una cubierta para sellar una abertura superior de un recipiente […]
Procedimiento de obturación de un orificio de impregnación de un conjunto de almacenamiento de energía, del 20 de Septiembre de 2018, de Blue Solutions: Procedimiento de obturación de un orificio de impregnación de un conjunto de almacenamiento de energía, comprendiendo el conjunto una caja […]
 Pilas de combustible de metal-aire y métodos para retirar combustible gastado de las mismas, del 25 de Abril de 2018, de Phinergy Ltd: Un método para retirar o reducir la concentración de combustible gastado sólido o semisólido de una pila o batería de combustible de metal-aire, comprendiendo […]
Pilas de combustible de metal-aire y métodos para retirar combustible gastado de las mismas, del 25 de Abril de 2018, de Phinergy Ltd: Un método para retirar o reducir la concentración de combustible gastado sólido o semisólido de una pila o batería de combustible de metal-aire, comprendiendo […]
Procedimiento de fabricación de una placa bipolar para una batería de plomo-ácido, del 1 de Marzo de 2017, de East Penn Manufacturing Co: Un procedimiento de fabricación de una placa de batería bipolar para una batería bipolar, comprendiendo dicho procedimiento: proporcionar […]
Procedimiento para llenar celdas electroquímicas, del 21 de Diciembre de 2016, de FRAUNHOFER-GESELLSCHAFT ZUR FORDERUNG DER ANGEWANDTEN FORSCHUNG E.V.: Procedimiento para llenar una bolsa de lámina de batería o de acumulador con líquido y sellar esta bolsa, que comprende los pasos: (a) proporcionar una bolsa de lámina […]
Batería de forma plana, del 30 de Noviembre de 2016, de HITACHI MAXELL, LTD.: Una batería de forma plana que comprende: una carcasa exterior que tiene una abertura en su extremo superior; una junta de estanquidad […]
Tapa para baterías para prevenir la fuga de electrolitos, del 25 de Mayo de 2016, de Global Battery Co., Ltd: Una tapa de la batería para evitar fugas de electrolito, que comprende una tapa inferior herméticamente asentada en un extremo superior de una caja […]