BIOMOLÉCULA(S) DE DIAGNÓSTICO.
Un procedimiento para detectar o cuantificar la presencia de, o predisposición a, o gravedad de o pronosticar el resultado de cáncer de ovario en un sujeto o seleccionar al menos un candidato para ensayo o ensayos clínicos, experimentación o ensayo de diagnóstico para cáncer de ovario o indicar la eficacia del tratamiento, comprendiendo el procedimiento:
(a) determinar en al menos una muestra de fluido quístico obtenida de un sujeto, la expresión de proteína haptoglobina; y (b) comparar la expresión de la proteína haptoglobina con la de un control, indicando una diferencia en la expresión la presencia de, predisposición a, gravedad de o pronostico del resultado de cáncer de ovario en el sujeto o la adecuación del sujeto como un candidato o indicación de la eficacia del tratamiento
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/SG2007/000264.
Solicitante: NATIONAL UNIVERSITY OF SINGAPORE.
Nacionalidad solicitante: Singapur.
Dirección: 21 LOWER KENT RIDGE ROAD SINGAPORE 119077 SINGAPUR.
Inventor/es: CHOOLANI,Mahesh Arjandas, JABARULLAH KHAN,Khalil Razvi,B.,M, ANNAMALAI,Loganath, BISWAS,Arijit, ZHAO,Changqing.
Fecha de Publicación: .
Fecha Solicitud PCT: 20 de Agosto de 2007.
Clasificación Internacional de Patentes:
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
Clasificación PCT:
- G01N33/50 G01N 33/00 […] › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/53 G01N 33/00 […] › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
- G01N33/574 G01N 33/00 […] › para el cáncer.
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2362121_T3.pdf





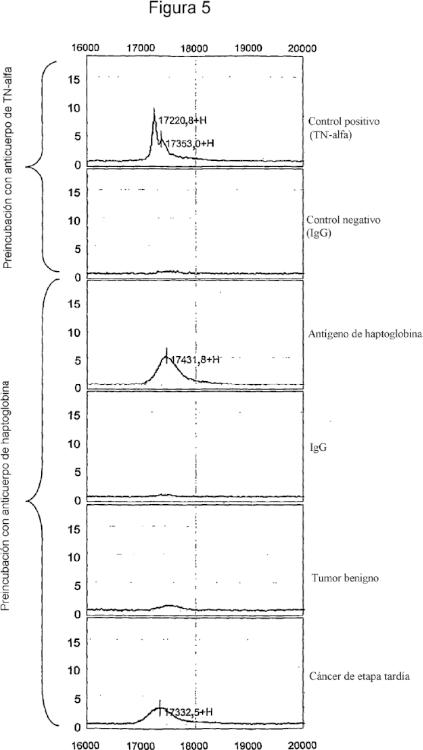
Fragmento de la descripción:
Campo de la Invención
La presente invención se refiere a proteína haptoglobina como una biomolécula de diagnóstico para cáncer de ovario.
Antecedentes de la Invención
El cáncer de ovario epitelial es el más letal de los cánceres del tracto genital femenino. La mayoría de los cánceres de etapa temprana son asintomáticos y más de tres cuartos de los diagnósticos habitualmente se realizan en un momento en el que la enfermedad es con frecuencia incurable debido a que ya se ha establecido metástasis regional o distante (Wingo y col, 1998). Debido a la escasez de síntomas y su aparición insidiosa, la mayoría de los pacientes presentan enfermedad avanzada siendo las tasas de supervivencia en cinco años solamente del 30% (Kristensen y col, 1997).
Examinaciones pélvicas regulares y mediciones del biomarcador CA-125 seguido de diagnóstico radiológico de una manera individualizada ha sido la práctica actual para detección de esta afección enigmática. Aunque los protocolos de detección tempranos actuales han implicado generalmente una combinación de ultrasonido y niveles en suero de CA-125, estos protocolos han conseguido un éxito limitado (Karlan y col., 1999). La mayor prueba de exploración aleatoria hasta la fecha, que evalúo más de 20.000 mujeres indicó un beneficio de supervivencia, sin embargo, que no se tradujo en menos muertes entre el grupo explorado y no explorado de mujeres (Jacobs y col., 1999).
Además, las concentraciones de CA-125 son elevadas en mujeres con condiciones ginecológicas benignas incluyendo quistes ováricos, endometriosis y fibromas que forman parte del diagnóstico diferencial para cáncer de ovario (Mackey y col., 1995). Además, mujeres con enfermedad hepática, insuficiencia renal, pancreatitis y otras afecciones pueden tener CA-125 elevado limitando de este modo el papel de esta proteína como un marcador para cáncer de ovario (Devarbhavi y col., 2002). La exploración con marcadores de suero adicionales incluyendo CA-19-9 y ácido lisofosfatídico como adjuntos a exploración de CA-125 tampoco se han mostrado que sean clínicamente relevantes para fines de diagnóstico (Woolas y col., 1999).
La mayoría de las mujeres con cáncer de ovario son asintomáticas durante las etapas tempranas de esta enfermedad y la mayoría de las mujeres presentes en etapas III y IV de FIGO (Federación Internacional de Ginecología y Obstreticia). El tratamiento actualmente aceptado para cáncer de ovario de etapa avanzada es cirugía primaria de citorreducción para conseguir una citorreducción óptima (definida como tumor residual menor de 2 cm) seguido de quimioterapia. La cirugía implica habitualmente histerectomía abdominal total, salpingo-ooforectomía bilateral, omentectomia y linfadenectomia paraaórtica y pélvica. A pesar de la cirugía citoreductora, las tasas de morbidez y mortalidad siguen siendo altas con impacto mínimo en las tasas de supervivencia (Michel y col., 1997; Vergote y col., 1998). Por el contrario, la enfermedad de etapa temprana está asociada con hasta 95% de supervivencia (Cannistra, 2004) y puede usarse un enfoque quirúrgico que conserve la fertilidad en pacientes que deseen la preservación de la fertilidad (Robinson y col., 1992).
Los avances en laparoscopia han permitido a los ginecólogos realizar procedimientos previamente conseguidos solamente por laparotomía. Los ginecólogos actualmente realizan procedimientos de laparoscopia para el tratamiento de quistes ováricos benignos y ocasionalmente encuentran tumores malignos inesperados (Maiman y col., 1991). Una cirugía inapropiada debido a diagnóstico erróneo está asociada con un resultado negativo para el paciente. Es por lo tanto importante que se realice un diagnóstico intraoperatorio preciso de tumor maligno para una intervención terapéutica y quirúrgica apropiada.
El estado de la técnica actual para diagnóstico intraoperatorio es biopsia en sección congelada (Yeo y col., 1998). Este es un ensayo caro, costoso en recursos y en trabajo que no está disponible en muchos hospitales alrededor del mundo e incuso cuando está disponible habitualmente es un servicio limitado durante las horas de oficina. Su precisión se ha indicado desde el 100% (Lim y col, 1997) a un mínimo de 88,7% (Canis y col., 2004). Se necesita una alternativa fiable, más barata y más fácilmente disponible que pudiera ponerse a disposición de la mayoría de los hospitales.
Como tal, un procedimiento que resuelve o al menos alivia los problemas y limitaciones de la técnica anterior sería bienvenido.
Sumario de la Invención
La presente invención afronta los problemas anteriores y proporciona un procedimiento para detectar, cuantificar la presencia de, predisposición a o gravedad de, o pronosticar el resultado de cáncer de ovario en un sujeto o seleccionar al menos un candidato para ensayo o ensayos clínicos, experimentación o ensayo de diagnóstico para cáncer de ovario o indicar la eficacia del tratamiento, comprendiendo el procedimiento:
(a) determinar en al menos una muestra de fluido quístico obtenida de un sujeto, la expresión de proteína haptoglobina; y
(b) comparar la expresión de la proteína haptoglobina con la de un control, indicando una diferencia en la expresión la presencia de, predisposición a, gravedad de o pronóstico del resultado de cáncer de ovario en el sujeto o de la adecuación del sujeto como un candidato o indica la eficacia del tratamiento.
Un ensayo para determinar el nivel de proteína haptoglobina se desveló en el documento US 6.451.550. Sin embargo, no se proporcionó ninguna sugerencia y/o indicio con respecto al uso de este ensayo asociado con las muestras de fluido quístico y/o para la detección y/o cuantificación de un trastorno celular proliferativo.
De acuerdo con un aspecto, la presente invención proporciona un procedimiento para detectar y/o cuantificar la presencia de, predisposición a, y/o gravedad de un cáncer de ovario en un sujeto, comprendiendo el procedimiento:
(a) proporcionar al menos una muestra de fluido quístico de un sujeto;
(b) determinar la expresión de proteína haptoglobina y
(c) comparar la expresión de la proteína haptoglobina con la de un control, indicando una diferencia en la expresión la presencia de, predisposición a, y/o gravedad de cáncer de ovario en el sujeto.
También se proporciona un procedimiento para pronosticar el resultado de cáncer de ovario en un sujeto, comprendiendo el procedimiento:
(a) proporcionar al menos una muestra de fluido quístico de un sujeto;
(b) determinar la expresión de proteína haptoglobina y
(c) comparar la expresión de la proteína haptoglobina con la de al menos un control, indicando una diferencia en la expresión el pronóstico de cáncer de ovario en el sujeto.
También se proporciona un procedimiento para seleccionar al menos un candidato para ensayo o ensayos clínicos, experimentación y/o ensayo de diagnóstico que comprende:
(a) proporcionar al menos una muestra de fluido quístico de un sujeto;
(b) determinar la expresión de proteína haptoglobina y
(c) comparar la expresión de la proteína haptoglobina con la de al menos un control, indicando una diferencia en la expresión la adecuación del sujeto como un candidato.
También se proporciona un procedimiento para controlar la eficacia de un tratamiento para cáncer de ovario en un sujeto, comprendiendo el procedimiento:
(a) proporcionar al menos dos muestras de fluido quístico de un sujeto, obtenida cada muestra en diferentes puntos temporales;
(b) determinar la expresión de una proteína haptoglobina; y
(c) comparar la expresión de la proteína haptoglobina, en las al menos dos muestras, indicando una diferencia en la expresión la eficacia del tratamiento en el sujeto.
Las muestras de fluido quístico pueden obtenerse de quistes ováricos.
El control es al menos un sujeto no diagnosticado con cáncer de ovario o el control puede ser un experimento, valor
o sujeto de referencia con el que pueden compararse los valores obtenidos en las muestras o ensayos. La proteína haptoglobina puede ser una proteína haptoglobina humana.
La secuencia de una proteína haptoglobina se proporciona en SEC ID Nº: 2. El gen de la haptoglobina puede tener la secuencia de ADN de SEC ID Nº: 1. La determinación puede ser por colorimetría. La colorimetría puede estar basada en actividad peroxidasa de complejo hemoglobina-haptoglobina en un sustrato. La determinación puede ser por Espectrometría de Masas. La Espectrometría... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para detectar o cuantificar la presencia de, o predisposición a, o gravedad de o pronosticar el resultado de cáncer de ovario en un sujeto o seleccionar al menos un candidato para ensayo o ensayos clínicos, experimentación o ensayo de diagnóstico para cáncer de ovario o indicar la eficacia del tratamiento, comprendiendo el procedimiento:
(a) determinar en al menos una muestra de fluido quístico obtenida de un sujeto, la expresión de proteína haptoglobina; y
(b) comparar la expresión de la proteína haptoglobina con la de un control, indicando una diferencia en la expresión la presencia de, predisposición a, gravedad de o pronostico del resultado de cáncer de ovario en el sujeto o la adecuación del sujeto como un candidato o indicación de la eficacia del tratamiento.
2. El procedimiento de acuerdo con la reivindicación 1, comprendiendo el procedimiento:
(a) determinar en al menos dos muestras de fluido quístico obtenidas de un sujeto, cada muestra obtenida en diferentes puntos temporales, la expresión de una proteína haptoglobina; y
(b) comparar la expresión de la proteína haptoglobina en las al menos dos muestras, indicando una diferencia en la expresión la eficacia del tratamiento en el sujeto.
3. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 ó 2, en el que el control es al menos un sujeto no diagnosticado con cáncer de ovario.
4. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que la proteína haptoglobina es proteína haptoglobina humana.
5. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que la secuencia de la proteína haptoglobina se da en SEC ID Nº: 2.
6. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en el que el procedimiento comprende adicionalmente al menos una medición de CA-125 en la muestra o muestras.
7. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que el procedimiento comprende adicionalmente al menos una evaluación de ultrasonidos del sujeto.
8. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 7, en el que el sujeto es un mamífero.
9. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 8, en el que la expresión de proteína haptoglobina se mide por determinación de la presencia de:
(a) proteína haptoglobina total;
(b) al menos una subunidad de la proteína haptoglobina y/o
(c) transcrito génico que codifica la proteína haptoglobina.
10. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en el que la expresión de proteína haptoglobina se mide por determinación de la presencia de subunidad α o subunidad β de la proteína haptoglobina.
11. El procedimiento de acuerdo con la reivindicación 10, en el que la subunidad α de la proteína haptoglobina es la subunidad α2.
12. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 10, en el que la expresión de proteína haptoglobina se determina usando al menos un anticuerpo.
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Métodos para detectar distintivos de enfermedades o afecciones en fluidos corporales, del 15 de Julio de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un método in vitro para diagnosticar la presencia de un agente infeccioso en un individuo que comprende los pasos de: obtener un primer perfil de expresión […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos para clasificar pacientes con un cáncer sólido, del 24 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un método in vitro para el pronóstico del tiempo de supervivencia de un paciente que padece un cáncer sólido, cuyo método comprende los siguientes […]
Procedimiento de detección del cáncer, del 24 de Junio de 2020, de Sienna Cancer Diagnostics Ltd: La presente invención proporciona un procedimiento para resolver una evaluación citológica no concluyente de células epiteliales de vejiga en […]
Método para el diagnóstico/pronóstico de cáncer colorrectal, del 17 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un método de obtención de datos útiles para el diagnóstico, el pronóstico o la monitorización de la evolución de cáncer colorrectal (CCR), […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]
Medios y métodos para la predicción de la respuesta a un tratamiento de un paciente con cáncer, del 10 de Junio de 2020, de Grabe, Niels: Un método para predecir si un paciente con cáncer con un tumor sólido responde a un tratamiento con quimioterapia, que comprende las etapas que consisten […]