Batería de combustible de agua oxigenada y ácido clorhídrico.
Batería de combustible que funciona mediante la utilización de ácido clorhídrico y agua oxigenada como tales.
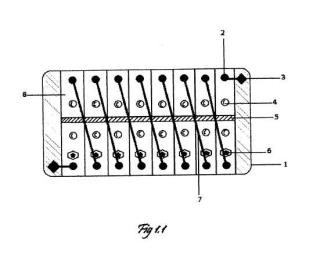
La reacción química produce agua y oxígeno, además de alrededor de 1 voltio. La batería se divide en cubas electrolíticas (8) conectadas en serie por cables de cobre (7). Cada cuba tiene dos aberturas correspondientes, a extremos opuestos de la cuba, aisladas mediante tapones de rosca (4), con el fin de que el usuario pueda restituir los compuestos químicos, cuando sea necesario. Además, posee una tercera abertura en el lado de la membrana en el cual se añadirá la solución que sólo contendrá el agua oxigenada, la cual esta taponada por una válvula expulsora de aire (6), que liberará el oxigeno producido por la reacción. Cada cuba electrolítica está dividida en dos por una membrana de polietileno de baja densidad (5), la cual permite el paso de iones H+ cerrando el circuito. A cada lado de la membrana se encuentra un fino cilindro de platino (2) el cual funciona como catalizador de la reacción y electrodo.Además, los electrodos de los extremos se encuentran conectados a los bornes de la batería (3), los cuales se conectarán al aparato al que se le quiera suministrar energía. Todo esto se encuentra en un recipiente cúbico de plástico de 1 cm de grosor mínimo (1).
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201300836.
Solicitante: VALERA RIBERA, Carlos.
Nacionalidad solicitante: España.
Inventor/es: VALERA RIBERA,Carlos.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- H01M6/04 ELECTRICIDAD. › H01 ELEMENTOS ELECTRICOS BASICOS. › H01M PROCEDIMIENTOS O MEDIOS, p. ej. BATERÍAS, PARA LA CONVERSION DIRECTA DE LA ENERGIA QUIMICA EN ENERGIA ELECTRICA. › H01M 6/00 Células primarias; Su fabricación. › Células con electrolito acuoso.
- H01M8/08 H01M […] › H01M 8/00 Pilas de combustible; Su fabricación. › Pilas de combustible con electrolitos acuosos.
Fragmento de la descripción:
Batería de combustible de agua oxigenada y ácido clorhídrico.
Sector de la técnica 5
La invención se encuadra en el sector técnico de pilas y baterías generadoras de electricidad, más concretamente en el relativo a pilas de combustible, es decir, pilas que permiten el reabastecimiento continuo de reactivos consumidos.
Estado de la técnica
La contaminación y altos niveles de dióxido de carbono generados por la población mundial afectan de forma muy negativa tanto al medio ambiente como a nuestra salud. Cabe destacar como se bao creado diversos tratados entre naciones para reducir la 15 producción de dióxido de carbono.
Con el fin de disminuir la cantidad de polución producida por el ser humano, científicos de todo el mundo bao diseñado y creado fuentes de energías alternativas. En el campo de las pilas y baterías, se ha buscado la forma de obtener energía sin el uso de metales o 20 compuestos que sean perjudiciales para el medio ambiente.
Uno de las pocos tipos de baterías que no contaminan pero que son lo suficientemente eficientes son las baterías de combustible, entre ellas la batería de hidrógeno. La cual emplea el hidrógeno y el oxígeno como combustibles, generando como único residuo 25 agua.
La pila de hidrógeno utiliza el hidrógeno y oxigeno como combustible para producir electricidad. Se separan el cátodo y ánodo por una membrana que permite el paso de protones. 30
En el ánodo, la molécula de hidrógeno (H2) se separa en dos protones y dos electrones. Los electrones viajan hasta el cátodo, mientras que los protones cruzan la membrana hasta la cámara donde se encuentra el oxígeno y el cátodo.
En el cátodo, las moléculas de oxigeno (O2) reaccionan con los protones que bao cruzado la membrana y con los electrones provenientes del ánodo. Formando vapor de agua.
Combinando las semirreacciones, y los potenciales estándares redox:
O2 (g) + 2H+ (ac) + 4e- ï³ H2O (l) EÃ = + 1, 23 V
2H+ (ac) + 2e- ï³ H2 (g) EÃ = 0, 00 V
O2 (g) + 2H2 (ac) 2H2O (l) EÃ = + 1, 23 V
** (Ver fórmula) **
Pero, esta pila presenta varias desventajas y problemas, los cuales se analizaran a continuación, que dificultan su fabricación como sustituto de las pilas y baterías actuales. 50 El principal efecto de esta batería es su membrana. Dado que la membrana solo debe permitir el paso de protones, es preciso incorporar a la pila una membrana diseñada para permitir solo el intercambio de protones entre los dos compuestos, lo cual resulta altamente costoso. Además, la membrana debe hidratarse, requiriendo evaporar el agua exactamente en la misma medida en que ésta es producida. Si el agua se evapora demasiado rápido, la membrana se seca, la resistencia a través de ella aumenta, y se 5 agrietará, creando un "corto circuito" de gas donde el hidrógeno y el oxígeno se combinan directamente, generando calor que dañará la celda de combustible. Si el agua se evapora demasiado despacio, los electrodos se inundarán, evitando que los reactivos puedan alcanzar el catalizador y se parará la reacción.
Otro problema es la utilización de hidrógeno como combustible. El hidrógeno es un gas altamente inflamable y con gran capacidad reductora. Alto riesgo de incendio o explosión. Su inhalación en altas concentraciones provoca una deficiencia de oxígeno, con riesgo de inconsciencia o muerte. Además, la producción de hidrógeno si produce residuos dañinos para el medio ambiente. 15
Para resolver este problema, la presente invención trata sobre una batería de combustible que no precisa de la utilización de hidrógeno ni lo genera. Pero generando suficiente energía para su utilización como batería de un vehículo, siendo totalmente respetuosa con el medio ambiente. 20
Descripción detallada de la invención
La presente invención se refiere a una nueva batería de combustible que precisa como combustible de agua oxigenada y ácido clorhídrico, sus correspondientes 25 concentraciones y el procedimiento para la fabricación de dicha batería.
Dicha batería se conforma por un recipiente cúbico, compuesto de plástico de un grosor de 1 cm mínimo, dividido en cubas electrolíticas conectadas en serie. Cada cuba está a su vez dividida por la mitad por una membrana de polietileno de baja densidad. 30
En cada cuba hay dos electrodos de platino, uno a cada lado de la membrana de polietileno de baja densidad, de forma cilíndrica, los cuales llegan basta el fondo del recipiente. Cada electrodo esta unido mediante un cable al electrodo de la división a la que precede y del lado de la membrana de polietileno de baja densidad, contrario al suyo. 35 Además, cada división de las cubas posee un orificio para su posterior recambio de los compuestos químicos. Cada orificio tiene un tapón correspondiente para evitar la fuga de los líquidos químicos de la batería. A lados opuestos del recipiente se encuentran los bornes de la batería, los cuales se conectarán al sistema de cableado del aparato al que se conecte. Los bornes están a su vez conectados en serie con el resto del cableado de 40 la batería, conformando cada uno el extremo del cableado, pero sin llegar a cerrar el circuito.
Al mismo lateral para todas las membranas del polietileno de baja densidad se añade ácido clorhídrico concentrado y agua oxigenada en un ratio molar de dos a uno 45 respectivamente. En el lateral opuesto de todas las membranas de polietileno de baja densidad se añade agua oxigenada de la misma concentración que la del lado opuesto. En ese mismo lado se encuentra una abertura, en la cual se encuentra una válvula de expulsión de aire automática. La cual permitirá que el oxígeno formado en ese lado de la membrana sea liberado pero no permitirá que aire de fuera de la batería la penetre. 50
Dado que la reacción química que se produce al combinar ambas semirreacciones es la siguiente:
2H2O2 (ac) + 2H+ (ac) 2H2O (l) + O2 (g)
** (Ver fórmula) **
Cada cuba electrolítica da de media 1 voltio de potencial eléctrico.
La presente invención se ilustra adicionalmente mediante el siguiente ejemplo, el cual no pretende ser limitativo de su alcance.
Ejemplo 1
Cuando la batería está destinada para. funcionar como batería de arranque de un automóvil, en este caso un turismo, las concentraciones, número de cubas electrolíticas con sus correspondientes membranas de polietileno, válvulas de aire automáticas y 15 electrodos es el siguiente:
â? Concentración de los compuestos:
â- Concentración de agua oxigenada: 110 volúmenes. 20
â- Concentración de ácido clorhídrico: 23%.
â? Número de cubas electrolíticas más sus componentes:
â- 12 cubas electrolíticas.
â- 12 membranas de polietileno de baja densidad.
â- 24 tapones. 30
â- 12 cables conectando las cubas en serie.
â- 24 electrodos de platino.
â- 12 válvulas de expulsión de aire automáticas.
â? Otros componentes de la batería:
â- 2 bornes para conectar al automóvil (turismo) . 40
â? Los volúmenes de los compuestos químicos y tamaño de las cubas electrolíticas son variables y no dispensan de un valor específico para el correcto funcionamiento del dispositivo. Aun así es recomendable que el volumen de los compuestos químicos respete el ratio 1 : 2 molar entre el agua oxigenada y el ácido clorhídrico, 45 respectivamente, que se encuentran en la misma cuba electrolítica.
Descripción de las figuras
La figura 1.1 hace referencia a la batería en perspectiva cenital. El recipiente cúbico de 50 plástico de un grosor de 1 cm como mínimo (1) , esta herméticamente cerrado de forma que los cables de cobre (7) y los electrodos de platino (2) no están expuestos al ambiente. Además, el recipiente contiene las cubas electrolíticas (8) , el número de cubas electrolíticas depende del voltaje deseado. A mayor número de cubas más voltaje se obtiene. Todas las cubas electrolíticas están divididas por la mitad por una membrana de polietileno de baja densidad (5) , la cual permite el paso de iones H+, cerrando el circuito. 5 A cada lado de la membrana se encuentra un electrodo de platino (2) , el cual actuará como catalizador de la reacción y además funcionará como conductor de los electrones generados por la reacción. Cada electrodo está conectado por un cable de cobre (7) al electrodo del lado opuesto de la membrana y de la cuba siguiente como se muestra en el dibujo. Excepto los de las cubas de los extremos, los cuales están conectados a los 10 bornes (3) de la batería, que se conectarán al aparato que...
Reivindicaciones:
1. Máquina suministradora de electricidad, la cual se trata de una batería de combustible, permitiendo el restablecimiento continuo de los reactivos consumidos. Se comprende por un recipiente cúbico de plástico de 1 cm de grosor mínimo (1) , dividido en cubas 5 electrolíticas (8) conectadas en serie. Cada cuba tiene dos aberturas correspondientes, a extremos opuestos de la cuba, aisladas mediante tapones de rosca (4) , con el fin de que el usuario pueda restituir los compuestos químicos, cuando sea necesario. Esta batería está caracterizada por que como electrolitos utiliza agua oxigenada y ácido clorhídrico. De tal forma que ocurre la reacción: 10
2H2O2 (ac) + 2H+ (ac) 2H2O (l) + O2 (g) , generando de media un voltio de potencial eléctrico por cada cuba electrolítica utilizada.
** (Ver fórmula) **
2. Batería de combustible según la reivindicación 1 caracterizada por la división de cada cubas electrolítica por una membrana de polietileno de baja densidad (5) , colocada de 15 forma transversal en el centro de cada cuba, dividiéndola en dos partes y separando la mezcla de ácido clorhídrico y agua oxigenada del electrolito de agua oxigenada pura.
3. Batería de combustible según la reivindicación 1 y 2 caracterizada por la utilización de platino como electrodo (2) , colocando dos electrodos por cuba, uno a cada lado de la 20 membrana (5) . Además los electrodos se encuentran conectados en serie entre cuba y cuba, como muestra la Figura (1.1) .
4. Batería de combustible según la reivindicación 1, 2 y 3 caracterizada por la utilización de válvulas de expulsión de aire automáticas en un solo lado de la batería (6) , en el cual 25 se encontrará el electrolito de agua oxigenada pura. De este modo, el oxígeno producido por el agua oxigenada pura al ser oxidada.
Patentes similares o relacionadas:
Módulo metálico generador eléctrico, del 30 de Noviembre de 2018, de SANTANA RAMIREZ, Alberto Andrés: El funcionamiento del Módulo metálico generador eléctrico se basa en la producción eléctrica estable de una pluralidad de ánodos de sacrificio de uso común […]
Batería de flujo redox totalmente de cobre acuoso, del 7 de Noviembre de 2018, de Aalto University Foundation sr: Una batería de flujo redox acuoso totalmente de cobre, que comprende: (i) al menos un primer compartimento de celda media que incluye una primera solución […]
Sistema de recaptura/reciclado de agua en celdas electroquimicas, del 28 de Septiembre de 2016, de Fluidic, Inc: Un sistema para manejar el contenido de agua en una o más celdas electroquímicas y cada celda electroquímica comprende una pluralidad […]
Celda enriquecida para reacción tipo Redox, del 19 de Julio de 2016, de SANTANA RAMIREZ, Alberto Andrés: 1. Celda enriquecida para reacción tipo redox caracterizado por ser un depósito con tapa para generar electricidad usando como electrolito agua de […]
 Batería de flujo redox para generación de hidrógeno, del 2 de Marzo de 2016, de EOS Holding SA: Un sistema de batería de flujo redox, que comprende:
a. Una batería de flujo redox, que comprende:
i. Una celda electroquímica que tiene un primer compartimento […]
Batería de flujo redox para generación de hidrógeno, del 2 de Marzo de 2016, de EOS Holding SA: Un sistema de batería de flujo redox, que comprende:
a. Una batería de flujo redox, que comprende:
i. Una celda electroquímica que tiene un primer compartimento […]
 Red interpenetrada de polímeros de intercambio de aniones, su método de fabricación y su uso, del 10 de Febrero de 2016, de ELECTRICITE DE FRANCE: Método de fabricación de un material polimérico de intercambio de aniones que tiene una estructura de tipo red interpenetrada de polímeros […]
Red interpenetrada de polímeros de intercambio de aniones, su método de fabricación y su uso, del 10 de Febrero de 2016, de ELECTRICITE DE FRANCE: Método de fabricación de un material polimérico de intercambio de aniones que tiene una estructura de tipo red interpenetrada de polímeros […]
 Conjunto de pilas de combustible que tiene características de larga duración, del 13 de Enero de 2016, de Doosan Fuel Cell America, Inc: Un conjunto de pilas de combustible , que comprende:
una placa separadora ;
una primera capa de campo de flujo y una segunda capa de campo de flujo (12') […]
Conjunto de pilas de combustible que tiene características de larga duración, del 13 de Enero de 2016, de Doosan Fuel Cell America, Inc: Un conjunto de pilas de combustible , que comprende:
una placa separadora ;
una primera capa de campo de flujo y una segunda capa de campo de flujo (12') […]
 REFRIGERACION DE PILAS DE COMBUSTIBLE, del 16 de Noviembre de 2007, de GENERAL ELECTRIC COMPANY: Un montaje de pila de combustible que comprende: al menos una pila de combustible que comprende un ánodo , un cátodo y un electrolito interpuesto […]
REFRIGERACION DE PILAS DE COMBUSTIBLE, del 16 de Noviembre de 2007, de GENERAL ELECTRIC COMPANY: Un montaje de pila de combustible que comprende: al menos una pila de combustible que comprende un ánodo , un cátodo y un electrolito interpuesto […]