APARATO Y PROCEDIMIENTO PARA LA SECUENCIACION DE ACIDOS NUCLEICOS.
Matriz para secuenciar un ácido nucleico, que comprende: una oblea cavitada de fibras ópticas formadas a partir de un haz de una pluralidad de fibras ópticas individuales,
presentando cada fibra óptica individual un diámetro de entre 3 y 100 µm, comprendiendo la oblea una superficie superior y una superficie inferior, comprendiendo la superficie superior más de 400.000 cámaras de reacción, en la que las cámaras de reacción se encuentran grabadas en la superficie superior de la oblea cavitada de fibras ópticas y en el que el grosor de la oblea entre la superficie superior y la superficie inferior presenta un grosor de entre 0,5 mm y 5,0 mm; en el que la profundidad de cada cámara de reacción se encuentra comprendida entre una mitad del diámetro de la fibra óptica individual y tres veces el diámetro de la fibra óptica individual, y en el que una pluralidad de cámaras de reacción sobre la superficie superior de la oblea cavitada presenta un ácido nucleico en las mismas, y en el que 50% a 100% de las cámaras de reacción puede presentar un soporte sólido móvil con un enzima de secuenciación inmovilizado sobre el mismo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/008700.
Solicitante: 454 LIFE SCIENCES CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 20 COMMERCIAL STREET BRANFORD CT 06405 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ROTHBERG,JONATHAN,M, DEWELL,SCOTT,B, SIMPSON,JOHN W, WEINER,MICHAEL,PHILIP, BADER,JOEL,S, BERKA,JANE, COLANGELO,CHRISTOPHER,M, MCDADE,KEITH.
Fecha de Publicación: .
Fecha Solicitud PCT: 21 de Marzo de 2002.
Fecha Concesión Europea: 26 de Mayo de 2010.
Clasificación Internacional de Patentes:
- B01L3/00C6M
- B82Y15/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B82 NANOTECNOLOGIA. › B82Y USOS O APLICACIONES ESPECIFICOS DE NANOESTRUCTURAS; MEDIDA O ANALISIS DE NANOESTRUCTURAS; FABRICACION O TRATAMIENTO DE NANOESTRUCTURAS. › Nano tecnología para interactuar, detectar o actuar, p. ej. puntos cuánticos como marcadores en ensayos de proteínas o motores moleculares.
- C12P19/34 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › Polinucleótidos, p. ej. ácidos nucleicos, oligorribonucleótidos.
- C12Q1/68B10A
- G01N21/03A
- G01N21/64P2
- G01N21/77B
Clasificación PCT:
- B01J19/00 B […] › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01J PROCEDIMIENTOS QUÍMICOS O FÍSICOS, p. ej. CATÁLISIS O QUÍMICA DE LOS COLOIDES; APARATOS ADECUADOS. › Procedimientos químicos, físicos o físico-químicos en general; Aparatos apropiados.
- B01L3/00 B01 […] › B01L APARATOS DE LABORATORIO PARA LA QUIMICA O LA FISICA, DE USO GENERAL (aparatos de uso médico o farmacéutico A61; aparatos para aplicaciones industriales o aparatos de laboratorio cuya estructura y funciones son comparables a las de aparatos industriales similares, ver las clases relativas a los aparatos industriales, en particular las subclases B01 y C12; aparatos de separación o de destilación B01D; dispositivos de mezcla o de agitación B01F; atomizadores B05B; tamices, cribas B07B; tapones, capuchones B65D; manipulación de líquidos en general B67; bombas de vacío F04; sifones F04F 10/00; grifos, válvulas F16K; tubos, empalmes para tubos F16L; aparatos especialmente adaptados al estudio y análisis de materiales G01, particularmente G01N; aparatos eléctricos u ópticos, ver las subclases apropiadas en las secciones G y H). › Recipientes o utensilios para laboratorios, p. ej. cristalería de laboratorio (botellas B65D; equipos para enzimología o microbiología C12M 1/00 ); Cuentagotas (recipientes para volumetría G01F).
Clasificación antigua:
- C12P19/34 C12P 19/00 […] › Polinucleótidos, p. ej. ácidos nucleicos, oligorribonucleótidos.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
CAMPO TÉCNICO [0001] La invención se refiere a un aparato y a métodos para determinar la secuencia de un ácido nucleico.
ANTECEDENTES DE LA INVENCIÓN [0002] Muchas enfermedades se asocian a secuencias particulares de ADN. Las secuencias de ADN con frecuencia se denominan polimorfismos de secuencia de ADN para indicar que la secuencia de ADN asociada a un estado de enfermedad difiere de la secuencia de ADN correspondiente en individuos no afectados. Entre los polimorfismos de secuencia de ADN se incluyen, por ejemplo, inserciones, deleciones o sustituciones de nucleótidos en una secuencia respecto a una segunda secuencia. Un ejemplo de un polimorfismo de secuencia de ADN particular es 5'-ATGC-3' respecto a la secuencia 5'-ATGG-3' en una localización particular en el genoma humano. El primer nucleótido 'G' en la última secuencia ha sido sustituido por el nucleótido 'C' en la primera secuencia. La primera secuencia se asocia a un estado de enfermedad particular, mientras que la última secuencia se encuentra en individuos que no padecen la enfermedad. De esta manera, la presencia de la secuencia de nucleótidos 5'-ATCG-3' indica que el individuo presenta una enfermedad particular. Este tipo particular de polimorfismo de secuencia es conocido como polimorfismo de nucleótido único,
o SNP, debido a que la diferencia entre las secuencias se debe a un cambio de un único nucleótido. [0003] Las técnicas que permiten la rápida detección de tan sólo un único cambio de base de ADN resultan, por lo tanto, metodologías importantes para la utilización en el análisis genético. Debido al gran tamaño del genoma humano, del orden de 3.000 millones de pares de bases, las técnicas para identificar polimorfismos deben ser suficientemente sensibles para identificar específicamente la secuencia que contiene el polimorfismo en una población potencialmente grande de ácidos nucleicos. [0004] Típicamente, se lleva a cabo un análisis de polimorfismo de secuencias del ADN mediante el aislamiento del ADN de un individuo, la manipulación del ADN aislado, por ejemplo mediante digestión del ADN con enzimas de restricción y/o la amplificación de un subconjunto de secuencias en el ADN aislado. A continuación, se examina adicionalmente el ADN manipulado para determinar si se encuentra presente una secuencia particular. [0005] Entre los procedimientos utilizados comúnmente para analizar el ADN se incluyen la electroforesis. Entre las aplicaciones comunes de la electroforesis se incluyen la electroforesis en gel de agarosa o de poliacrilamida. Las secuencias de ADN se insertan, o se cargan, en los geles y se someten a un campo eléctrico. Debido a que el ADN porta una carga negativa uniforme, el ADN migra a través del gel basado en propiedades que incluyen la longitud de la secuencia, la conformación tridimensional e interacciones con la matriz de gel tras la aplicación del campo eléctrico. En la mayoría de aplicaciones, las moléculas de ADN más pequeñas migrarán más rápidamente a través del gel que los fragmentos más grandes. Tras prolongar la electroforesis durante un periodo de tiempo suficientemente largo, las moléculas de ADN en la población inicial de secuencias de ADN se habrán separado según sus tamaños relativos. [0006] De esta manera pueden detectarse moléculas particulares de ADN utilizando una diversidad de metodologías de detección. Para algunas aplicaciones, se identifican secuencias particulares de ADN a partir de la presencia de etiquetas detectables, tales como marcajes radioactivos, unidos a molécula de ADN específicas. [0007] Los análisis de separación de tipo electroforético pueden resultar menos deseables para aplicaciones en las que resulta deseable analizar rápida, económica y exactamente un gran número de muestras de ácidos nucleicos para polimorfismos de secuencia particulares. Por ejemplo, el análisis de tipo electroforético puede requerir una gran cantidad de ADN de entrada. Además, el procesamiento de un gran número de muestras, requerido para los análisis de ácidos nucleicos basados en la electroforesis, puede ser laboriosa. Además, estas técnicas pueden requerir muestras de moléculas de ADN idénticas, que deben crearse antes de la electroforesis a costes que pueden ser considerables. [0008] Recientemente se han puesto a disposición del público sistemas automáticos de electroforesis. Sin embargo, la electroforesis puede resultar poco adecuada para aplicaciones tales como la secuenciación clínica, en la que resultan necesarias unidades relativamente rentables de alto rendimiento. De esta manera, la necesidad de métodos no electroforéticos para la secuenciación es grande. Para muchas aplicaciones, se utiliza la electroforesis conjuntamente con el análisis de secuencias de ADN. [0009] Se han descrito varias alternativas a la secuenciación de tipo electroforético. Entre ellas se incluyen la microscopía electrónica de barrido de efecto túnel, la secuenciación mediante hibridación y los métodos de detección de moléculas individuales. [0010] Otra alternativa al análisis de separación de tipo electroforético son los análisis de ácidos nucleicos basados en un sustrato sólido. Estos sustratos típicamente se basan en la utilización de grandes números de sondas de ácidos nucleicos fijados en diferentes localizaciones en un soporte sólido. Entre estos soportes sólidos se incluyen, por ejemplo, superficies de vidrio, placas de microtitulación de plástico, hojas de plástico, polímeros delgados o semiconductores. [0011] Las sondas pueden, por ejemplo, adsorberse o unirse covalentemente al soporte, o pueden microencapsularse o de otro modo atraparse dentro de una matriz de sustrato, membrana o película.
Entre los análisis de ácidos nucleicos basados en un sustrato pueden incluirse aplicar un ácido nucleico de muestra que se conoce o se sospecha que contiene un polimorfismo de secuencia particular a una matriz o a sondas unidas al sustrato sólido. Los ácidos nucleicos en la población se dejan hibridar a secuencias complementarias unidas al sustrato, en caso de encontrarse presente. A continuación, se detectan las secuencias de ácidos nucleicos hibridantes en una etapa de detección. [0013] Las metodologías de hibridación basadas en una matriz de soporte sólido y de secuenciación pueden requerir una concentración elevada de ADN de muestra y pueden resultar afectadas negativamente por la cinética relativamente lenta de la hibridación de las muestras de ácidos nucleicos con las sondas oligonucleótidas inmovilizadas. Con frecuencia, únicamente se dispone de una cantidad reducida de ADN de molde, y puede resultar deseable disponer de concentraciones elevadas de la secuencia diana de ácidos nucleicos. De esta manera, los análisis de detección basados en un sustrato con frecuencia incluyen una etapa en la que se amplifican copias del ácido nucleico diana, o un subconjunto de secuencias en el ácido nucleico diana. Los métodos basados en la reacción en cadena de la polimerasa (PCR), por ejemplo, pueden incrementar un número pequeño de sondas diana en varios órdenes de magnitud en solución. Sin embargo, la PCR puede reusltar difícil de incorporar en un enfoque de fase sólida debido a que el ADN amplificado no se encuentra inmovilizado sobre la superficie de la matriz de soporte sólido. [0014] La detección basada en una fase sólida de los polimorfismos de secuencia ha sido descrita. Un ejemplo es un protocolo de "mini-secuenciación" basado en un principio de fase sólida descrito por Hultman et al., Nucl. Acids Res. 17:4937-4946, 1988; Syvanen et al., Genomics 8:684-692, 1990. En este estudio, la incorporación de un nucleótido marcado radioactivamente se mide y se utiliza para el análisis de un polimorfismo de tres alelos del gen de la apolipoproteína E humana. Sin embargo, dichos métodos radioactivos no resultan muy adecuados para las aplicaciones clínicas rutinarias, y por lo tanto, el desarrollo de un método no radioactivo simple y altamente sensible para el análisis rápido de la secuencia del ADN también ha despertado un gran interés. [0015] Walt D. et al., Anal. Chem. 72:5618-5624, 2000, dan a conocer una matriz aleatoria de microesferas de ADN de fibra óptica de alta densidad. [0016] Walt D. et al., Anal. Chem. 70:1242-1248, 1998, dan a conocer matrices detectoras ópticas direccionables de alta densidad ordenadas aleatoriamente. [0017] Winograd N. et al., Anal. Chem. 71:3318-3324, 1999, dan a conocer matrices con
10.000 nanoviales/cm2. [0018] Walt D. et al., Nature Biotech. 14:1681-1684, 1996, dan a conocer una micromatriz biodetectora de ADN de fibra óptica para el análisis de la expresión génica. [0019] La patente WO nº 97/27326 da a conocer un método de fabricación y lectura de una
Reivindicaciones:
1. Matriz para secuenciar un ácido nucleico, que comprende:
una oblea cavitada de fibras ópticas formadas a partir de un haz de una pluralidad de fibras ópticas individuales, presentando cada fibra óptica individual un diámetro de entre 3 y 100 µm, comprendiendo la oblea una superficie superior y una superficie inferior, comprendiendo la superficie superior más de 400.000 cámaras de reacción, en la que las cámaras de reacción se encuentran grabadas en la superficie superior de la oblea cavitada de fibras ópticas y en el que el grosor de la oblea entre la superficie superior y la superficie inferior presenta un grosor de entre 0,5 mm y 5,0 mm; en el que la profundidad de cada cámara de reacción se encuentra comprendida entre una mitad del diámetro de la fibra óptica individual y tres veces el diámetro de la fibra óptica individual, y en el que una pluralidad de cámaras de reacción sobre la superficie superior de la oblea cavitada presenta un ácido nucleico en las mismas, y en el que 50% a 100% de las cámaras de reacción puede presentar un soporte sólido móvil con un enzima de secuenciación inmovilizado sobre el mismo.
2. Matriz según la reivindicación 1, en la que el ácido nucleico se inmoviliza sobre las cámaras de reacción o sobre un soporte móvil.
3. Matriz según la reivindicación 1 ó 2, en la que el diámetro de cada fibra óptica individual en la oblea cavitada de fibras ópticas es de entre 6 y 50 µm.
4. Matriz según cualquiera de las reivindicaciones 1 a 3, en la que las cámaras de reacción presentan un espaciado centro a centro de entre 10 y 200 µm.
5. Matriz según cualquiera de las reivindicaciones 1 a 3, en la que las cámaras de reacción presentan un espaciado centro a centro de entre 10 y 150 µm.
6. Matriz según cualquiera de las reivindicaciones 1 a 3, en la que las cámaras de reacción presentan un espaciado centro a centro de entre 100 y 150 µm.
7. Matriz según cualquiera de las reivindicaciones 1 a 6, en la que la matriz presenta una superficie pulida de fibras ópticas situada delante de la superficie cavitada de fibras ópticas, y en la que la superficie pulida permite el acoplamiento óptica con una segunda fibra óptica.
8. Matriz según cualquiera de las reivindicaciones 1 a 7, en la que la oblea cavitada de fibras ópticas se encuentra recubierta.
9. Matriz según la reivindicación 8, en la que el recubrimiento se selecciona de entre el grupo que consiste de plástico, capas de oro con monocapas autoensamblantes de tiol-alcanos de cadena larga, reactivos organosilano, línkers fotorreactivos, geles de polímero hidrofílico y polímeros plurónicos, encontrándose los polímeros plurónicos específicamente adsorbidos a una superficie de poliestireno o de vidrio silanizado.
10. Matriz según cualquiera de las reivindicaciones 1 a 9, en la que el enzima de secuenciación es la luciferasa.
11. Matriz según cualquiera de las reivindicaciones 1 a 9, en la que el enzima de secuenciación es la sulfurilasa.
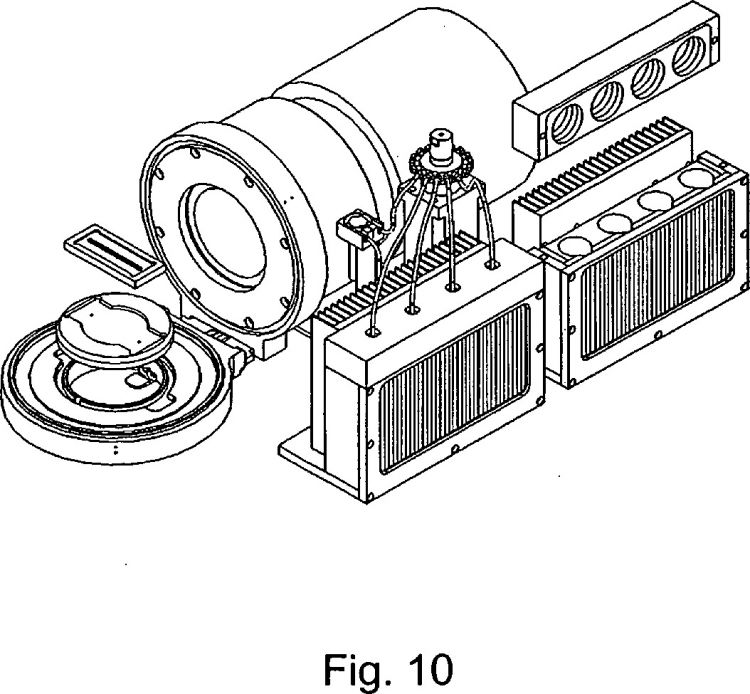
12. Aparato para secuenciar ácidos nucleicos, que comprende una matriz según cualquiera de las reivindicaciones 1 a 11, un medio para administrar reactivos en las cámaras de reacción y desde las mismas, y un medio para detectar un suceso de reacción de secuenciación.
13. Aparato según la reivindicación 12, comprendiendo el aparato:
una cámara de flujo en la que se ha dispuesto una matriz según la reivindicación
1, en la que las cámaras de reacción presentan un espaciado de centro a centro de
entre 5 y 200 µm,
un medio líquido para administrar reactivos de procesamiento procedentes de
uno o más reservorios a la cámara de flujo de manera que los ácidos nucleicos en
los mismos se encuentren expuestos a los reactivos, y
un medio de detección para detectar una secuencia de señales ópticas procedente de cada una de las cámaras de reacción, en el que
el medio de detección se encuentra en comunicación con las cámaras de reac
ción, siendo cada señal óptica de la secuencia indicativa de una interacción entre un
reactivo de procesamiento y el ácido nucleico en la cámara de reacción.
14. Aparato según la reivindicación 12 ó 13, en el que el diámetro de cada fibra óptica individual en la oblea cavitada de fibras ópticas es de entre 6 y 50 µm.
15. Aparato según la reivindicación 12, 13 ó 14, en el que el medio de detección es una cámara CCD.
16. Aparato según cualquiera de las reivindicaciones 12 a 15, en el que la oblea cavitada de fibras ópticas se encuentra recubierta
17. Aparato según la reivindicación 16, en el que el recubrimiento se selecciona de entre el grupo que consiste de plástico, capas de oro, reactivos organosilano, línkers fotorreactivos, geles de polímero hidrofílico y polímeros plurónicos, adsorbiéndose específicamente los polímeros plurónicos a una superficie de poliestireno o de vidrio silanizado.
18. Aparato según cualquiera de las reivindicaciones 12 a 17, en el que el enzima de secuenciación es la luciferasa.
19. Aparato según cualquiera de las reivindicaciones 12 a 17, en el que el enzima de secuenciación es la sulfurilasa.
20. Aparato según cualquiera de las reivindicaciones 12 a 19, en el que el ácido nucleico se inmoviliza en las cámaras de reacción o sobre un soporte móvil.
21. Aparato según cualquiera de las reivindicaciones 12 a 19, en el que las cámaras de reacción presentan un espaciado de centro a centro de entre 10 µm y 200 µm.
22. Aparato según cualquiera de las reivindicaciones 12 a 19, en el que las cámaras de reacción presentan un espaciado de centro a centro de entre 10 µm y 150 µm.
23. Aparato según cualquiera de las reivindicaciones 12 a 19, en el que las cámaras de reacción presentan un espaciado de centro a centro de entre 100 µm y 150 µm.
24. Método para la secuenciación de un ácido nucleico, comprendiendo el método utilizar una matriz según cualquiera de las reivindicaciones 1 a 11, o en el que el método comprende utilizar un aparato según cualquiera de las reivindicaciones 12 a 23.
25. Método según la reivindicación 24, en el que la matriz se dispone en una cámara de
flujo y en el que las cámaras de reacción presentan un espaciado de centro a centro de entre 5 y 200 µm,
y en el que el método comprende administrar reactivos de procesamiento procedentes de uno o más reservorios a la cámara de flujo de manera que los ácidos nucleicos dispuestos en los mismos se encuentren expuestos a los re-activos, y
detectar una secuencia de señales ópticas de cada una de las cámaras de reacción utilizando un medio de detección que se encuentra en comunicación con las cámaras de reacción, siendo cada señal óptica de la secuencia indicativa de una interacción entre un reactivo de procesamiento y el ácido nucleico dispuesto en la cámara de reacción.
26. Método según la reivindicación 24 ó 25, en el que el ácido nucleico se encuentra inmovilizado en las cámaras de reacción o sobre un soporte móvil.
27. Método según cualquiera de las reivindicaciones 24 a 26, en el que se produce pirofosfato como producto secundario de secuenciación.
28. Método según la reivindicación 27, en el que el pirofosfato se detecta mediante la puesta en contacto del producto secundario de secuenciación con una sulfurilasa bajo condiciones que permiten la formación de ATP.
29. Método según la reivindicación 28, en el que la sulfurilasa es un sulfurilasa termoestable.
30. Método según la reivindicación 27, que comprende además añadir apirasa para degradar los nucleótidos trifosfato no reaccionados.
31. Método según la reivindicación 27, que comprende además eliminar mediante lavado los reactivos de secuenciación difundibles, por ejemplo dNTPs no incorporado, con un tampón de lavado tras la administración de dichos reactivos de secuenciación.
32. Método según la reivindicación 31, en el que el tampón incluye apirasa.
33. Método según cualquiera de las reivindicaciones 24 a 32, en el que el diámetro de cada fibra óptica individual en la oblea cavitada de fibras ópticas es de entre6 y50 µm.
34. Método según la reivindicación 24 ó 25, en el que las cámaras de reacción presentan un espaciado de centro a centro de entre 10 µm y 200 µm.
35. Método según la reivindicación 34, en el que las cámaras de reacción presentan un espaciado de centro a centro de entre aproximadamente 50 µm y 150 µm.
36. Método según la reivindicación 34, en el que las cámaras de reacción presentan un espaciado de centro a centro de entre 100 µm y 150 µm.
37. Método según cualquiera de las reivindicaciones 24 a 36, en el que el medio de detección es una cámara CCD.
38. Método según cualquiera de las reivindicaciones 24 a 37, en el que la matriz presenta una superficie pulida de fibras ópticas enfrentada a la superficie cavitada de fibras ópticas, y en el que la superficie pulida permite el acoplamiento óptica a una segunda fibra óptica.
39. Método según cualquiera de las reivindicaciones 24 a 38, en el que la oblea cavitada de fibras ópticas se encuentra recubierta.
40. Método según la reivindicación 39, en el que el recubrimiento se selecciona de entre el grupo que consiste de plástico, capas de oro, reactivos organosilano, línkers fotorreactivos, geles de polímero hidrofílico y polímeros plurónicos, siendo los polímeros plurónicos específicamente adsorbidos a una superficie de poliestireno o de vidrio silanizado.
41. Método según cualquiera de las reivindicaciones 24 a 40, en el que el agente
- 87de secuenciación de pirofosfato es la luciferasa.
42. Método según cualquiera de las reivindicaciones 24 a 40, en el que el agente de secuenciación es la sulfurilasa.
Patentes similares o relacionadas:
Fitasa, del 6 de Mayo de 2020, de BASF Enzymes LLC: Un ácido nucleico aislado, recombinante o sintético que codifica un polipéptido que tiene actividad fitasa, en donde el ácido nucleico se selecciona del grupo que […]
Métodos de preparación de polinucleótidos usando composiciones de sales de catiónicas multivalentes, del 6 de Mayo de 2020, de GERON CORPORATION: Un método para preparar un polinucleótido, comprendiendo el método: a) poner en contacto una primera composición polinucleotídica con una sal catiónica […]
Preparación de muestras para la amplificación de ácidos nucleicos, del 8 de Abril de 2020, de ILLUMINA CAMBRIDGE LIMITED: Un método para preparar una muestra para la amplificación de bibliotecas y la amplificación posterior que comprende las siguientes etapas: (a) en una […]
Método para producir y purificar ARN, que comprende al menos una etapa de filtración de flujo tangencial, del 1 de Abril de 2020, de CureVac Real Estate GmbH: Método para producir y purificar ARN, que comprende las etapas de A) proporcionar ADN que codifica para el ARN; B) realizar la transcripción in vitro del […]
Método y composiciones para reducir productos de amplificación no específicos, del 25 de Marzo de 2020, de Paragon Genomics, Inc: Un método para reducir productos de amplificación no específicos de una reacción de extensión de cebadores dependiente de plantilla, comprendiendo el método: […]
Partículas de transducción no replicativas y sistemas indicadores basados en partículas de transducción, del 22 de Enero de 2020, de Geneweave Biosciences Inc: Un sistema de empaquetamiento de célula bacteriana para empaquetar una molécula de ácido nucleico indicadora en una partícula de transducción no […]
Composiciones terapéuticas y procedimientos que implican la transfección de ARNm, del 21 de Enero de 2020, de Herzberg, Mark C: ARNm que codifica un polipéptido implicado en la inmunidad innata, en el que el polipéptido es proteína antimicrobiana de catelicina (CAMP), calprotectina, […]
Fabricación y uso de ARN monocatenario sintetizado in vitro para introducción en células de mamífero para inducir un efecto biológico o bioquímico, del 4 de Diciembre de 2019, de CELLSCRIPT, LLC: Una composición de ARN tratado que comprende ARN monocatenario o ARNm sintetizado in vitro, en la que menos del 0,01 %, preferentemente menos del 0,001 […]