Antígenos de Chlamydia trachomatis para uso en vacuna y diagnóstico.
Uso de un polipéptido sustancialmente puro, que comprende una secuencia de aminoácidos seleccionada de
(a) SEQ ID NO.
1, o
(b) una porción inmunógena de la secuencia 5 indicada en (a), o
(c) una secuencia de aminoácidos análoga que tiene al menos 90% de identidad de secuencia con unacualquiera de las secuencias en (a) o (b) y es al mismo tiempo inmunógena, o el ácido nucleico codificante delos polipéptidos indicados en (a), (b) o (c), para preparación de una composición farmacéutica paraprevención o tratamiento de infecciones causadas por una bacteria de una especie de Chlamydia, en dondeel polipéptido está fusionado a una pareja de fusión.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2005/000651.
Solicitante: STATENS SERUMINSTITUT.
Nacionalidad solicitante: Dinamarca.
Dirección: ARTILLERIIVEJ 5 DK-2300 COPENHAGEN S DINAMARCA.
Inventor/es: ANDERSEN, PETER, LEAH, ROBERT, OLSEN,ANJA, THEISEN,MICHAEL, FOLLMANN,FRANK, JENSEN,KLAUS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/118 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Chlamydiaceae, p. ej. Chlamydia trachomatis o Chlamydia psittaci.
- C07K14/295 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Chlamydiales (O).
- C07K16/12 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales bacterianos.
- C12Q1/68 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- G01N33/569 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para microorganismos, p. ej. protozoarios, bacterias, virus.
PDF original: ES-2389562_T3.pdf
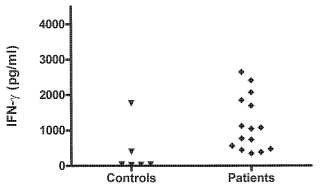
Fragmento de la descripción:
Antígenos de Chlamydia trachomatis para uso en vacuna y diagnóstico
Campo de la Invención
La presente invención describe el uso de polipéptidos inmunógenos y composiciones inmunógenas basadas en polipéptidos y ácido nucleico derivado de C. trachomatis como vacuna y agentes de diagnóstico.
Antecedentes Generales
Las especies Chlamydiales causan una extensa gama de enfermedades tanto en animales como en humanos. De particular importancia es C. trachomatis, una bacteria intracelular forzosa, que infecta y se multiplica en las células epiteliales. Es la causa más frecuente de enfermedad de transmisión sexual (STD) en los países desarrollados y es la causa más común de enfermedad oftálmica en los países en desarrollo (Schachter, Moncada et al. 1988) . Hay una cifra estimada de 92 millones de individuos que son portadores de la infección en todo el mundo (WHO, 1999) .
La duración de la STD por Chlamydia sin tratar es prolongada, y el aclaramiento completo no se consigue a menudo antes de los primeros 12 meses. Se cree que la inmunidad protectora inducida durante la infección es específica de serovariantes y de vida corta, permitiendo así re-infecciones frecuentes (Katz, Batteiger et al. 1987) . Estas circunstancias, el curso prolongado de la infección y las posibles re-infecciones pueden conducir al desarrollo de secuelas graves, con inclusión de enfermedad inflamatoria pélvica, infertilidad y embarazos ectópicos (Brunham 1999) .
La infección se controla eficazmente por terapia con antibióticos; sin embargo, la alta prevalencia de casos asintomáticos sugiere que el control sostenible de Chlamydia puede preverse únicamente si se desarrolla una vacuna eficaz contra Chlamydia. Si bien se han destinado muchos esfuerzos a una vacuna contra las infecciones de Chlamydia a lo largo de las últimas décadas, hasta ahora no se ha desarrollado ninguna vacuna.
Esto hace que el desarrollo de una vacuna contra Chlamydia sea una cuestión urgente. Se han realizado muchos intentos para definir sustancias protectoras contra Chlamydia; sin embargo, la demostración de una respuesta específica inmune protectora de larga duración no se ha conseguido todavía. A lo largo de las últimas décadas se han destinado muchos esfuerzos al desarrollo de una vacuna contra las infecciones por Chlamydia; sin embargo, hasta ahora no se ha desarrollado ninguna vacuna. Algunos de los primeros esfuerzos estuvieron enfocados en el control del tracoma, y se utilizaron organismos enteros viables o desactivados como el antígeno para inmunizar humanos y monos (Wang, Grayston et al. 1967; Grayston y Wang 1978) . Los niños vacunados con una vacuna de células enteras desactivadas daban como resultado protección inicial, pero la protección era serovar-específica y de vida corta (Grayston y Wang 1978) . Adicionalmente, la reinfección de los individuos parcialmente protegidos daba como resultado una enfermedad clínica que era más grave que la enfermedad existente en los controles no vacunados (Grayston y Wang 1978) . El hecho de que las pruebas iniciales con organismos enteros desactivados daban como resultado algunos casos de lo que parecía ser una reacción de hipersensibilidad impulsó los intentos para desarrollar vacunas subunitarias.
C. trachomatis contiene, al mismo tiempo que secreta, varias proteínas de potencial relevancia para la generación de una vacuna contra Chlamydia. Durante varios años, la investigación para moléculas candidato se han enfocado fundamentalmente en proteínas asociadas con la superficie de la forma infecciosa del Cuerpo Elemental (EB) . A pesar de la caracterización de un gran número de tales proteínas, sólo un número muy pequeño de éstas han demostrado provocar protección parcial como vacunas subunitarias en modelos animales. La primera molécula inmunógena descrita fue la proteína mayor de la membrana externa (MOMP) , y esta molécula ha sido estudiada por ello con gran detalle como vacuna candidata. Sin embargo, muchos intentos de inmunizar diferentes animales con MOMP extraída de C. trachomatis o preparaciones recombinantes han dado resultado variables (Su, Parnell et al. 1995; Pal, Barnhart et al. 1999; Zhang, Yang et al. 1999; Pal, Theodor et al. 2001; Shaw, Grund et al. 2002) . La razón para la ineficacia relativa de MOPM como vacuna no se conoce, pero puede ser resultado de adyuvantes o sistemas de suministro inadecuados o del uso de inmunógenos de MOMP que no mimetizan la estructura natural de la proteína (Pal, Theodor et al. 2001) .
Más recientemente, se han identificado varias otras moléculas inmunógenas ( (Hassell, Reynolds et al. 1993; Kubo y Stephens 2000; LaVerda, Albanese et al. 2000; Fling, Sutherland et al. 2001; Goodall, Yeo et al. 2001; Starnbach, Loomis et al. 2003) . La inmunidad a C. trachomatis se caracteriza por ciertos rasgos básicos; los linfocitos T sensibilizados específicamente median la protección (Su y Caldwell 19995; Morrison, Su et al. 2000; Morrison y Caldwell 2002) , y la molécula mediadora más importante parece ser el interferón gamma (IFNγ) (Morrison y Caldwell 2002) . Adicionalmente, anticuerpos de los isotipos IgG, IgM e IgA pueden jugar también un papel (Cotter, Meng et al. 1995) .
En 1995 Tripples et al (Tipples y McClarty 1995) aislaron el gen para la CTP-sintetasa y Gu et al. (Gu, Wenman et al. 1995) clonaron la región que rodea el gen para la subunidad alfa de la RNA-polimerasa. Esta región contiene
también genes para las proteínas SecY, S13, S11, y L17, que son equivalentes a proteínas de Escherichia coli y Bacillus subtilis. El 1997, se aisló el gen para el factor de elongación Ts (Zhang, Tao et al. 1997) .
En 1998, Stevens et al. publicaron la secuencia genómica completa de C. trachomatis y predijeron la presencia de aproximadamente 875 marcos de lectura abiertos. Entre otras, se describen secuencias de nucleótidos que comprenden CT442, CT460, CT509, CT579, CT587, CT713, CT812, o CT681 (MOMP) , y se sugieren secuencias proteínicas supuestas para las secuencias anteriores. Aunque es importante, esta información de secuencias no puede utilizarse para predecir si el DNA se transcribe y se traduce en proteínas in vivo.
Es todavía más importante que, sobre la base de las secuencias, no es posible predecir si una secuencia dada codificará una proteína inmunógena o inactiva. WO 9928475 describe la secuencia genómica completa de C. trachomatis, pero no proporciona evidencia alguna en apoyo de ningún efecto inmunógeno. Correspondientemente, WO 9927105 describe la secuencia genómica completa de C. pneumoniae.
La base de datos TREMBL, entrada 084047-CHLTR de 1 de noviembre de 1998 describe una proteína CT043 hipotética de Chlamydia trachomatis con una secuencia dada correspondiente a SEQ ID NO. 1 de la presente invención.
La única manera de determinar si una proteína es reconocida por el sistema inmunitario durante o después de una infección con C. trachomatis consiste en producir la proteína dada y testarla en un ensayo apropiado como se describe en esta memoria y determinar si es posible el fragmento o epítope que tiene un efecto inmunógeno.
Sumario de la invención
La invención se refiere a la prevención, tratamiento y detección de infecciones causadas por especies de Chlamydia
(C. trachomatis ssp y C. pneumonia) por el uso de un polipéptido que comprende un antígeno de C. trachomatis o una porción inmunógena u otra variante del mismo, o por el uso de una secuencia de DNA que codifica un antígeno de C. trachomatis o una porción inmunógena u otra variante del mismo.
Descripción detallada de la invención
La presente invención describe el uso de un polipéptido sustancialmente puro del antígeno de Chlamydia (polipéptidos o ácidos nucleicos) ctO43, o fragmentos (porción inmunógena, p.ej. un epítope de células T o células B) u homólogos de éstos para preparación de una composición farmacéutica para prevención o tratamiento o diagnóstico de infecciones causadas por una bacteria de las especies Chlamydia, en donde el polipéptido está fusionado a una pareja de fusión.
La presente invención describe también una composición farmacéutica en forma de una vacuna o un agente de diagnóstico.
El polipéptido utilizado para preparación de la composición farmacéutica puede estar lipidado para permitir un efecto auto-adyuvante y está fusionado a una pareja de fusión... [Seguir leyendo]
Reivindicaciones:
1. Uso de un polipéptido sustancialmente puro, que comprende una secuencia de aminoácidos seleccionada de
(a) SEQ ID NO. 1, o
(b) una porción inmunógena de la secuencia indicada en (a) , o
(c) una secuencia de aminoácidos análoga que tiene al menos 90% de identidad de secuencia con una cualquiera de las secuencias en (a) o (b) y es al mismo tiempo inmunógena, o el ácido nucleico codificante de los polipéptidos indicados en (a) , (b) o (c) , para preparación de una composición farmacéutica para prevención o tratamiento de infecciones causadas por una bacteria de una especie de Chlamydia, en donde el polipéptido está fusionado a una pareja de fusión.
2. Uso de acuerdo con la reivindicación 1, en donde el polipéptido está lipidado a fin de permitir un efecto autoadyuvante del polipéptido.
3. Uso de acuerdo con cualquiera de las reivindicaciones 1-2, en donde la pareja de fusión comprende
(a) un polipéptido derivado de una especie de Chlamydia, o
(b) al menos una porción inmunógena de cualquiera de tales polipéptidos indicados en (a) .
4. Uso de acuerdo con cualquiera de las reivindicaciones 1-2, en donde la secuencia de ácido nucleico que codifica el polipéptido indicado en (a) tiene la secuencia correspondiente siguiente: SEQ ID NO 2.
5. Una composición farmacéutica para uso a fin de prevenir o tratar infecciones causadas por una bacteria de las especies Chlamydia, que comprende un polipéptido sustancialmente puro, que comprende una secuencia de aminoácidos seleccionada de
(a) SEQ ID NO. 1, o
(b) una porción inmunógena de la secuencia indicada en (a) ; y/o
(c) una secuencia de aminoácidos análoga que tiene al menos 90% de identidad de secuencia con una cualquiera de las secuencias indicadas en (a) o (b) y que es al mismo tiempo inmunógena, o el ácido nucleico codificante de (a) , (b) o (c) , en donde el polipéptido está fusionado a una pareja de fusión.
6. Una composición farmacéutica para uso de acuerdo con la reivindicación 5, en donde el polipéptido está lipidado a fin de permitir un efecto auto-adyuvante del polipéptido.
7. Una composición farmacéutica para uso de acuerdo con la reivindicación 5, en donde la pareja de fusión comprende
(a) un polipéptido derivado de una especie de Chlamydia, o
(b) al menos una porción inmunógena de cualquiera de tales polipéptidos indicados en (a) , o el ácido nucleico que codifica los mismos.
8. Una composición farmacéutica para uso de acuerdo con la reivindicación 5, en donde las secuencias de ácido nucleico que codifican los polipéptidos indicados en (a) tiene la secuencia correspondiente siguiente: SEQ ID NO. 2.
9. Una composición farmacéutica para uso de acuerdo con la reivindicación 5-8, que se encuentra en la forma de una vacuna.
10. Una vacuna de acuerdo con la reivindicación 9 para uso en la inmunización contra o el tratamiento de infecciones causadas por una bacteria de una especie de Chlamydia.
11. Una vacuna para uso de acuerdo con la reivindicación 10, en donde la especie de Chlamydia es C. trachomatis.
12. Un anticuerpo monoclonal que reacciona específicamente con una secuencia de aminoácidos seleccionada de:
(a) SEQ ID NO. 1, o
(b) una porción inmunógena de la secuencia indicada en (a) ; y/o
(c) una secuencia de aminoácidos análoga que tiene al menos 90% de identidad de secuencia con una cualquiera de las secuencias indicadas en (a) o (b) y que es al mismo tiempo inmunógena en un inmunoensayo o un fragmento de fijación específico de dicho anticuerpo.
13. Un método para diagnóstico de infección previa o en curso con una bacteria de una especie de Chlamydia, comprendiendo dicho método poner en contacto una muestra con un reactivo de diagnóstico a fin de detectar una reacción positiva, en donde dicho reactivo de diagnóstico comprende un polipéptido sustancialmente puro, que comprende una secuencia de aminoácidos seleccionada de
(a) SEQ ID NO. 1, o
(b) una porción inmunógena de la secuencia indicada en (a) , o
(c) una secuencia de aminoácidos análoga que tiene al menos 90% de identidad de secuencia con una cualquiera de las secuencias indicadas en (a) o (b) y que es al mismo tiempo inmunógena, o el ácido nucleico codificante de los polipéptidos indicados en (a) , (b) o (c) .
14. Un método para diagnóstico de infección previa o en curso con una bacteria de una especie de Chlamydia, comprendiendo dicho método
(a) poner en contacto una muestra con un anticuerpo de acuerdo con la reivindicación 12 a fin de detectar una reacción positiva en caso de infección.
15. Un método in vitro de diagnóstico de una infección previa o en curso con una bacteria y una especie de Chlamydia en un individuo que comprende:
(a) poner en contacto un reactivo de diagnóstico con un fluido corporal del individuo, en donde dicho reactivo de diagnóstico comprende un polipéptido sustancialmente puro, que comprende una secuencia de aminoácidos seleccionada de:
(1) SEQ ID NO. 1, o
(2) una porción inmunógena de la secuencia indicada en (1) , o
(3) una secuencia de aminoácidos análoga que tiene al menos 90% de identidad de secuencia con una cualquiera de las secuencias indicadas en (1) o (2) y que es al mismo tiempo inmunógena, o el ácido nucleico codificante de los polipéptidos indicados en (1) , (2) o (3) ;
(b) detectar la fijación de un anticuerpo a dicho polipéptido, siendo dicha fijación una indicación de que dicho individuo está infectado por una bacteria de una especie de Chlamydia.
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Ensayo de toxina botulínica con sensibilidad mejorada, del 1 de Julio de 2020, de BioMadison, Inc: Un método para aumentar la sensibilidad de la detección basada en células de una toxina botulínica, que comprende: (i) proporcionar una célula […]
Bebidas energéticas y otras ayudas nutricionales derivadas de licores a base de agave, del 1 de Julio de 2020, de Roar Holding, LLC: Una composición que comprende compuestos inhibidores de monoamino oxidasa (MAO), cuya composición se prepara mediante la eliminación de etanol de una bebida […]
Evaluación asistida del pronóstico en la enfermedad inflamatoria, del 24 de Junio de 2020, de KINGS COLLEGE LONDON: Un método in vitro de recopilación de información útil para predecir el resultado clínico en un sujeto, en donde el sujeto tiene o se sospecha que tiene una enfermedad […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.
Marcadores celulares para el diagnóstico de la enfermedad de Alzheimer y para la progresión de la enfermedad de Alzheimer, del 17 de Junio de 2020, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: Un método para el diagnóstico de la probabilidad de la enfermedad de Alzheimer (EA) en un individuo examinado, que comprende: (i) medir los […]
Biomarcadores de TB, del 22 de Abril de 2020, de United Kingdom Research and Innovation: Un método para el diagnóstico de TB en un sujeto, comprendiendo el método: (a) proporcionar una muestra de dicho sujeto, siendo dicha muestra seleccionada […]
Procedimiento para detectar bacterias coliformes contenidas en la leche, del 15 de Abril de 2020, de ASAHI KASEI KABUSHIKI KAISHA: Procedimiento para lisar bacterias coliformes contenidas en la leche, que comprende la etapa de mezclar un agente de lisis que contiene lisozima, un surfactante aniónico […]