ANTIGENOS DE B. PERTUSSIS Y USO DE LOS MISMOS EN VACUNACION.
Una composición inmunogénica que comprende FHA y toxina pertúsica y que comprende además un polipéptido que comprende
a)una secuencia de aminoácidos que tiene una identidad de al menos el 85% con la secuencia de aminoácidos de la SEC ID Nº:
34, a lo largo de la longitud completa de la SEC ID Nº: 34, o
b)un fragmento inmunogénico que tiene al menos 15 aminoácidos contiguos de la SEC ID Nº: 34,
y un excipiente farmacéuticamente aceptable
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/011082.
Solicitante: GLAXOSMITHKLINE BIOLOGICALS S.A..
Nacionalidad solicitante: Bélgica.
Dirección: RUE DE L'INSTITUT 89,1330 RIXENSART.
Inventor/es: DENOEL, PHILIPPE, POOLMAN, JAN, CASTADO,CINDY, GODFROID,FABRICE.
Fecha de Publicación: .
Fecha Concesión Europea: 21 de Julio de 2010.
Clasificación Internacional de Patentes:
- A61K39/10B
Clasificación PCT:
- A61K39/10 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Brucella; Bordetella, p. ej. Bordetella pertussis.
Clasificación antigua:
- A61K39/10 A61K 39/00 […] › Brucella; Bordetella, p. ej. Bordetella pertussis.
Fragmento de la descripción:
Antígenos de B. pertussis y uso de los mismos en vacunación.
Campo de la invención
La presente invención se refiere a polinucleótidos (en lo sucesivo en el presente documento denominados "polinucleótido o polinucleótidos de BASB232"), polipéptidos que los codifican (denominados en el presente documento "BASB232" o "polipéptido o polipéptidos de BASB232"), materiales recombinantes y procedimientos para su producción. En particular, la invención se refiere a composiciones inmunogénicas y vacunas que contienen polipéptidos o nucleótidos individuales o combinaciones ventajosas de los mismos. En otro aspecto de la invención, la invención se refiere a procedimientos para usar dichos polipéptidos y polinucleótidos para el tratamiento o la prevención de infecciones por Bordetella. En un aspecto adicional, la invención se refiere a ensayos de diagnóstico para detectar una infección por Bordetella.
Antecedentes de la invención
La bacteria Bordetella pertussis es el agente causal para la tos ferina, una enfermedad respiratoria que puede ser grave en lactantes y niños pequeños. El curso clínico de la enfermedad se caracteriza por paroxismos de toses rápidas seguidos de esfuerzo inspiratorio, con frecuencia asociado con un sonido de "tos ferina" característico. En casos graves, la falta de oxígeno puede conducir a daño cerebral, sin embargo la complicación más común es la neumonía secundaria.
La tos ferina se considera habitualmente que está causada por B. pertussis, pero ocasionalmente se aísla B. parapertussis de pacientes con signos típicos y síntomas de tos ferina. La infección por B. parapertussis es de menor frecuencia que la de B. pertussis, estando el 5-10% de la tos ferina asociada con B. parapertussis (Mertsola (1985) Eur J Clin Microbiol 4; 123; Lautrop (1971) Lancet 1 (7711) 1195-1198). B. parapertussis se asocia con síntomas clínicos leves que, combinados con su reactividad cruzada serológica con B. pertussis, hacen que B. parapertussis sea difícil de diagnosticar.
La primera generación de vacunas contra B. pertussis eran vacunas de células completas, compuestas por bacterias completas muertas. Éstas se introdujeron en muchos países en los años 50 y 60 y tuvieron éxito reduciendo la incidencia de la tos ferina. Un problema con la vacunas de B. pertussis de célula completa es el alto nivel de reactogenicidad asociado con las mismas. Las vacunas acelulares que contienen proteínas de B. pertussis purificadas son menos reactogénicas y se han adoptado para los programas de vacunación de muchos países. Las vacunas acelulares, que contienen típicamente toxina pertúsica (PT), hemaglutinina filamentosa (FHA) y muy frecuentemente pertactina (PRN), se usan ampliamente y proporcionan una protección eficaz frente a la gravedad de la tos ferina. Oliver y col. divulgan una composición inmunogénica que comprende proteína Brka recombinante que se usa para generar anticuerpos policlonales en conejos (VACCINE, vol. 20, 2002, páginas 235-241). Además, el documento US 5885587 (Eckhardt y col) describe "vacunas eficaces contra Bordetella pertussis que comprenden una combinación de antígenos pertúsicos purificados individualmente".
A pesar de la vacunación, la tos ferina continúa siendo una enfermedad endémica (Mooi y col (2001) Emerging Infectious Diseases 7; 526). La tos ferina ha resurgido en Australia, Canadá y Países Bajos; países con poblaciones altamente vacunadas. Una comparación de cepas prevacunación con cepas aisladas recientemente ha demostrado una deriva antigénica, particularmente en PT y PRN (Mooi y col (1998 Infection and Immunity 66; 670). Está ampliamente reconocido que las vacunas actuales protegen frente a la enfermedad grave, pero no eliminan Bordetella pertussis del cuerpo (Cherry y col (1998) Vaccine 16; 1901, Hewlett y Halperin (1998) Vaccine 16; 1889, Storsaeter y col (1998) Vaccine 16; 1907). Los mecanismos de defensa de Bordetella pertussis permiten que evite su eliminación del cuerpo, indicando que las vacunas actuales no inutilizan completamente estos mecanismos de defensa.
La vacunación usando vacunas de B. pertussis de células completas (Pw) parece proteger frente a la infección por B. parapertussis, probablemente debido a la similitud de las dos bacterias. La infección por B. parapertussis en lactantes no vacunados puede conducir a complicaciones graves y mortales, mientras que en individuos vacunados con Pw, se observa un curso más leve, con frecuencia subclínico, de tos ferina (Long y col (1990) Pediatric Infect Dis J 9; 700). Teóricamente, la introducción de vacunas antitosferínicas acelulares que contienen sólo dos o tres proteínas purificadas podría reducir la capacidad de la vacunación para proteger frente a B. parapertussis.
Por consiguiente, son necesarias vacunas acelulares mejoradas adicionalmente contra la tos ferina que combinen una baja reactogenicidad con una capacidad para generar una respuesta protectora frente a la infección por Bordetella, particularmente tanto B. pertussis como B. parapertussis. La identificación de nuevos antígenos candidato y combinaciones particularmente eficaces de antígenos permitirá el desarrollo de dichas vacunas.
Sumario de la invención
La presente invención se refiere a la <reivindicación 1> y a la <reivindicación 6>. En otro aspecto, la invención se refiere a procedimientos para usar dichas composiciones inmunogénicas, incluyendo la prevención y el tratamiento de enfermedades por Bordetella, entre otras. En un aspecto adicional, la divulgación se refiere a ensayos de diagnóstico para detectar enfermedades asociadas con infecciones microbianas y afecciones asociadas con dichas infecciones, tales como ensayos para detectar la expresión o actividad de polinucleótidos o polipéptidos de BASB232.
Descripción de las figuras
Figura 1 - es una gráfica que muestra la protección frente a la exposición a B. pertussis cepa Tohama en grupos de ratones preinmunizados con vehículo DT BrkA, DTPa-2, DTPa-2 BrkA, DTPa-3 o DTPa-3 BrkA. Los resultados se expresan como el número de UFC aisladas por pulmón a diferentes puntos temporales después de la exposición. Pa-2 es una combinación de toxina pertúsica y FHA, mientras que Pa-3 es una combinación de toxina pertúsica, FHA y pertactina.
Figura 2 - es una gráfica que muestra la protección frente a la exposición a B. pertussis cepa 18323 en grupos de ratones preinmunizados con vehículo DT BrkA, DTPa-2, DTPa-2 BrkA, DTPa-3 o DTPa-3 BrkA. Los resultados se expresan como el número de UFC aisladas por pulmón a diferentes puntos temporales después de la exposi- ción.
Figura 3 - gráficas que muestran la protección frente a la exposición a B. pertussis o B. parapertussis en grupos de ratones preinmunizados con DTPw o DTPa de varias fuentes. Los resultados se expresan como el número de UFC aisladas del pulmón a diferentes puntos temporales después de la exposición.
Figura 4 - gráficas que muestran la protección frente a B. parapertussis por anticuerpos contra B. pertussis de célula completa. El panel A muestra protección activa frente a B. parapertussis después de la inmunización de ratones con vacuna DTPw. El panel B muestra una protección pasiva frente a B. parapertussis por antisueros generados contra DTPw.
Figura 5 - alineamiento del SDS-PAGE de OMP de B. parapertussis y la transferencia de Western correspondiente tratada con sueros generados contra B. pertussis (DTPw). El tampón de procesamiento usado para estos geles era MES. El alineamiento se realizó usando patrones de peso molecular preteñidos como puntos de referencia.
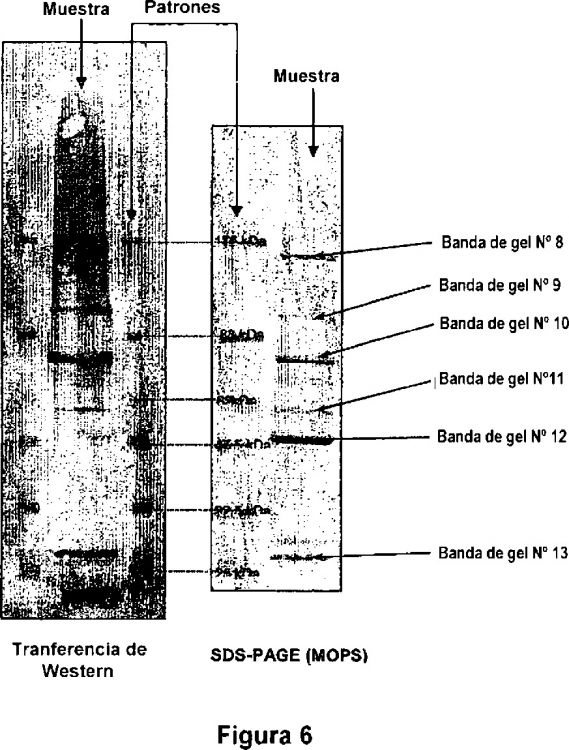
Figura 6 - alineamiento del SDS-PAGE de OMP de B. parapertussis y la transferencia de Western correspondiente tratada con sueros generados contra B. pertussis (DTPw). El tampón de procesamiento usado pare estos geles era MOPS. El alineamiento se realizó usando patrones de peso molecular preteñidos como puntos de referencia.
Descripción de la invención
La invención se refiere a polipéptidos de BASB232, como se describen con mayor detalle a continuación. En particular, la invención se refiere a polipéptidos de BASB232 de B. pertussis comprendidos en composiciones inmunogénicas. La invención se refiere especialmente a los polipéptidos de BASB232 enumerados en la tabla 1. Esos polinucleótidos y polipéptidos...
Reivindicaciones:
1. Una composición inmunogénica que comprende FHA y toxina pertúsica y que comprende además un polipéptido que comprende
y un excipiente farmacéuticamente aceptable.
2. La composición inmunogénica de acuerdo con la reivindicación 1, en la que el polipéptido comprende una secuencia de aminoácidos que tiene una identidad de al menos el 95% con la secuencia de aminoácidos de la SEC ID Nº: 34, a lo largo de la longitud completa de dicha secuencia de la SEC ID Nº: 34, o un fragmento inmunogénico de la misma, en la que el fragmento inmunogénico tiene al menos 15 aminoácidos contiguos de la SEC ID Nº: 34.
3. La composición inmunogénica de acuerdo con la reivindicación 1, en la que el polipéptido comprende la secuencia de aminoácidos de la SEC ID Nº: 34, o un fragmento inmunogénico de la misma, en la que el fragmento inmunogénico tiene al menos 15 aminoácidos contiguos de la SEC ID Nº: 34.
4. La composición inmunogénica de las reivindicaciones 1-3, en la que el polipéptido comprende una secuencia de aminoácidos que es un fragmento inmunogénico del polipéptido de la SEC ID Nº: 34, en la que dicho fragmento inmunogénico tiene al menos 15 aminoácidos contiguos de la SEC ID Nº: 34 y es capaz de generar una respuesta inmune que reconoce el polipéptido de la SEC ID Nº: 34.
5. La composición inmunogénica de acuerdo con cualquiera de las reivindicaciones 1 a 4, en la que dicho polipéptido es parte de una proteína de fusión de mayor tamaño.
6. Una composición inmunogénica que comprende
y al menos, o exactamente, un antígeno o antígenos de Bordetella diferentes, en la que el antígeno o antígenos se seleccionan de al menos un grupo o grupos de proteínas seleccionadas de las siguientes:
7. La composición inmunogénica de la reivindicación 6, que comprende una o más proteínas de adquisición de hierro de Bordetella seleccionadas del grupo constituido por los polipéptidos que comparten una identidad de al menos el 70% con la SEC ID Nº: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26 ó 28, o que comprenden un fragmento antigénico de al menos 15 aminoácidos contiguos de la SEC ID Nº: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26 ó 28.
8. La composición inmunogénica de la reivindicación 6 ó 7, que comprende una lipoproteína de Bordetella seleccionada del grupo constituido por BipA, compartiendo el polipéptido una identidad de al menos el 70% con la SEC ID Nº: 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96 ó 98, o que comprenden un fragmento antigénico de al menos 15 aminoácidos contiguos de la SEC ID Nº:56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96 ó 98.
9. La composición inmunogénica de las reivindicaciones 6-8, que comprende una adhesina de Bordetella seleccionada del grupo constituido por fimbrias y pertactina.
10. La composición inmunogénica de la reivindicación 9, en la que la adhesina de Bordetella es la fimbria 2 y/o 3.
11. La composición inmunogénica de las reivindicaciones 6-10, que comprende una toxina/invasina de Bordetella o antígenos implicados en la secreción de toxina/invasina seleccionados del grupo constituido por adenilato ciclasa, toxina dermonecrótica (dnt), Tipo III ss o lipopolisacárido (LPS).
12. La composición inmunogénica de las reivindicación 11, en la que la toxina/invasina de Bordetella o el antígeno implicado en la secreción de toxina/invasina es LPS.
13. La composición inmunogénica de las reivindicaciones 6-12, que comprende a) FHA, b) toxina pertúsica y c) adenilato ciclasa.
14. La composición inmunogénica de las reivindicaciones 1-13 para la prevención o tratamiento de una infección por Bordetella pertussis.
15. La composición inmunogénica de las reivindicaciones 1-14 para la prevención o tratamiento de una infección por Bordetella parapertussis.
16. La composición inmunogénica de las reivindicaciones 1-15 para la prevención o tratamiento de una infección por Bordetella bronchiseptica.
17. La composición inmunogénica de las reivindicaciones 1-16, que comprende un polipéptido que se expresa durante la fase Bvg+ temprana de la infección por Bordetella.
18. La composición inmunogénica de las reivindicaciones 1-17, que comprende un polipéptido que se expresa durante la fase Bvg+ tardía de la infección por Bordetella.
19. La composición inmunogénica de las reivindicaciones 1-18, que comprende un polipéptido que se expresa durante la fase Bvgi de la infección por Bordetella.
20. La composición inmunogénica de las reivindicaciones 1-19, que comprende un antígeno que se expresa durante la fase Bvg- de la infección por Bordetella.
21. La composición inmunogénica de las reivindicaciones 1-20, que comprende además toxoide diftérico y toxoide tetánico.
22. La composición inmunogénica de las reivindicaciones 1-21, que comprende además oligosacárido o polisacárido capsular PRP de Haemophilus influenzae b.
23. La composición inmunogénica de la reivindicaciones 1-22, que comprende además antígeno superficial de hepatitis B (HbsAg).
24. La composición inmunogénica de las reivindicaciones 1-23, que comprende además vacuna de la polio inactivada (IPV).
25. La composición inmunogénica de las reivindicaciones 1-24, que comprende además uno o más de polisacáridos u oligosacáridos capsulares A, C, W o Y de seres humanos.
26. La composición inmunogénica de las reivindicaciones 1-25, que comprende además una proteína de N. meningitidis serogrupo B.
27. La composición inmunogénica de las reivindicaciones 1-26, que comprende además uno o más polisacáridos u oligosacáridos capsulares de S. pneumoniae.
28. La composición inmunogénica de las reivindicaciones 1-27, que comprende además virus de la Hepatitis A atenuado muerto.
29. Una vacuna que comprende la composición inmunogénica de la reivindicación 1-28.
30. La vacuna de la reivindicación 29, que comprende un adyuvante.
31. Uso de la composición inmunogénica de las reivindicaciones 1-28 en la preparación de un medicamento para su uso en el tratamiento o la prevención de una enfermedad por Bordetella.
32. El uso de la reivindicación 31 en la preparación de un medicamento para su uso en el tratamiento o la prevención tanto de una enfermedad por B. pertussis como por B. parapertussis.
Patentes similares o relacionadas:
 VACUNAS CONTRA LA TOS FERINA ACELULARES Y PROCEDIMIENTOS DE PREPARACIÓN DE LAS MISMAS, del 27 de Mayo de 2011, de SANOFI PASTEUR LIMITED: Utilización de la forma purificada de toxoide de la tos ferina, hemoaglutinina filamentosa, pertactina y aglutinógenos fimbriales de B. pertussis […]
VACUNAS CONTRA LA TOS FERINA ACELULARES Y PROCEDIMIENTOS DE PREPARACIÓN DE LAS MISMAS, del 27 de Mayo de 2011, de SANOFI PASTEUR LIMITED: Utilización de la forma purificada de toxoide de la tos ferina, hemoaglutinina filamentosa, pertactina y aglutinógenos fimbriales de B. pertussis […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
DERIVADOS DE OLIGOSACÁRIDOS SINTÉTICOS COMO VACUNA CONTRA BORDETELLA PERTUSSIS, del 2 de Julio de 2020, de INSTITUTO FINLAY DE VACUNAS: La presente invención proporciona fragmentos de oligosacáridos sintéticos provenientes del pentasacárido terminal del lipooligosacárido de Bordetella pertussis, un método […]
Una vacuna para usar contra la infección asintomática por Lawsonia en un cerdo, del 6 de Mayo de 2020, de INTERVET INTERNATIONAL B.V: Una vacuna que comprende antígeno de Lawsonia intracellularis no vivo y un vehículo farmacéuticamente aceptable para usar en un método para reducir […]
Composiciones de vacunas contra el síndrome reproductivo y respiratorio porcino y las enfermedades asociadas al circovirus porcino, del 29 de Abril de 2020, de Reber Genetics Co., Ltd: Una proteína de fusión que comprende: (a) un dominio de unión a células presentadoras de antígeno (APC) ubicado en el N-terminal de la proteína de fusión, en la […]
Cepas bacterianas que expresan genes de metilasa y sus usos, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una bacteria aislada para usar en la producción de ADN plasmídico metilado, en donde la bacteria comprende un polinucleótido exógeno que codifica una CpG metilasa […]
Efecto de una cepa de Bordetella atenuada contra enfermedades alérgicas, del 1 de Enero de 2020, de NATIONAL UNIVERSITY OF SINGAPORE: Una cepa mutada de Bordetella pertussis para su uso en la obtención de inmunidad protectora contra una enfermedad alérgica de la piel, en la que la cepa está atenuada y en […]
Anticuerpos de tos ferina humanizados y usos de los mismos, del 18 de Septiembre de 2019, de BOARD OF REGENTS THE UNIVERSITY OF TEXAS SYSTEM: Un anticuerpo 1B7 humanizado que se une a una proteína de toxina pertussis, que comprende una región variable de cadena pesada de inmunoglobulina […]