ANTICUERPOS SELECTIVOS DE PROTOFIBRILLAS MEJORADOS Y SU USO.
Un anticuerpo o fragmento del mismo que es selectivo y que tiene una elevada afinidad por protofibrillas Aβ
humanas, en el que el anticuerpo o el fragmento en sus seis regiones CDR posee las siguientes secuencias consenso:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/SE2007/000292.
Solicitante: BioArctic Neuroscience AB.
Nacionalidad solicitante: Suecia.
Dirección: Warfvinges väg 39 112 51 Stockholm.
Inventor/es: GELLERFORS, PAR, LANNFELT,Lars, SEHLIN,Dag, EKHOLM PETTERSSON,Frida, ENGLUND,Hillevi.
Fecha de Publicación: .
Fecha Solicitud PCT: 23 de Marzo de 2007.
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P25/28 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › de los problemas neurodegenerativos del sistema nervioso central, p. ej. noótropos, activadores del conocimiento, medicamentos para el tratamiento del Alzheimer o de otras formas de demencia.
- C07K16/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356159_T3.pdf



Fragmento de la descripción:
Anticuerpos selectivos de protofibrillas mejorados y su uso.
Campo de la invención
Esta invención se refiere a la prevención, tratamiento y diagnóstico de enfermedades neurodegenerativas, en particular enfermedad de Alzheimer y otras enfermedades similares. Más exactamente, a anticuerpos de elevada afinidad 10-7 M, preferiblemente 10-8 M, incluso menos de 10-9 M o menos de 10-10 M o 10-11 M, selectivos para la proteína beta amiloide (Aβ) en su conformación protofibrilar y de clase IgG y subclases IgG1 o IgG4 o sus combinaciones o sus mutaciones, que conservan elevada unión al receptor de Fc y baja unión a C1 (C1q), eficaces en la eliminación de protofibrillas Aβ y con riesgo de inflamación reducido.
Antecedentes
La enfermedad de Alzheimer (AD) es una enfermedad neurodegenerativa progresiva e irreversible que causa trastornos cognitivos, de memoria y de comportamiento. Es la causa más común de demencia en la población de la tercera edad que afecta aproximadamente al 5% de la población mayor de 65 años y al 20% mayor de 80 años. La AD se caracteriza por la aparición gradual y deterioro progresivo en múltiples funciones cognitivas. La neuropatología implica depósitos proteináceos argirófilos extracelulares e intracelulares. Los depósitos extracelulares, denominados placas neuríticas, consisten principalmente en proteína beta amiloide (Aβ) rodeada de neuritas distróficas (procesos neuronales inflamatorios, deformados). En el interior de estos depósitos extracelulares la Aβ tiene un carácter fibrilar con una estructura de lámina β plegada. En estos depósitos la Aβ puede teñirse con diferentes colorantes, por ejemplo, rojo Congo, y muestra una ultra estructura fibrilar. Estas características, adoptadas por la Aβ en su estructura fibrilar en placas neuríticas, son la definición del término genérico amiloide. La clásica lesión patológica intracelular de la AD es el ovillo neurofibrilar (NFT) que consiste en estructuras filamentosas denominadas filamentos helicoidales pareados (PHF), compuestos por cadenas retorcidas de proteína tau hiperfosforilada asociada a microtúbulos. Las placas neuríticas y los depósitos en ovillo neurofibrilares frecuentes en el cerebro son criterios de diagnóstico para la AD, según autopsias realizadas. Cerebros con AD también presentan atrofia cerebral macroscópica, pérdida de neuronas, inflamación local (microgliosis y astrocitosis) y a menudo angiopatia amiloide cerebral (CAA) en las paredes de los vasos cerebrales.
En la AD, las placas neuríticas presentan dos formas de péptidos Aβ, como especies dominantes, Aβ40 y Aβ42, siendo la Aβ40 la especie destacada en el amiloide cerebrovascular asociada con la AD. Las actividades enzimáticas permiten que la Aβ se forme de manera continua a partir de una proteína más grande denominada proteína precursora amiloide (APP) tanto en individuos sanos como en individuos que padecen la AD en todas las células del cuerpo. Dos eventos principales de procesamiento de la APP mediante actividades β y γ-secretasa permiten la producción de Aβ, mientras que una tercera enzima denominada α-secretasa, impide la generación de Aβ por escisión dentro de la secuencia Aβ (Selkoe, 1994; Ester 2001; US5604102). La Aβ42 es un péptido de cuarenta y dos aminoácidos de longitud, es decir, una longitud de dos aminoácidos más en el extremo C- terminal, en comparación con la Aβ40. La Aβ42 es más hidrófoba y se agrega más fácilmente dentro de estructuras más largas de péptidos de Aβ (Jarret 1993) tales como dímeros Aβ, trímeros Aβ, tetrámeros Aβ, oligómeros Aβ, protofibrillas Aβ o fibrillas Aβ. Las fibrillas Aβ son hidrófobas e insolubles, mientras que las otras estructuras son menos hidrófobas y solubles. Todas estas estructuras moleculares más grandes de péptidos Aβ se definen individualmente basándose en su aspecto biofísico y estructural, por ejemplo, a microscopia electrónica y sus características bioquímicas, por ejemplo, por análisis con cromatografía de exclusión por tamaño/transferencia de Western. Estos péptidos Aβ, particularmente Aβ42, se ensamblarán gradualmente dentro de una diversidad de estructuras moleculares más grandes de Aβ durante el periodo de vida. La AD, que es un trastorno fuertemente dependiente de la edad, se producirá en etapas tempranas de la vida si este proceso de ensamblaje se produce más rápidamente. Éste es el fundamento de la "hipótesis de la cascada amiloide" de la AD que reivindica que el procesamiento de la APP, los niveles de Aβ42 y su ensamblaje en estructuras moleculares mas grandes son una causa central de la AD. El resto de neuropatologías de cerebros con AD y los síntomas de la AD, tales como demencia, están de alguna manera producidos por la Aβ o sus formas ensambladas.
La Aβ puede tener diferentes longitudes, es decir, 1-39, 1-40, 1-42 y 1-43 y tamaños de fragmentos, es decir, 1-28 y 25-35. Los truncamientos pueden producirse en el extremo N del péptido. Todos estos péptidos pueden agregarse y formar intermedios solubles y fibrillas insolubles, teniendo cada forma molecular una conformación estructural y propiedades biofísicas únicas. Por ejemplo, la Aβ1-42 monomérica, es un péptido de 42 aminoácidos de longitud soluble y no tóxico, que se supone que está implicado en las funciones normales de sinapsis. En determinadas condiciones, la Aβ1-42 puede agregarse en dímeros, trímeros, tetrámeros, pentámeros hasta 12 oligómeros y formas oligoméricas más grandes, todas con sus propiedades fisicoquímicas diferentes tales como tamaño molecular, estructura EM y forma molecular AFM (microscopio de fuerzas atómicas). Un ejemplo de una forma Aβ oligomérica soluble de mayor peso molecular es la protofibrilla (Walsh 1997), que tiene un peso molecular aparente > 100 kDa y una estructura curvilínea de 4-11 nm de diámetro y < 200 nm de longitud. Recientemente se ha demostrado que los péptidos Aβ oligoméricos solubles tales como protofibrillas Aβ perjudican la potenciación a largo plazo (LTP) una medida de la plasticidad sináptica que se cree que refleja la formación de memoria en el hipocampo (Walsh 2002). Por otro lado, los péptidos Aβ Árticos oligoméricos presentan efecto inhibidor mucho más profundo que los Aβts (de tipo silvestre) en la LTP en el cerebro, probablemente debido a su fuerte tendencia para formar protofibrillas Aβ (Klyubin 2003).
Además existen otras formas oligoméricas solubles descritas en la bibliografía que son claramente diferentes de las protofibrillas. Una de dichas formas oligoméricas es el ADDL (Ligando Difusible Derivado de Amiloides) (Lambert 1998). Análisis AFM del ADDL revelaron especies globulares predominantemente pequeñas de 4,7-6,2 nm a lo largo del eje z con pesos moleculares de 17-42 kDa (Stine 1996). Otra forma se denomina ASPD (esferas amiloides) (Hoshi 2003). Las ASPD son oligómeros esféricos de Aβ1-40. Estudios de toxicidad demostraron que las ASPD esféricas > 10 nm eran más tóxicas que las formas moleculares más pequeñas (Hoshi 2003). Esta idea ganó apoyo a partir del reciente descubrimiento de la mutación Ártica de la APP (E693), que produce aparición temprana de la AD (documento US 2002/0162129 A1; Nilsberth et al., 2001). La mutación se localiza dentro de la secuencia peptídica de la Aβ. Los transportadores de la mutación generarán por lo tanto variantes de péptidos de Aβ, por ejemplo Aβ40 Ártica y Aβ42 Ártica. Tanto la Aβ40 Ártica como la Aβ42 Ártica se ensamblarán mucho más fácilmente dentro de estructuras moleculares más grandes, es decir, protofibrillas. Por tanto, el mecanismo patógeno de la mutación Ártica sugiere que las protofibrillas solubles de moléculas más grandes son causantes de la AD y contienen un epítopo específico único, es decir, "el epítopo de la enfermedad de AD".
En el cerebro que presenta la enfermedad de Alzheimer (AD), las placas amiloides extracelulares se encuentran típicamente en el parénquima y en las paredes de los vasos. Las placas están compuestas de amiloide (péptidos auto-agregantes e hidrófobos de Aβ de 38-43 aminoácidos de longitud) que se polimerizan gradualmente antes de la deposición de la placa. Se ha propuesto que especies oligoméricas de Aβ solubles se correlacionan mejor con la enfermedad que las propias placas amiloides (McLean et al., 1999; Näslund et al., 2000).... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo o fragmento del mismo que es selectivo y que tiene una elevada afinidad por protofibrillas Aβ humanas, en el que el anticuerpo o el fragmento en sus seis regiones CDR posee las siguientes secuencias consenso:

2. El anticuerpo de acuerdo con la reivindicación 1, en el que dicho anticuerpo es monoclonal.
3. El anticuerpo de acuerdo con la reivindicación 1 o 2, en el que el aminoácido prolina en la posición 331 en la IgG1 humana se cambia por serina o por otro aminoácido polar.
4. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que dicho anticuerpo es de la clase IgG.
5. El anticuerpo de acuerdo con la reivindicación 4, en el que dicho anticuerpo es de la subclase IgG1 o IgG4.
6. El anticuerpo de acuerdo con la reivindicación 5, en el que dicho anticuerpo es una quimera de las subclases IgG1 e IgG4, en el que la región constante de cadena pesada CH2 o una parte de CH2 es de IgG4 y las regiones CH1 y CH3 son de IgG1.
7. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que dicho anticuerpo comprende la secuencia completa de aminoácidos de cadena pesada de acuerdo con la Tabla 31 y la secuencia completa de aminoácidos de cadena ligera de acuerdo con la Tabla 42.
8. Un anticuerpo que se une a protofibrillas Aβ humanas, en el que el anticuerpo comprende una cadena pesada y una cadena ligera, en el que la cadena pesada comprende la secuencia de aminoácidos 158RHA en la Tabla 27 y la cadena ligera comprende la secuencia de aminoácidos 158RKA en la Tabla 38.
9. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que dicho anticuerpo comprende mutaciones en la cadena pesada (VH) de acuerdo con la Tabla 43, seleccionándose dichas mutaciones de E a D en la posición de Kabat 1, de A a P en la posición de Kabat 74 y de S a T en la posición de Kabat 82A, y/o mutaciones en la cadena ligera (VK) de acuerdo con la Tabla 44, seleccionándose dichas mutaciones de V a L en la posición de Kabat 3 y de P a G en la posición de Kabat 100, o combinaciones de estas mutaciones VH y VK.
10. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que dicho anticuerpo comprende la secuencia de cadena pesada completa de acuerdo con la Tabla 31 y la secuencia de cadena ligera completa de acuerdo con la Tabla 42, con la excepción de que en la cadena pesada se ha introducido la mutación S23A.
11. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 10, en el que dicho anticuerpo es humano o humanizado o ha mutado para reducir la antigenicidad en seres humanos.
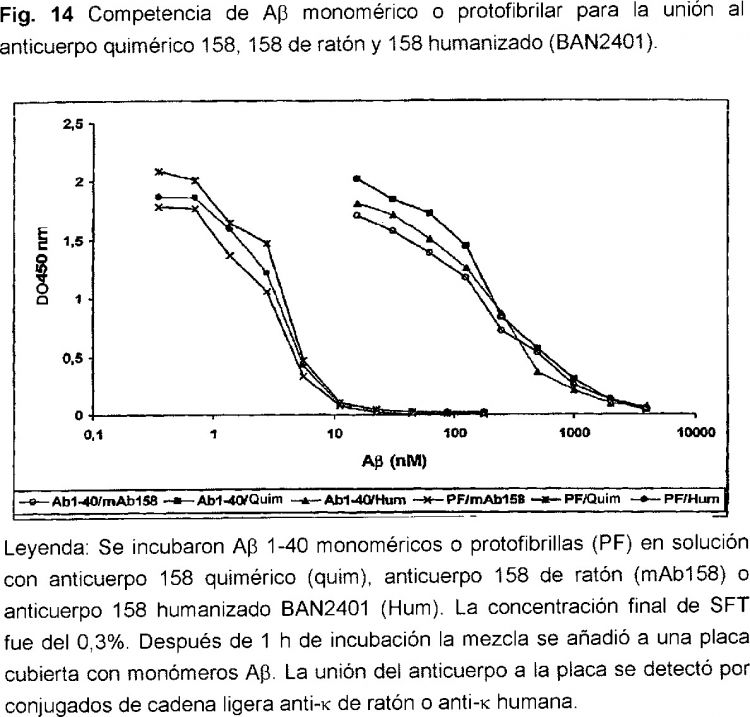
12. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 11, en el que la proporción especifica entre monómeros Aβ y protofibrillas es al menos de 1:200 como se determina por ELISA competitivo.
13. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1, 2, 4, 5 ó 6, en el que dicho anticuerpo es un anticuerpo de ratón.
14. El anticuerpo de acuerdo con la reivindicación 13, en el que dicho anticuerpo comprende la secuencia de cadena ligera completa codificada por la secuencia de ADN 158VK de acuerdo con la Tabla 11 y la secuencia de cadena pesada completa codificada por la secuencia de ADN 158VH de acuerdo con la Tabla 15.
15. Composición que comprende el anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 14 y un tampón farmacéuticamente aceptable.
16. La composición de acuerdo con la reivindicación 15, que comprende adicionalmente un agente anti-bacteriano.
17. La composición de acuerdo con la reivindicación 15 ó 16, en el que la composición esta liofilizada.
18. La composición de acuerdo con la reivindicación 17, en la que la composición esta liofilizada junto con un excipiente para aumentar la estabilidad del anticuerpo durante y después de la liofilización.
19. La composición de acuerdo con la reivindicación 18, en la que el excipiente es manitol o trehalosa.
20. Un método de detención de protofibrillas Aβ in vitro, que comprende las etapas de:
21. El método de acuerdo con la reivindicación 20, en el que dicho método de detección es un inmunoensayo.
22. El método de acuerdo con la reivindicación 20, en la que dicho método de detección es un ensayo de ligamiento por proximidad.
23. Un anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1-14 para su uso en un método de diagnostico de la enfermedad de Alzheimer, comprendiendo el método:
24. Un anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1-14 para su uso en un método de diagnóstico del síndrome de Down, demencia por cuerpos de Lewy o demencia vascular, comprendiendo el método:
25. El uso del anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1-14 o la composición de acuerdo con una cualquiera de las reivindicaciones 15-19 para la preparación de un medicamento para el tratamiento de la enfermedad de Alzheimer.
26. El uso del anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1-14 o la composición de acuerdo con una cualquiera de las reivindicaciones 15-19 por la preparación de un medicamento para el tratamiento del síndrome de Down, demencia por cuerpos de Lewy o demencia vascular.
27. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1-14 o la composición de acuerdo con una cualquiera de las reivindicaciones 15-19 para su uso en el tratamiento de la enfermedad de Alzheimer.
28. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1-14 o la composición de acuerdo con una cualquiera de las reivindicaciones 15-19 para su uso en el tratamiento del síndrome de Down, demencia por cuerpos de Lewy o demencia vascular.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]